附子为毛茛科植物乌头Acunitum carmichaelii子根的加工品,因其回阳救逆之功备受名家青睐[1],作为毒与效并存的药物,附子既可以强心,也可导致心脏毒性[2]。通常选用炮制,煎煮、限量来起到减轻附子毒性。甘草系豆科植物甘草Glycyrrhiza uralensis,胀果甘草Glycyrrhiza inflate或光果甘草Glycyrrhiza glabra的根及根茎除去杂质、洗净、润透并干燥的炮制品,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效[3]。临床用药过程中,附子常与甘草配伍以达到减毒增效的目的,但作用机制尚不明确[4-5],现阶段研究者对该药对配伍后药效成分含量变化及对肝脏细胞色素P450酶(cytochrome P450,CYP450)的改变等角度进行了大量实验[6],本课题组前期在肝脏角度下进行甘草与附子配伍调控CYP450系统减轻肝毒性研究,发现在转录水平通过下调CYP1A2,CYP3A1 mRNA的表达,代谢减慢,使有毒成分乌头碱在体内蓄积时间延长,毒性增加;甘草与附子配伍后可上调CYP1A2,CYP3A1 mRNA表达,减少乌头碱在体内的蓄积时间,起到减毒的作用[7-10]。但从心脏细胞色素P450酶学角度考虑配伍产生的相互作用的报道较为少见。
相关研究显示心脏细胞色素P450代谢酶与心血管疾病的发生具有相关性,心脏CYP450途径主要分为CYP表氧化酶和CYP ω-羟化酶2种途径[11]。花生四烯酸(arachidonic acid,AA)通过CYP表氧化酶催化产生具有心血管保护作用的环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs),主要包含5,6-EET;8,9-EET;11,12-EET和14,15-EET这4种异构体;而CYP ω-羟化酶可催化产生代谢产物20-羟-二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE),该物质在心肌细胞肥大时浓度升高,提示抑制CYP ω-羟化酶可对心脏起到保护作用[12-13]。本文研究了附子单用及与甘草配伍后对大鼠心肌酶,组织病理及心脏CYP450酶mRNA表达的影响,进一步从心脏CYP系统阐释附子与甘草配伍的减毒增效作用。
1 材料
1.1 动物
健康SD大鼠,雄性,6~8周龄,体质量(200±20)g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2013-0035。动物饲养于中国中医科学院中药研究所SPF级动物房,其使用许可证号SYXK(京)2015-0041。饲养条件为12 h明暗交替,温度(23±1) ℃,湿度(50±15)%,自主饮水及进食。本实验所进行的所有相关操作均在中国中医科学院中药研究所动物伦理委员会的批准下进行,批准号20172001。
1.2 药品与试剂
附子和甘草均购于安国市同利中药材有限公司,由军事医学科学院李鲁教授鉴定,附子为毛茛科多年生草本植物乌头A. carmichaelii的子根,甘草为豆科植物甘草G. uralensis的根及根茎;苯巴比妥(50 mg,北京百灵威公司,批号H948960),天门冬氨酸氨基转移酶(AST)试剂盒,肌酸激酶(CK)试剂盒和乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所,批号分别为C0010-2,A032,A020-2);cDNA反转录,实时荧光定量聚合酶链式反应(Real-time PCR)试剂盒(北京全式金公司,批号分别为L21011,M40517);苏木素-伊红(HE)染色试剂盒(珠海贝索生物技术有限公司,批号2018051),苯巴比妥及其他试剂均为国产分析纯。
1.3 仪器
98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);RE-52A型旋转蒸发器(上海亚荣生化仪器厂);Finesse 325型切片机,Excelsior ES型全自动脱水机,Histocentre3型石蜡包埋机,Varistain Gemini ES型全自动染色机,NANODROP ONE型核酸浓度测定仪(美国Thermo公司);LightCycler® 480型Real-time PCR仪(瑞士Roche公司);VICTOR X型多标记酶标仪(美国Perkin Elmer公司)。
2 方法
2.1 药物准备
附子水提液的制备:取附子,粉碎,置于圆底烧瓶中,加入8倍量去离子水,浸泡8 h,待煮沸后加热回流提取30 min,4层纱布滤过,回流提取2次,合并提取液,减压浓缩至生药质量浓度0.05 g·mL-1,4 ℃保存,备用。
甘草水提液的制备:取甘草,粉碎,置于圆底烧瓶中,加入8倍量去离子水,浸泡8 h,待煮沸后加热回流提取30 min,4层纱布滤过,回流提取2次,合并提取液,减压浓缩至生药质量浓度0.05 g·mL-1,4 ℃保存,备用。
附子-甘草水提液的制备:取附子、炙甘草粉碎,甘草-附子1∶1混匀[14],置于圆底烧瓶中,加入8倍量去离子水,浸泡8 h,回流提取30 min,用4层纱布滤过,回流提取2次,合并提取液,减压浓缩至生药质量浓度0.05 g·mL-1,4 ℃保存,备用。
2.2 动物分组与给药
动物到达后适应性观察3 d,按体质量随机分为5组,包括空白组,苯巴比妥组,附子组,甘草组和附子-甘草组,每组6只。药物根据2015年版《中国药典》(一部)规定的临床剂量[3]按体表面积换算成大鼠剂量。空白组给予生理盐水;苯巴比妥组(0.08 g·kg-1·d-1)连续腹腔注射给药4 d;附子组(0.5 g·kg-1·d-1),甘草组(0.5 g·kg-1·d-1)和附子-甘草组(0.5 g·kg-1·d-1)连续灌胃给药8 d。全部大鼠于末次给药后禁食不禁水16 h。
2.3 血清心肌酶活性检测
实验结束后,麻醉打开大鼠腹腔,用采血管自下腔静脉采血5 mL,室温放置1~3 h,4 ℃,3 000 r·min-1离心15 min,上清放入-20 ℃冰箱冻存备用,取血清200 μL,测定血清中AST,CK,LDH水平变化,具体操作应严格按试剂盒说明书进行。
2.4 肝脏组织切片HE及病理学观察
将4%甲醛浸泡过心脏组织经脱水、包埋,制成4 μm的石蜡切片,行HE染色,常规显微镜下观察组织病理学变化并记录。
2.5 Real-time PCR检测心CYP mRNA表达
取空白组,苯巴比妥组,附子组,甘草组和附子-甘草组的大鼠心脏50~100 mg,利用RNA提取试剂盒,按照说明书提取心脏总RNA,紫外分光光度计检测RNA浓度和纯度(吸光度A260 nm/A280 nm 1.8~2.0)。取总RNA 1 μg逆转录成cDNA后进行Real-time PCR检测,PCR反应条件为预变性95 ℃ 20 s,95 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,共40个循环,以各目标基因2-ΔΔCt值表示各目标mRNA相对表达水平,特异性引物序列由北京博迈德公司合成,见表1。
| 引物 | 上游序列/5′-3′ | 长度/bp | 下游序列/5′-3′ | 长度/bp |
|---|---|---|---|---|
| CYP2B1 | GGCCTCCTCAATTCCTTC | 18 | TGTCTGTCCCACATAGCAT | 19 |
| CYP2C11 | CACCAGCTATCAGTGGATTTGG | 22 | GTCTGCCCTTTGCACAGGAA | 20 |
| CYP2E1 | TCTGCTCCTGTCTGCTATT | 19 | GTGGGATACTGCCAAAGC | 18 |
| CYP2J3 | CATTGAGCTCACAAGTGGCTTT | 22 | CAATTCCTAGGCTGTGATGTCG | 22 |
| CYP4A1 | TTGAGCTACTGCCAGATCCCAC | 22 | CCCATTTTTGGACTTCAGCACA | 22 |
| CYP4A3 | CTCGCCATAGCCATGCTTATC | 21 | CCTTCAGCTCATTCATGGCAATC | 23 |
| CYP4F1 | CCCCCAAGGCTTTTTGATG | 19 | GAGCGCAACGGCAGCT | 16 |
| CYP4F5 | AGGATGCCGTGGCTAACTG | 19 | GGCTCCAAGCAGCAGAAGA | 19 |
| CYP4F6 | TCACTTGACCTTGATGAAGAACAAC | 25 | AAGAGAGGTGGATATCACGGAAC | 23 |
| β-actin | CCAGATCATGTTTGAGACCTTCAA | 24 | GTGGTACGACCAGAGGCATACA | 22 |
2.6 统计学方法
所有数据重复3次,结果采用
3 结果
3.1 附子与甘草配伍对大鼠心肌酶的影响
与正常组比较,苯巴比妥组AST,CK水平的升高(P<0.05);附子组AST,CK,LDH水平升高(P<0.05,P<0.01),表明附子产生心肌损伤作用;附子-甘草组与附子组比较,心肌酶含量下降,但未出现统计学差异,提示甘草削弱了附子的心脏损失作用,见表2。
| 组别 | 剂量/g·kg-1 | AST | CK | LDH |
|---|---|---|---|---|
| 空白 | - | 39.17±19.83 | 4 369.17±1 727.88 | 1 532.83±247.11 |
| 苯巴比妥 | 0.08 | 67.00±9.861) | 5 917.50±800.84 1) | 1 784.17±143.21 |
| 附子 | 0.5 | 67.00±14.971) | 5 913.17±1 519.901) | 2 605.17±370.182) |
| 甘草 | 0.5 | 46.00±40.03 | 4 795.17±1 572.67 | 1 780.83±213.72 |
| 附子-甘草 | 0.5 | 51.83±26.27 | 4 983.33±1 147.48 | 1 768.83±172.72 |
3.2 附子与甘草配伍对大鼠心脏病理学的影响
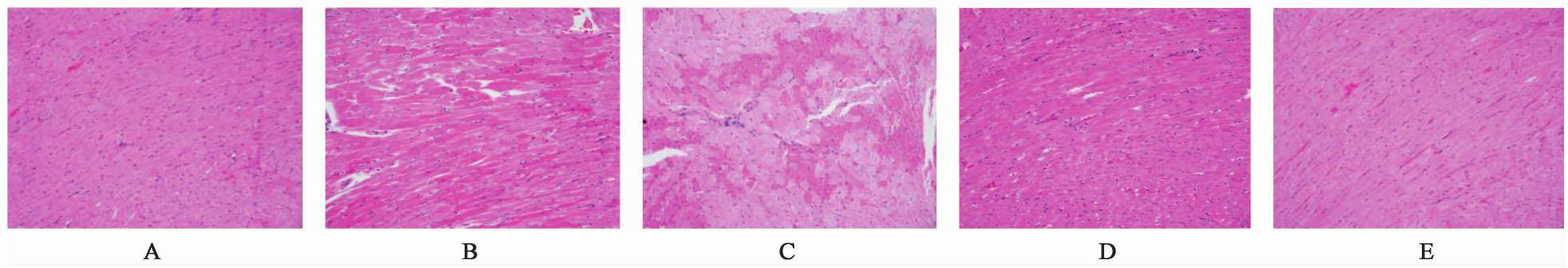
心脏病理学检测发现空白组、甘草组、附子-甘草组心肌纤维排列整齐,偶见灶性心肌纤维均质红染,间质未见炎症细胞浸润,组织结构正常。附子组、苯巴比妥组可见局灶性或小片状心肌纤维均质红染,嗜酸性变,其余未见异常变化。本实验中,附子-甘草配伍后,心脏的病理变化与附子组比较灶性心肌纤维均质红染程度减轻,心肌纤维排列整齐,表明甘草可以减轻附子毒性,对心脏起到保护作用,见图1。
3.3 附子与甘草配伍对大鼠心CYP mRNA表达的影响
与空白组比较,苯巴比妥作为肝药酶诱导剂,对CYP2家族mRNA表达具有诱导作用(P<0.05,P<0.01)。与空白组比较,附子组、甘草组和附子-甘草组能不同程度地诱导CYP2B1,CYP2C11 mRNA表达(P<0.05);附子组能上调CYP2E1 mRNA表达(P<0.05),甘草组能上调CYP2J3 mRNA表达(P<0.05),与附子组相比,附子-甘草配伍后能上调CYP2J3 mRNA表达(P<0.05),见表3。
| 组别 | 剂量/g·kg-1 | CYP2B1 | CYP2C11 | CYP2E1 | CYP2J3 |
|---|---|---|---|---|---|
| 苯巴比妥 | 0.08 | 5.00±0.912) | 6.55±1.112) | 4.09±0.771) | 2.83±0.142) |
| 附子 | 0.5 | 2.37±0.331) | 1.68±0.381) | 2.72±0.591) | 0.87±0.16 |
| 甘草 | 0.5 | 2.52±0.701) | 1.78±0.551) | 1.69±0.50 | 1.54±0.171) |
| 附子-甘草 | 0.5 | 3.05±0.291) | 1.76±0.271) | 2.65±0.74 | 1.57±0.243) |
甘草对CYP4家族中CYP4A1,CYP4A3,CYP4F1,CYP4F5,CYP4F6 mRNA表达无影响,附子能诱导CYP4家族中CYP4A1,CYP4A3,CYP4F1,CYP4F5,CYP4F6 mRNA表达(P<0.05,P<0.01);与附子组相比,附子-甘草配伍后能下调CYP4家族mRNA表达(P<0.05,P<0.01),见表4。
| 组别 | 剂量/g·kg-1 | CYP4A1 | CYP4A3 | CYP4F1 | CYP4F5 | CYP4F6 |
|---|---|---|---|---|---|---|
| 苯巴比妥 | 0.08 | 1.61 ±0.011) | 1.04 ±0.07 | 1.16 ±0.09 | 1.80 ±0.051) | 1.20 ±0.10 |
| 附子 | 0.5 | 2.43±0.661) | 2.05±0.012) | 2.45±0.062) | 2.48±0.022) | 1.81±0.042) |
| 甘草 | 0.5 | 1.11±0.23 | 0.71±0.12 | 0.94±0.11 | 1.05±0.08 | 0.93±0.10 |
| 附子-甘草 | 0.5 | 1.94±0.281) | 1.44±0.004) | 1.33±0.131,3) | 1.57±0.121,3) | 1.50±0.091,3) |
4 讨论
附子因具有回阳救逆之效,因疗效显著,使用广泛,但作为毒与效并存的药物,使用不当会引发严重的毒性反应,特别是对心脏的毒性。临床常以甘草配伍附子,既能缓“附子之性急”,又能解“附子之性毒”,代表方有四逆汤、甘草附子汤等[15]。
在外界多种生理或病理刺激下,磷脂酶A2分解细胞磷脂成分释放AA,AA作为一种不饱和脂肪酸,广泛存在于心血管及肾脏系统中,涉及多种细胞的信号转导与信号通路的调节,主要有环氧化酶(cyclooxygenase,COX)途径,脂氧酶(lipoxygenase,LOX)途径与CYP途径这3种代谢途径。细胞色素P450酶是血红蛋白家族基因编码的蛋白,作为重要的I相代谢酶系,涉及体内众多内源性与外源性物质的生物转化[16]。在CYP途径中,AA代谢生成EETs的过程中CYP1A,CYP2B,CYP2C,CYP2J,CYP4A,CYP4F等亚家族均有不同程度地贡献。
通过检测大鼠心脏心肌酶,心脏病理组织学变化和基因转录水平变化来阐释基于心脏CYP450水平的附子-甘草配伍减毒增效作用机制。AST,CK,LDH为临床最常应用判断心肌是否出现损伤的指标,在细胞胞质中大量分布着AST,CK,LDH,在心肌出现缺血时,细胞能量降低,代谢产物蓄积,细胞损伤及细胞生物膜通透性增加导致细胞胞质酶的释放,灌注时钙超载及氧自由基造成生物膜进一步损伤,促AST,CK和LDH大量漏出。同时CK和LDH在心肌细胞中的具有特异性且含量最高,因此该指标在临床上对于心肌损伤具有显著的敏感性[17-18]。本研究结果显示,附子组AST,CK,LDH含量的升高,说明附子对心脏产生损伤作用,配伍后心肌酶含量下降,推断甘草可缓解附子引起的心脏毒性。
大鼠心脏病理学观察发现,甘草组、附子-甘草组心肌纤维排列整齐,偶见灶性心肌纤维均质红染,间质未见炎症细胞浸润,组织结构正常。附子组、苯巴比妥组可见局灶性或小片状心肌纤维均质红染,嗜酸性变,其余未见异常变化;附子配伍甘草后,心脏的病理变化与附子组比较灶性心肌纤维均质红染程度减轻,心肌纤维排列整齐,证明甘草可以减轻附子产生的心脏毒性。
在基因转录水平心脏CYP450酶主要包括2家族与4家族,其中表氧化酶CYP2J3, CYP2C11主要负责将花生四烯酸代谢生成EETs,且CYP2J3在心脏特异性高表达,EETs作为一种心血管活性物质,可以舒张血管,参与血压调节,促血管生成,改善冠状动脉(冠脉)微循环,调节心肌细胞收缩,保护缺血心肌等心脏保护作用。实验结果显示,甘草组能不同程度地上调CYP2C11和CYP2J3 mRNA的表达,附子组下调CYP2J3 mRNA表达,甘草与附子配伍后能上调CYP2J3 mRNA表达,结果推测配伍可促进AA代谢生成EETs。同时ω-羟化酶CYP4A1和CYP4F1主要负责将AA代谢生成20-HETE,其主要参与机体血管收缩、心肌细胞凋亡、冠脉血流量等,在高血压、冠心病等心血管疾病的发生发展中发挥着极为重要的作用[19-22]。本文实验结果显示,附子能上调CYP4家族中CYP4A1,CYP4A3,CYP4F1,CYP4F5,CYP4F6 mRNA表达,推测其能促进20-HETE的生成。附子与甘草配伍后能削弱附子下调CYP4A3与CYP4F1,CYP4F5,CYP4F6家族mRNA表达的能力,抑制20-HETE的生成,减轻由附子产生的心脏毒性。
综上所述,本实验基于心脏CYP450酶角度来阐释附子与甘草配伍后降低附子毒性的作用机制。从而为揭示传统中药配伍理论科学内涵提供数据依据,同时为心血管疾病的治疗提供新的可能途径或靶点,提高中药复方临床使用的有效性和安全性,并为推动中药研究的现代化提供新思路。

