在传统中医理论中,“火”(包括温、热)为阳盛之气所化生,作者的团队长期从事“上火”的科学内涵研究,提出“上火”是一种生理过程中不协调的应激性反应,是失去机体内环境稳定状态的身心疲劳综合症[1]。从“上火”到形成疾病是一种包括中枢神经、内分泌及免疫系统的复杂应激负荷反应过程[2]。情志应激、燥热环境、嗜食辛辣等因素均会造成“上火”,其中情志应激导致的上火,即“五志过极化火”是最重要的因素之一,如最常见的“肝郁化火”。
“肝郁化火”是情志致病理论的核心内容之一,是一种病机,也是一种证候,是指情志不遂,引起肝气郁结,进而影响机体阴阳和脏腑的生理平衡,日久从阳化热,导致火热内生,出现“上火”的状态。肝经气火上逆所表现的症状,具有气火上冲,头面部热象等显著特征。“肝郁化火”最常见的症状有口舌生疮、目赤、咽痛、口干、口腔溃疡、牙龈肿痛、溲赤、胸胁肋痛、便秘等[3]。“肝郁化火”广泛存在于各种相关疾病的病理过程中,是情志致病病机转变的关键环节,是疏肝解郁、清肝泻火中药辨证论治的重要指导原则,因此阐明“肝郁化火”的科学内涵及生物医学基础具有重要意义。然而,由于具备中医证型特点动物模型的缺乏,限制了“肝郁化火”的生物医学基础研究,影响了相关中药作用机制的研究进展。
本文对近年国内外相关文献及本课题组的研究进行总结和分析,从情志应激导致潜伏Ⅰ型单纯疱疹病毒(herpes simplex virus-1,HSV-1)复发感染角度建立“肝郁化火”的研究模型,阐明“肝郁化火”病理过程中的效应分子、效应靶标与机制通路,以期为疏肝泻火等清热中药提供药效表征的方法参考。
潜伏HSV-1复发的“肝郁化火”实验动物模型
当人体遭遇精神刺激或情志不遂,肝首当其冲受累。气机郁滞导致肝气郁结,日久化火,使机体神经、内分泌、免疫系统出现应激负荷反应,引发神经-体液代谢处于失调状态,导致各种疾病的“易感性”增加。例如急火攻心会引发心脑血管疾病的突发,持续“上火”会加速神经退行性疾病进程,引起肿瘤发病率增加等[4-5]。对于病毒感染性疾病,本来应是耐受的人群可能因为机体处于“肝郁化火”的状态而转变为易感人群。其中,由HSV-1复发引发的口唇疱疹(中医称“热疮”)是情志应激致“肝郁化火”最为常见的病症之一[6]。
HSV-1的感染在人群中普遍存在,大多数感染发生于儿童时期并终生存在于体内。根据世界卫生组织(WHO)2020年数据,全球约有37亿50岁以下的人(67%)感染HSV-1,中国人群的潜伏感染率在90%以上。人类是HSV-1唯一的天然宿主,原发感染的病毒通过病毒粒子融合侵入轴突末端后,逆行运输至三叉神经元细胞核中建立潜伏[7]。在潜伏期,病毒以游离的异染色质态环状DNA存在于神经元中,此时大部分病毒基因组沉默,只转录一系列潜伏相关mRNAs,如潜伏相关转录子(latency associated transcript,LAT)。当机体受到刺激时,病毒会被重新激活并复制,随后沿轴突顺行至神经末梢,感染临近的上皮细胞,引起颜面部复发性病变[8]。
当人体阴阳平衡,气机调畅,HSV-1潜伏在神经元胞体中,不引起任何症状;当机体处于情志应激状态,肝失疏泄,气机不畅,久而化火,导致阳热亢盛,气火上冲,围绕肝经巡行至头面部位如眼、口唇皮肤黏膜交界处,反复出现成群小疱并伴有刺痛、发红、肿胀、发痒或灼热感,充满液体的水泡形成后可迅速破溃,遗留溃疡并结痂等症,严重者可进一步引发角膜炎、脑炎等其他严重疾病[9]。因此,以“肝郁化火”证的头面部症状为研究对象,发现其口唇热疮、面红目赤、头痛耳鸣等症状,与HSV-1复发的症状有相通之处,且其复发的头面部部位与中医经络肝经的头面循行部位表里对应(图1)。因此,认为“肝郁化火”时颜面部火热症状的部分病理过程,与情志应激诱发潜伏HSV-1激活的复发引起的头面部症状有关,采用情志应激诱导潜伏HSV-1激活可以建成“肝郁化火”病证结合的研究模型[10]。
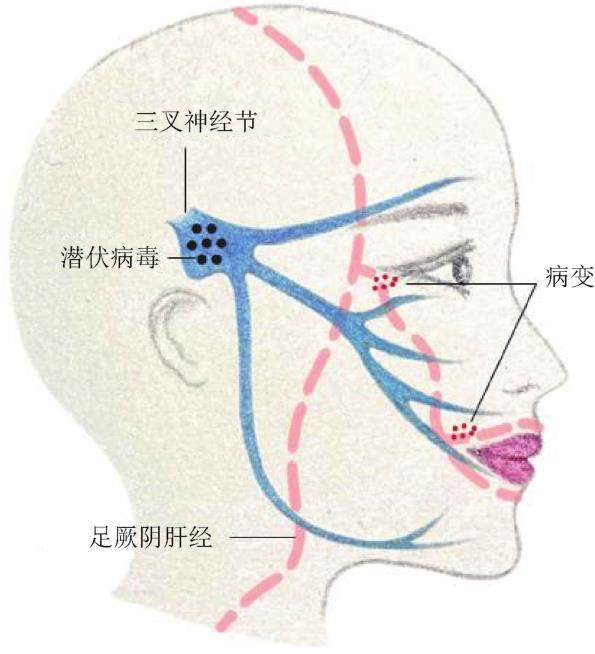
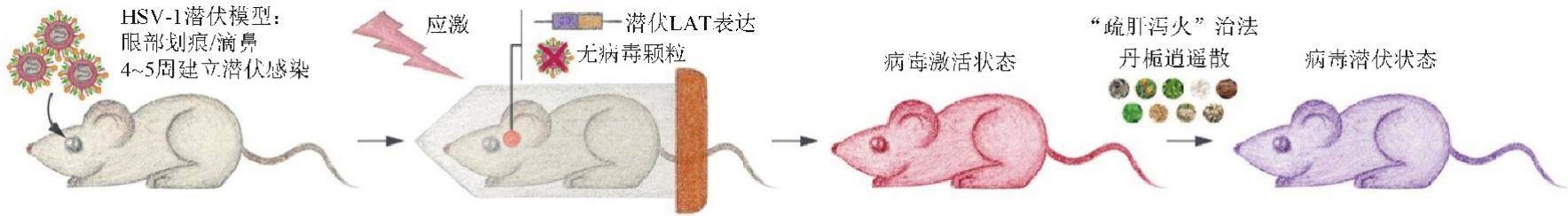
课题组成功建立了拘束应激诱导潜伏HSV-1激活的动物模型,对模型的病证结合特点进行分析(表1),并采用疏肝泻火经典方剂丹栀逍遥散针对这一模型进行了干预研究(图2)。该模型小鼠口唇、眼部能出现明显的炎症反应,尤其眼部的炎症表型,与临床的疱疹病毒复合细菌性感染的眼部炎症表现一致。综合分析表明,该模型具有“肝郁化火”的证候特点,可有效用于“肝郁化火”证生物医学基础研究,也可以用于评价清热类中药的药效[11-12]。有学者采用单纯细菌或者脂多糖(LPS)诱导葡萄膜炎作为肝火证模型来评价中药药效[13],但是这类模型缺乏情志应激因素引起内热化火的过程,应该更适合中药的抗菌和抗炎的药效评价。
| 分类 | 中医 | 西医 |
|---|---|---|
| 临床表型 | 热疮、目赤、头痛、耳鸣、脸红 | 口唇疱疹、角膜炎症、三叉神经痛 |
| 诊断标准 | 症状+病毒检测 | 症状+病毒检测 |
| 治疗原则 | 疏肝解郁、清肝泻火 | 抗病毒 |
| 治疗药物 | 丹栀逍遥散等疏肝清热中药 | 阿昔洛韦、伐昔洛韦等 |
基于潜伏HSV-1复发的“肝郁化火”模型的机制研究进展
情志应激通过应激激素调控潜伏期HSV-1再激活
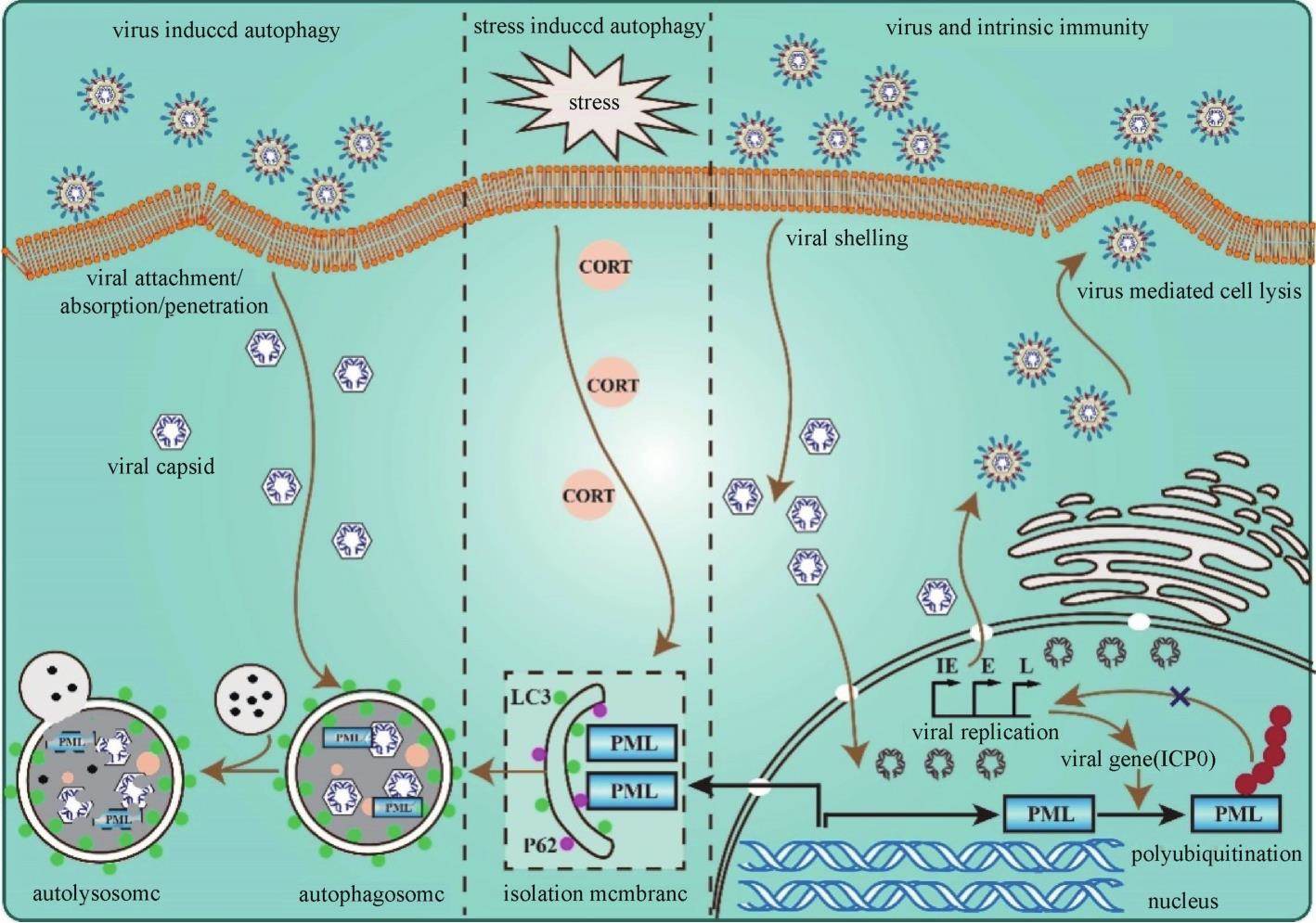
中医“肝郁”的状态属于情志应激范畴,这种情志的应激状态会显著影响机体神经中枢皮层和边缘系统,以及下丘脑-垂体-肾上腺(HPA)轴的神经递质、神经肽、激素、基因表达等多个方面,导致机体神经-免疫轴各系统中细胞的氧化应激损伤。HSV-1的再激活过程受到这一系统的调控,特别是受应激激素的影响,如糖皮质激素corticosterone(CORT)和甲状腺激素等[14-15]。应激激素作为诱导HSV-1易感的首级效应分子,其升高能促进宿主细胞内糖皮质激素调节蛋白激酶1(serum and glucocorticoid-regulated protein kinases 1,SGK1)的表达促进HSV-1的增殖复制[16]。早幼粒细胞白血病蛋白(promyelocytic leukemia,PML)作为内在免疫的主要成员,在基因组稳定性、程序性细胞死亡和肿瘤发展中发挥作用的同时,也对机体抵抗病毒感染至关重要[17-18]。课题组进一步的研究发现,PML的自噬性降解在情志应激诱发HSV-1易感性中扮演着重要角色:应激激素通过激活自噬,促进天然免疫蛋白PML与自噬标志物LC3和自噬受体P62的相互作用从而使PML蛋白发生自噬性降解,最终导致病毒复制增加(图3)[11]。实际上,自噬与HSV-1之间存在复杂的交互作用。一方面,应激激活的自噬能清除HSV-1[19];另一方面,激活的自噬也可以延长宿主细胞的生存并为HSV-1的复制提供有利的环境[20];鉴于应激激活的自噬与应激诱导的HSV-1易感这两者之间存在精细的调控网络,相关的分子生物学机制仍有待深入研究。
甲状腺激素在HSV-1的激活复发中也起到了很重要的作用。甲状腺激素能通过甲状腺激素受体β1激活LAT的转录,抑制早期蛋白ICP0的表达,并将抑制性组蛋白H3K9me3和H3K9me2募集至HSV-1胸腺激酶的启动子[21],阻断病毒基因的表达,抑制病毒的重激活。在应激状态下,HPA轴受到抑制,甲状腺激素的分泌大幅度减少,无法有效对HSV-1的基因沉默,从而引起HSV-1激活复发[22]。
情志应激诱导免疫紊乱导致潜伏HSV-1再激活
当HSV-1病毒在人体内潜伏的时候,病毒已进化出多种免疫逃逸策略,使机体在病毒和宿主细胞之间达到新的“阴阳平衡”。在这种状态下,HSV-1静息地驻留在受感染细胞的细胞核中,不产生感染性病毒子代。当人体情志抑郁不畅,肝失疏泄,气机郁滞,久而化火,干扰阴阳平衡,机体的免疫功能会受到显著影响。有研究表明肝气郁结会导致人体免疫机能低下,出现T淋巴细胞的增殖能力下降,其增殖指数明显降低,IL-4细胞因子的含量明显降低,Th细胞向Th1向偏移[23]。肝郁动物模型的胸腺指数、脾脏指数和脾淋巴细胞数目也显著降低,脾淋巴细胞亚群Th(CD3+CD4+)(辅助性T淋巴细胞)/Ts(CD3+CD8+)(抑制性T淋巴细胞)的比值和脾自然杀伤(NK)细胞活性降低[24]。这就导致在肝郁化火的情况下,病毒和宿主细胞之间的阴阳平衡被打破,导致病毒复发感染。有研究显示[25]复发性唇疱疹病毒的患者外周血淋巴细胞中Th17细胞、CD4+CD25+Treg细胞、Foxp3+Treg细胞含量显著升高,IL-2、IL-10和TGF-β含量显著升高,也提示患者机体处于免疫功能紊乱的状态。
课题组以往的研究也证明,拘束应激能够抑制实验动物的免疫功能,从而增加病毒感染的易感性和感染的严重程度[26-28]。正常情况下,接种H1N1流感病毒的小鼠发病率约为30%,而拘束应激处理22 h的小鼠发病率高达100%[29];其生存曲线、肺指数、病毒核蛋白水平和免疫组化结果显示疾病严重程度显著增加[30-31]。进一步研究发现应激小鼠线粒体抗病毒信号蛋白(MAVS)水平、自然杀伤细胞(NK)活性和T细胞活性下降,表明先天免疫和适应性免疫均明显受损[32-33]。对于HSV-1来说,情志应激导致的肝郁化火同样可抑制机体对HSV-1的固有和适应性免疫应答[34],包括NK细胞活性、HSV特异性CD8+T细胞数量和活性、免疫相关细胞因子水平和淋巴细胞浸润,进而增加感染神经元的数量,导致病毒子代的增加和复发性损伤的加重。这与情志应激后血中糖皮质激素浓度升高有关。糖皮质激素可通过其受体,抑制干扰素调节因子3(IRF3)磷酸化和IFN-β的减少[16]。也有研究显示,在HSV-1潜伏感染情况下,TRIM14可能会裂解cGAS合成酶的泛素链,阻止其通过自噬被降解,最终增强IFN信号通路,从而提高免疫应答[35]。另外,潜伏在三叉神经节中HSV-1导致特异性CD8+T细胞数量减少[36],与鼻咽有关的淋巴组织中的gB-CD8+特异性T细胞数量也减少,使其分泌IFN-γ和granzyme-B能力下降,从而引起HSV-1激活复发[37]。此外,糖皮质激素还抑制NK细胞和DC细胞活性,从而损害免疫功能,导致病毒基因表达增加[38]。还有文献显示[39],在病毒进入潜伏期的过程中,Treg细胞通过抑制抗病毒的CD8+T细胞功能,给病毒提供了机会,而当机体在应激状态下,大脑通过分泌糖皮质激素,可提高Treg细胞的水平和功能,从而抑制了抗病毒CD8+T细胞功能,导致HSV-1从潜伏状态进入到再激活和复发状态。同时,研究者发现干扰素基因刺激蛋白(stimulator of interferon genes,STING)在感染期间病毒脑内免疫逃逸的过程中起到了关键作用[40]。
情志应激诱导氧化应激促进潜伏HSV-1再激活
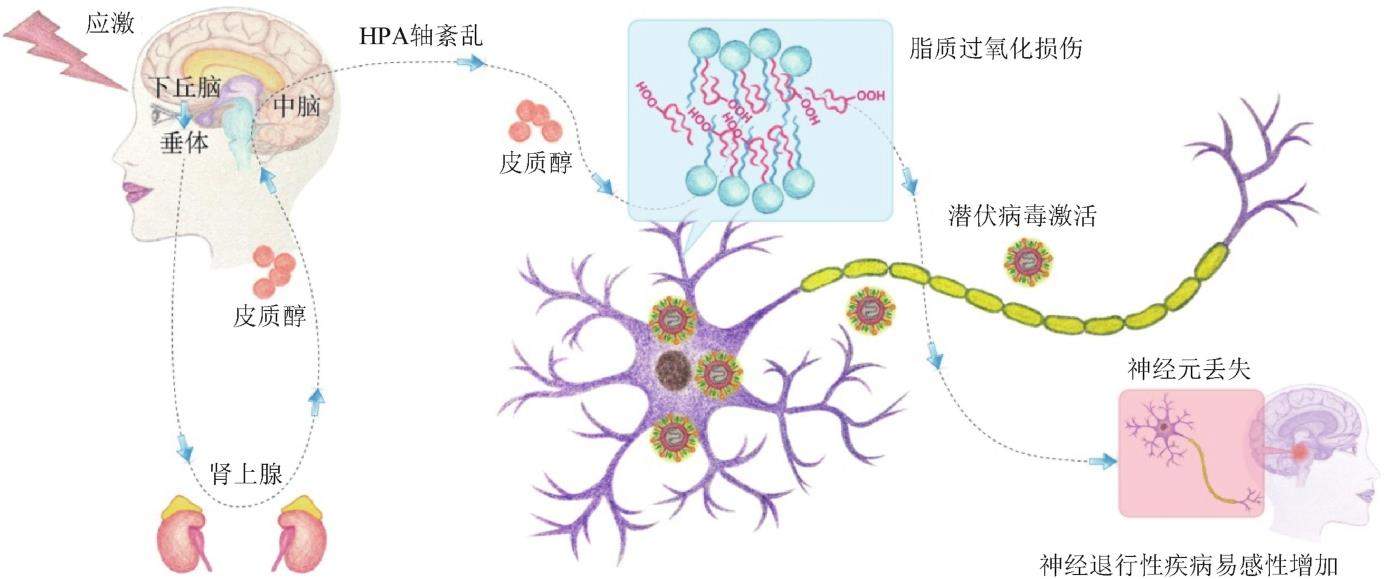
当机体处于情志应激状态时,细胞内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)等产生过多,攻击生物膜中的不饱和脂肪酸而引发脂质过氧化反应,当机体抗氧化能力相对不足,就导致脂肪酸链和细胞膜完整性的破坏,损伤生物大分子、细胞和生物体组织[3]。当机体受到应激刺激,邻近的轴突末端中的线粒体产生ROS,抑制mTOR的活性,降低Bcl-2的表达水平,产生凋亡信号,诱导病毒基因的级联表达,并且快速装配成成熟的病毒颗粒,感染新的细胞,从而延续其生存[41]。课题组的研究表明[42],拘束应激诱导的“肝郁化火”模型能引起细胞的氧化应激,尤其是导致免疫细胞的氧化损伤,使线粒体功能受损,线粒体抗病毒蛋白(MAVS)解聚从而抑制IFN-I的表达通路,进而引起HSV-1潜伏激活。HSV-1与神经/大脑退行性疾病的交互作用逐渐成为近年的研究热点,病毒从皮肤、黏膜中逆向进入(大脑)神经元潜伏。大脑神经元的谷胱甘肽含量较少,清除自由基的能力较弱;并且大脑神经元的细胞膜中含有大量不饱和脂肪酸,极易被氧化[43]。此类氧化损伤导致神经元中核酸、脂质和蛋白质的氧化,最终导致神经元凋亡或退化[44],同时引起潜伏的HSV-1病毒复制激活,激活胶质细胞并释放炎症因子,诱发运动神经元的损伤[45]。另一方面,神经元中丰富的不饱和磷脂(PUFA-PLs)受到氧化自由基的攻击被氧化成oxPUFA-PLs,oxPUFA-PLs是细胞发生铁死亡的主要脂质信号分子[46]。本课题组前期建立了基于LC-MS/MS的氧化脂组学分析技术,可快速鉴定和定量细胞中的氧化型脂质。研究发现,在肝郁化火的应激状态下,激活的HPA轴能引起神经元发生脂质过氧化损伤(图4)。神经元中的不饱和磷脂(PUFA-PLs)被氧化成oxPUFA-PLs,会诱发神经元发生铁死亡,进而增加脑部疾病,尤其是神经退行性疾病,例如帕金森病(Parkinson′s disease)和阿尔茨海默病(Alzheimer′s disease)的易感性。因此,肝郁化火的症状让人感觉微不足道,但是长期反复“上火”(潜伏HSV-1反复激活)则会引起一些重大疾病的易感性增加。
情志应激诱导潜伏HSV-1激活模型在清热中药药效评价中的应用
在中医理论中,肝为藏血之脏,血属阴,故肝体为阴;肝主疏泄,性喜条达,内寄相火,主升主动,故肝用为阳[3]。由于肝脏具有体阴而用阳的特点,在临床上对于肝病的治疗,“用药不宜刚而宜柔,不宜伐而宜和”(《类证治裁·卷之三》)。对于肝郁气滞、肝郁化火引起的各种疾病,主要的治则为疏肝解郁、清肝泻火。研究显示对表现为“肝郁化火”证型的多种疾病采用丹栀逍遥散[47]、逍遥散加减[48]等疏肝降火的方剂取得了良好效果;从郁论治“上火”,即通过疏通气机、调畅情志来治疗“上火”,为“上火”的治疗提供了新的思路[49-50]。在课题组开展“肝郁化火”动物模型研究之前,此类中医证型动物模型缺乏,限制了“肝郁化火”的生物医学基础研究,影响了相关中药作用机制的研究进展。作者课题组发现HSV-1体内外潜伏激活的研究模型,非常适合模拟“肝郁化火”的病理状态。通过拘束应激建立的HSV-1易感的原发和潜伏感染的动物模型[10],并基于“以方测证”在证候模型中应用的依据,采用疏肝泻火方剂针对模型进行干预。除了前面提到的丹栀逍遥散[10],还发现九节茶及其主要药效成分迷迭香酸可显著降低应激诱导的HSV-1易感性,其作用机制与靶向性抑制ALOX15介导的细胞及线粒体脂质过氧化水平有关[51]。此外,中药成分黄芩素对HSV-1/F和HSV-1/Blue(阿昔洛韦耐药株)的复制均有效;在小鼠眼部接种模型中,黄芩素显著抑制体内HSV-1/F复制,降低病毒感染诱导的炎症风暴和角膜组织学病变,提高小鼠生存率,其作用机制与黄芩素对病毒颗粒的灭和抑制IκB激酶(IKK-β)磷酸化的抑制作用有关[52]。同时,课题组系统分析了当前报道具有抗疱疹活性的天然产物小分子化合物,发现这些化合物多数来自清热类中药[12]。上述结果表明,情志应激诱导潜伏HSV-1激活模型,能有效地用于清热中药的药效表征,也可以揭示该类中药的效应活性成分。当然,在实践中也发现该模型存在建模时间较长等不足之处,需要在未来的研究进一步完善和改进。
总结
随着现代社会工业化和经济化的快速发展,生活节奏加快,人们承受的压力越来越大,随之产生的情志心理应激负荷导致的健康问题日趋明显。“情志致病”是中医基础理论的重要组成部分,情志心理应激,作为人类多种疾病的重要病因和诱因在现代研究中也逐步得到确认。本文从“肝郁化火”的中医基础病机出发,总结和探讨了情志应激导致潜伏的HSV-1激活复发病理过程中的机制通路研究进展,对“上火”之“肝郁化火”的科学内涵进行了补充。“肝郁化火”是情志致病的典型病机,所述研究进展对于多种包含此病机的疾病的中医药防治提供了一定的理论依据;情志应激导致潜伏HSV-1激活这一模型,也可为疏肝解郁,清肝泻火类临床常用中药提供药效表征的方法参考。

