支气管哮喘是由多种细胞及细胞组分参与的气道慢性炎症性疾病,主要特征包括气道对多种刺激因素呈现的高反应性,广泛多变的可逆性气流受限以及随病情延长而导致的一系列气道结构改变[1],临床表现为反复发作的喘息、气急、胸闷或咳嗽等症状,常在夜间及凌晨发作或加重。目前全球至少有3亿哮喘患者,其患病率呈逐年上升的趋势[2]。临床常用糖皮质激素及β2受体激动剂等药物治疗[3]。厚朴麻黄汤出自《金匮要略》[4],由厚朴、麻黄、苦杏仁、石膏、法半夏、干姜、细辛、五味子、小麦组成,具有宣肺化饮、清热降逆、止咳平喘的功效。临床报道该方对哮喘具有明确疗效[5],但目前对其效应机制研究不够深入。近年来发现瞬时受体电位通道蛋白A1(TRPA1),TRPV1与哮喘病理过程有关[6-8]。本课题组前期研究发现卵蛋白(OVA)复合PM2.5诱导加重哮喘的小鼠肺组织中TRPA1和TRPV1表达均增加[9]。本研究观察厚朴麻黄汤干预OVA诱导小鼠哮喘模型的生物效应,对支气管肺泡灌洗液(BALF)中Th2相关细胞因子、神经因子水平以及肺组织中TRPA1,TRPV1 mRNA和蛋白表达的影响,探讨厚朴麻黄汤干预哮喘的效应及作用机制。
1 材料
1.1 动物
60只雌性SPF级Balb/c小鼠,7~8周龄,体质量18~22 g。购自南京市江宁区青龙山动物繁殖场,合格证号SCXK(苏)2017-0001,实验前动物适应环境3 d。本研究经南京中医药大学实验动物伦理委员会批准,实验符合伦理委员会相关动物研究指导原则。
1.2 药物及试剂
厚朴、麻黄、苦杏仁、石膏、法半夏、干姜、细辛、五味子、小麦,购于南京中医药大学国医堂,以上药材经南京中医药大学药学院李伟东教授鉴定;OVA(上海伯奥生物科技有限公司,批号171209),氯化乙酰胆碱(ACh,国药集团化学试剂有限公司,批号20170412),地塞米松(南京先声药业有限公司,批号015171207),嗜酸细胞(EOS)计数液,瑞吉氏染液(南京建成生物工程研究所,批号分别为20180709,20180315),甲醛溶液(西陇化工股份有限公司,批号1704072),水合氯醛(国药集团化学试剂有限公司,批号20150812);白细胞介素(IL)-4,IL-13,前列腺素D2(PGD2),P物质(SP)酶联免疫吸附测定(ELISA)试剂盒(上海韵涵生物科技有限公司,批号分别为CK-E20011M,CK-E11384M,CK-E92939M,CK-E20437M),trizol(美国Invitrogen公司,批号15596-026),cDNA第一链合成试剂盒(美国Thermo Fisher公司,批号K1622);实时荧光定量聚合酶链式反应(Real time PCR) Master Mix(SYBR Green)(瑞士Roche公司,批号04913850001);全蛋白抽提试剂盒,SDS-PAGE凝胶电泳试剂盒,ECL检测试剂盒(江苏凯基生物科技发展有限公司,批号分别为KGP250,KGP113,KGP1123);TRPA1,TRPV1抗体(英国Abcam公司,批号分别为AB58844,AB5370);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Proteintech公司,批号60004-1-Ig)。
1.3 仪器
402AI型超声雾化器(江苏鱼跃医疗设备股份有限公司);WBP-MS型清醒无束缚小鼠给药和呼吸生理检测系统(法国EMKA公司);CX21型Olympus显微镜(日本Olympus公司);Prism® 7500型荧光实时定量PCR仪(美国Invitrogen公司);SpectraMax 190型酶标仪(美国伯腾仪器公司);5024R型高速冷冻离心机(德国Eppendorf公司);164-5051型PowerPac™基础电泳仪(美国Bio-Rad公司)。
2 方法
2.1 药物制备
参考《金匮要略》[4]原方及《方剂学》[10]古今剂量换算并结合临床常用量,厚朴15 g,麻黄12 g,杏仁9 g,石膏30 g,法半夏9 g,干姜6 g,细辛6 g,五味子6 g,小麦30 g,浸泡后回流提取2次,第1次加10倍量蒸馏水,第2次加8倍量蒸馏水,每次1.5 h,药液过8层纱布,合并2次滤液,加压浓缩至2.8 g·mL-1,药液常温冷却后,至4 ℃冰箱内保存备用。小鼠给药量按照体表面积换算[11],厚朴麻黄汤中剂量为临床等效量(14 g·kg-1),低剂量为临床等效量0.5倍(7 g·kg-1),高剂量为临床等效量2倍(28 g·kg-1)。
2.2 动物分组及模型复制
60只Balb/c小鼠随机分为6组,分别为空白组、模型组、厚朴麻黄汤低、中、高剂量组和地塞米松组,每组10只。参考文献复制OVA致敏激发哮喘小鼠模型[12-13],除空白组外,其余5组小鼠分别于第1,8天皮下、腹腔各注射致敏液0.1 mL(0.2 mL致敏液含OVA 0.1 mg,氢氧化铝0.02 mg)致敏;第15~21天每天雾化吸入OVA激发,第22~28天隔天激发。第19~28天分别予厚朴麻黄汤低、中、高(7,14,28 g·kg-1)剂量灌胃;地塞米松组予以2.4 mg·kg-1的地塞米松溶液灌胃,连续给药10 d。
2.3 检测增强呼气间歇(Penh)
末次激发后24 h进行小鼠无创肺功能测试,将小鼠置于特定描记箱中,待小鼠安静后,先记录小鼠在PBS激发下增强的Penh值(作为基线值),然后按6.25,12.5,25,50 g·L-1梯度浓度雾化ACh 50 μL,每个剂量连续记录5 min Penh值。测定Penh后,以0.01 mL·g-1腹腔注射4%水合氯醛麻醉处死,取血、肺泡灌洗液及肺组织等。
2.4 HE染色观察小鼠肺组织病理形态学变化
取小鼠左肺组织,10%甲醛固定,石蜡包埋切片,常规制备病理切片,HE染色后200倍光学显微镜下观察肺组织的病理变化。
2.5 外周血和BALF中EOS水平变化
取血液20 μL混匀于嗜酸细胞计数液0.38 mL中,在光学显微镜下进行EOS计数。将小鼠固定,打开胸腔行气管插管,对左侧主支气管进行结扎,以磷酸盐缓冲液(PBS)1.5 mL分3次灌洗,每次0.5 mL,回收率均为80%以上。收集到的BALF 4 ℃,3 500 r·min-1离心10 min,吸出上清液,取沉淀涂片固定,瑞吉氏染液染色,显微镜下读取200个白细胞,统计EOS百分比。
2.6 ELISA检测BALF中细胞因子和神经因子水平
将2.4项收集到的BALF上清液,采用ELISA检测BALF中IL-4,IL-13,PGD2,SP水平,按试剂盒说明书进行操作。
2.7 Real-time PCR检测肺组织TRPA1,TRPV1 mRNA的表达
取厚朴麻黄汤优效剂量组右肺组织,用trizol试剂提取总RNA,电泳检测其完整性。按照Thermo Fisher公司cDNA第一链合成试剂盒说明书进行逆转录合成cDNA。利用实时荧光定量PCR仪测定TRPA1,TRPV1 mRNA转录水平表达。PCR反应参数:变性为94 ℃ 30 s,退火为58 ℃ 30 s,延伸为72 ℃ 30 s各1次,进行40个循环,收集荧光信号,反应结束,进行数据分析,用2-ΔΔCt法计算TRPA1,TRPV1 mRNA表达水平。以GAPDH为内参,引物序列见表1。TRPA1,TRPV1,GAPDH的PCR引物均由江苏凯基生物科技发展有限公司设计合成。
| 引物 | 序列(5′-3′) | 长度/bp |
|---|---|---|
| TRPA1 | 上游TTGGATATTGCAAAGAAGTGATCC | 125 |
| 下游GAGGAACAAGGGCAACACGA | ||
| TRPV1 | 上游TCACCGTCAGCTCTGTTGTC | 117 |
| 下游GATCATAGAGCCTTGGGGGC | ||
| GAPDH | 上游TATGTCGTGGAGTCTACTGGT | 149 |
| 下游GAGTTGTCATATTTCTCGTGG |
2.8 蛋白免疫印迹法(Western blot)检测肺组织TRPA1,TRPV1蛋白表达
取空白组、模型组及厚朴麻黄汤中剂量组小鼠右肺组织,按蛋白提取试剂盒要求提取总蛋白,用BCA法测定,并将各组蛋白调至等浓度后,进行SDS聚丙烯酰胺凝胶电泳,将凝胶上蛋白用半干法转移至PVDF膜上后,加入含5%脱脂奶粉的封闭液,摇床振荡反应1.5~2 h。封闭结束用TBST洗膜3次,每次10 min。加入稀释的一抗TRPA1(1∶1 000),TRPV1(1∶1 000),GAPDH(1∶5 000),4 ℃摇床振荡孵育过夜。室温振荡30 min,吸弃一抗,TBST洗膜3次,每次10 min。加入稀释的二抗(1∶5 000),室温摇床振荡反应1~2 h,TBST洗膜3次,每次8 min。化学发光法进行曝光显色,成像后使用Gel-Pro 32软件对结果进行灰度分析。
2.9 统计学分析
使用GraphPad Prism 6进行实验数据分析,实验数据以
3 结果
3.1 对各组小鼠Penh的影响
与空白组比较,模型组小鼠在ACh质量浓度为12.5,25,50 g·L-1时,Penh明显升高(P<0.05,P<0.01)。与模型组比较,ACh质量浓度为12.5 g·L-1时,厚朴麻黄汤中剂量组和地塞米松组Penh明显降低(P<0.05);ACh质量浓度为25 g·L-1时,厚朴麻黄汤低、中、高剂量组及地塞米松组Penh明显降低(P<0.05,P<0.01);ACh质量浓度50 g·L-1时,厚朴麻黄汤低、中、高剂量组及地塞米松组小鼠Penh显著降低(P<0.01)。见表2。
| 组别 | 剂量/g·kg-1 | 基线值 | ACh不同浓度激发后Penh增加值 | |||
|---|---|---|---|---|---|---|
| 6.25 g·L-1 | 12.5 g·L-1 | 25 g·L-1 | 50 g·L-1 | |||
| 空白 | - | 0.32±0.04 | 0.34±0.03 | 0.43±0.07 | 0.48±0.09 | 0.52±0.22 |
| 模型 | - | 0.36±0.56 | 0.49±0.18 | 0.95±0.661) | 1.34±0.541) | 1.96±0.652) |
| 地塞米松 | 0.0 024 | 0.45±0.17 | 0.42±0.14 | 0.45±0.153) | 0.59±0.243) | 0.74±0.244) |
| 厚朴麻黄汤 | 7 | 0.38±0.04 | 0.48±0.10 | 0.59±0.16 | 0.78±0.233) | 1.06±0.374) |
| 14 | 0.34±0.01 | 0.39±0.05 | 0.51±0.143) | 0.65±0.184) | 0.90±0.294) | |
| 28 | 0.36±0.07 | 0.46±0.10 | 0.61±0.17 | 0.85±0.333) | 1.09±0.294) | |
3.2 对各组小鼠肺组织病理学的影响
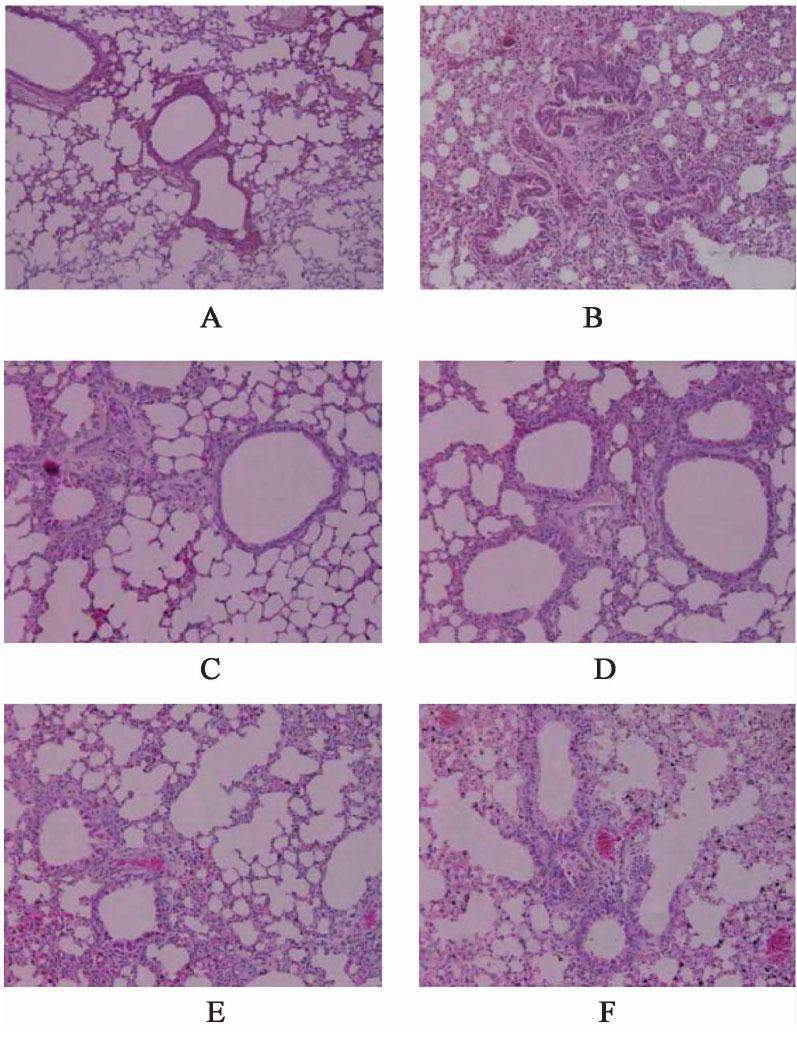
与空白组比较,模型组小鼠支气管及管壁周围有大量炎症细胞浸润,支气管黏膜水肿、增厚,管腔狭窄,黏液分泌增多;与模型组比较,用药组肺组织病理出现不同程度减轻,其中厚朴麻黄汤中剂量组减轻最明显。见图1。
3.3 对各组小鼠外周血及BALF中EOS水平的影响
与空白组比较,模型组外周血EOS数及BALF中EOS百分比显著增高(P<0.01);与模型组比较,厚朴麻黄汤低、中、高剂量组和地塞米松组外周血EOS数及BALF中EOS百分比显著降低(P<0.01)。见表3。
| 组别 | 剂量/g·kg-1 | 血液中EOS数(×106)/个/L | BALF中EOS百分比/% |
|---|---|---|---|
| 空白 | - | 65±52.97 | 2.63±1.60 |
| 模型 | - | 383±68.311) | 7.08±1.741) |
| 地塞米松 | 0.0 024 | 190±54.772) | 4.17±1.032) |
| 厚朴麻黄汤 | 7 | 222±36.322) | 4.20±1.482) |
| 14 | 150±35.362) | 4.06±1.472) | |
| 28 | 188±44.322) | 4.44±1.692) |
3.4 对各组小鼠BALF中细胞因子水平的影响
与空白组比较,模型组IL-4,IL-13,PGD2,SP水平明显升高(P<0.01)。与模型组比较,厚朴麻黄汤中剂量组、地塞米松组IL-4水平明显降低(P<0.05,P<0.01);厚朴麻黄汤中、高剂量组、地塞米松组IL-13水平明显降低(P<0.05);厚朴麻黄汤低、中、高剂量组、地塞米松组PGD2水平明显降低(P<0.01);厚朴麻黄汤中、高剂量组、地塞米松组SP水平显著降低(P<0.01)。见表4。
| 组别 | 剂量/g·kg-1 | IL-4 | IL-13 | PGD2 | SP |
|---|---|---|---|---|---|
| 空白 | - | 228±49.71 | 32±3.43 | 273±15.45 | 289±10.91 |
| 模型 | - | 328±20.841) | 38±1.701) | 314±17.871) | 315±20.271) |
| 地塞米松 | 0.0 024 | 271±39.753) | 35±3.112) | 271±17.983) | 275±8.563) |
| 厚朴麻黄汤 | 7 | 309±20.76 | 37±4.24 | 283±13.433) | 301±10.16 |
| 14 | 285±35.262) | 31±3.092) | 279±7.043) | 267±5.103) | |
| 28 | 310±10.98 | 33±4.072) | 278±12.703) | 257±10.193) |
3.5 对各组小鼠肺组织TRPA1,TRPV1 mRNA表达的影响
与空白组比较,模型组TRPA1,TRPV1 mRNA表达显著升高(P<0.01);与模型组比较,厚朴麻黄汤组TRPA1,TRPV1 mRNA表达明显降低(P<0.05,P<0.01)。见表5。
| 组别 | 剂量/g·kg-1 | TRPA1 | TRPV1 |
|---|---|---|---|
| 空白 | - | 0.99±0.01 | 1.07±0.1 |
| 模型 | - | 2.43±0.011) | 2.21±0.021) |
| 厚朴麻黄汤 | 14 | 1.54±0.013) | 1.45±0.022) |
3.6 对各组小鼠肺组织TRPA1,TRPV1蛋白表达的影响
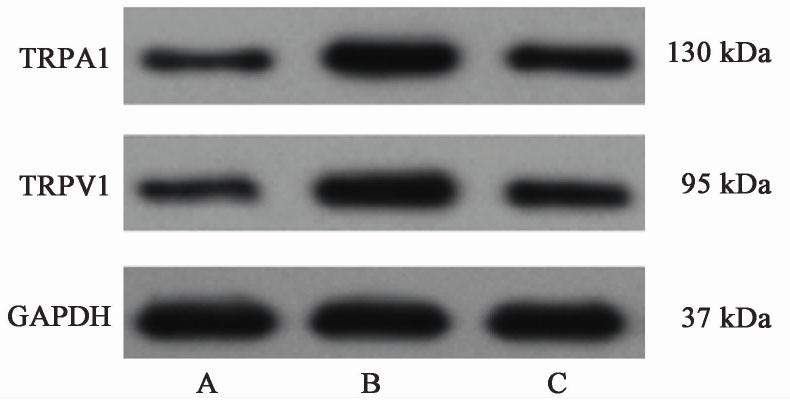
与空白组比较,模型组TRPA1,TRPV1蛋白表达显著升高(P<0.01);厚朴麻黄汤组TRPA1,TRPV1蛋白表达明显降低(P<0.05,P<0.01)。见图2,表6。
| 组别 | 剂量/g·kg-1 | TAPA1/GAPDH | TAPV1/GAPDH |
|---|---|---|---|
| 空白 | - | 0.21±0.02 | 0.23±0.01 |
| 模型 | - | 0.63±0.021) | 0.55±0.061) |
| 厚朴麻黄汤 | 14 | 0.38±0.023) | 0.39±0.062) |
4 讨论
《金匮要略·肺痿肺痈咳嗽上气病脉证并治》篇中记载:“咳而脉浮者,厚朴麻黄汤主之。”方中厚朴、麻黄、苦杏仁宣肺利气降逆;细辛、干姜、五味子、法半夏祛痰化饮止咳;石膏清热除烦;小麦养心益气。诸药相合,共奏宣肺涤饮,降气平喘之功,主要用于寒饮蕴肺、郁而化热,上迫于肺、肺失宣降之证。
哮喘发病机制十分复杂,一般认为Th2细胞应答增强为主的Th1/Th2失衡是哮喘发病的重要原因[14]。Th2细胞主要分泌IL-4,IL-13等细胞因子[15]。IL-4可以促进IgE合成,IL-13促进EOS,单核细胞的活化及募集,共同参与哮喘炎症反应[16]。TRPA1和TRPV1属于瞬时受体电位离子通道超家族[17]。TRPA1通道可被低温、有毒化学物质(如异硫氰酸烯丙酯)等激活,TRPV1通道可被热、疼痛、外来刺激物(如辣椒素)等激活,导致钙内流以及速激肽、降钙素基因相关肽的释放[18],感觉神经肽作用于呼吸道的一些效应细胞(如平滑肌、胆碱能神经节、黏液腺等),引起细胞旁的轴突反射、支气管收缩、蛋白渗出和炎性细胞趋化[19]。如SP水平升高可引起动物气道平滑肌收缩,导致微血管渗漏或出现炎性浸润反应[20]。PGD2可促使EOS募集,引起气道黏液分泌、支气管收缩和气体交换障碍,是哮喘气道炎症和气道高反应性的主要致病因子之一[21]。目前有报道TRPA1,TRPV1在咳嗽反射[22]和哮喘[23]气道炎症中发挥作用,TRPA1基因敲除小鼠哮喘模型中炎症因子减少和气道高反应性减轻[24]。课题组前期研究也证实了TRPA1,TRPV1通道在哮喘发病过程中发挥了重要的作用[9,13]。
本次实验结果证实厚朴麻黄汤可以降低哮喘模型小鼠气道反应性、减轻肺组织的病理损伤、减少炎症细胞浸润,降低BALF中Th2相关的IL-4,IL-13细胞因子水平,同时调控肺组织中TRPA1,TRPV1 mRNA和蛋白表达,以及神经因子PGD2,SP水平,以临床等效量中剂量组改善最为显著。提示厚朴麻黄汤干预哮喘的效应机制除降低Th2相关的细胞因子水平外,还涉及了调控TRPA1,TRPV1 mRNA和蛋白表达及降低相关神经因子水平,显示出该方复杂的功效机制特点,值得进一步深入研究。

