心血管疾病有很高的死亡率[1],而高脂血症与心血管病关系密切。临床研究证实在高血脂影响下,血管内皮细胞释放的一氧化氮(NO)与氧离子间的平衡被打破,常致使血管内皮细胞发生功能障碍。同时最新研究证明,内皮细胞的早期损伤不需要炎性细胞的侵蚀,而是当内皮细胞自身受到高血脂的刺激时,内皮炎症小体被激活,其中NOD样受体蛋白3(NLRP3)相关蛋白尤为突出,最终导致内皮细胞链接蛋白功能性受损[2-3]。由此不难看出,高脂引起的血管病变可以通过抑制血管内皮炎症发生来控制疾病的发展过程。高脂血症病人血管内会累积脂质而造成血管堵塞,最终导致血流凝滞不畅,引起疾病加重,恶性循环,而中医则称此类疾病病证为“痰浊血瘀”[4]。
三黄泻心汤作为经典的中医方剂,是由大黄、黄芩和黄连片3味药配伍组成,在东汉时期张仲景《金匮要略》首次记载,其主要功效是清热解毒[5],临床上主要用于治疗心胃火邪内炽证。现代研究结果也表明此方可改善血液的高凝状态,对缺血性脑血管疾病有一定疗效[6],具有降脂,减轻动脉粥样硬化斑块的形成及血管内皮细胞保护功能的作用[7]。但其对血管内皮细胞NLRP3炎症小体的作用机制尚不清楚。因此,本文在三黄泻心汤具有降脂保护血管损伤的药效研究基础上,探讨三黄泻心汤能否通过抑制7-酮基胆固醇(7-keto)诱导的血管内皮NLRP3炎症小体活化及相关通路,从而恢复内皮功能。这为阐明三黄泻心汤改善高脂血症的作用机制,为合理利用三黄泻心汤及揭示该方的科学内涵,探索中药复方配伍研究的新模式提供科学依据。
1 材料
1.1 细胞和动物
小鼠微血管内皮细胞购自上海ATCC公司。动物购自广东省动物中心,本课题经过广州中医药大学伦理委员会批准,批准号为2016046。
1.2 药物
三黄泻心汤由黄芩(批号170901),黄连(批号170804),大黄(批号170801)组成,饮片购自广东至信药业,质量符合实验要求,均由广州中医药大学中药学院黄海波副教授鉴定均为正品。
1.3 试剂
NLRP3抑制剂异甘草素(ISO)(北京Solarbio公司,货号SI8220);BCA,NO试剂盒(碧云天生物技术研究所,货号分别为P0028,S0021);胰酶,DMEM培养基,胎牛血清(美国Gibco公司,货号分别为25200056,111995065,16140071);7-keto(德国Cayman Chemical公司,货号0460384-17);乙酰胆碱(Ach,美国Sigma公司,货号A2661);β-肌动蛋白(β-actin)抗体(武汉博士德生物工程有限公司,货号BMO627);半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)抗体(美国Santa Cruz公司,货号sc-56036);白细胞介素-1β(IL-1β),NLRP3抗体(英国Abcam公司,货号分别为ab9722,ab91413);一氧化氮合酶(eNOS),兔抗免疫球蛋白(Ig)G,鼠抗兔IgG(美国CST公司,货号分别为32027s,7074s,7076s);硝普钠(Snp,上海麦克林生化科技有限公司,货号S817931)。
1.4 仪器
TANON5200型发光成像分析系统(上海天能科技有限公司);DMT620M型微血管张力测量系统(丹麦Danish Myo Technology A/S公司);1645070型凝胶电泳仪,1703930型转膜仪(美国Bio-Rad公司);Multiskan Sky型全波长酶标仪(美国Thermo公司)。
2 方法
2.1 含药血清制备
按照参考文献[8]方法,煎好三黄泻心汤,用三黄泻心汤灌胃4只大鼠1周,每天1次,每次10 mL·kg-1。最后1次灌胃后60 min进行腹主动脉取血,3 000 r·min-1离心10 min,置于56 ℃水浴30 min,冷却后用微孔滤头过滤密封冷冻备用。
2.2 细胞培养和给药
小鼠微血管内皮细胞用DMEM完全培养基在37 ℃ 5%CO2恒温培养箱中培养,每3 d传代。7-keto配成10 mmol·L-1作为储备液,用DMEM空白培养基按体积比例加入含药血清配制含药血清浓度为1%,2%,5%,10%的含药培养基;正式实验时,分为正常组,模型组(终浓度10 μmol·L-1 7-keto),给药组(含药血清浓度为1%,2%,5%,10%), ISO组(4.4 μmol·L-1 ISO),细胞在上述环境中培养24 h。
2.3 血管张力检测
在洁净工作台取正常野生型C57小鼠主动脉,剪成2~3 mm长的血管环,同上述细胞实验分组,在37 ℃恒温培养箱中体外培养1 d。1 d后用不同浓度的Ach和Snp通过微血管张力测量系统检验血管功能。血管舒张率=(血管最大张力-每次加入Ach或Snp后的血管张力)/(血管最大张力-基线张力)。一般以1×10-5 mol·L-1 Ach和Snp作用下的最大舒张率为各组主要比较和考量指标。
2.4 蛋白免疫印迹法(Western blot)检测内皮细胞蛋白的表达
用RIPA法提取总蛋白质,并用BCA法测蛋白浓度。加入适量蛋白上样缓冲液并在100 ℃变性5 min,随后可随即上样跑凝胶电泳,也可4 ℃保存备用。凝胶电泳设置100 V恒压分离SDS-PAGE凝胶,之后120 V恒压转膜。利用5%脱脂牛奶(TBST溶解)封闭1.5 h。相应NLRP3,剪切(Cle)-Caspase,前体(pro)-Caspase,cle-IL-1β,pro-IL-1β,β-actin一抗(1∶1 000)在室温下孵育30 min后转移至4 ℃孵育过夜,第2天回收一抗,用二抗(1∶1 500)室温孵育2 h。用TANON化学发光成像系统曝光蛋白条带并采集图像,分析灰度值。
2.5 NO浓度测定
收集上述不同组细胞的培养基,12 000 r·min-1离心10 min,取上清液做NO浓度测试。
2.6 统计学分析
采用统计软件GraphPad prism 5.0处理数据,所有结果均以
3 结果
3.1 对小鼠血管舒张功能与保护血管内皮的影响
与正常组比较,7-keto处理小鼠主动脉环造模24 h后,内皮依赖性血管舒张功能明显受损,在1×10-5 mol·L-1 Ach作用下的最大血管舒张率较正常组降低了约40%,有较明显的统计学差异(P<0.01)。与模型组比较,而在使用不同浓度三黄泻心汤含药血清处理后,血管舒张功能明显恢复,在5%血清处理时血管舒张功能恢复最为明显,与模型组相比有显著的统计学差异(P<0.05,P<0.01)。见图1。然而,使用Snp检测的非内皮依赖性血管舒张功能在用7-keto造模后无显著差异,且用不同浓度含药血清处理后也无明显变化,血管舒张率基本一致。见图2。


3.2 对血管功能与调节内皮细胞eNOS/NO系统的影响
与正常组比较,7-keto刺激造模的eNOS表达量明显降低(P<0.05,P<0.01),与模型组比较,5%和10%含药血清处理后eNOS表达量明显升高(P<0.05)。用相应的培养基上清液检测NO浓度,结果显示与正常组比较,模型组NO浓度显著降低(P<0.01),与模型组比较,用三黄泻心汤含药血清处理后NO浓度明显升高(P<0.05,P<0.01)。见图3,表1。

| 组别 | 体积分数/% | eNOS/β-actin(n=3) | NO/μmol·L-1 (n=6) |
|---|---|---|---|
| 正常 | - | 1 | 1 |
| 模型 | - | 0.68±0.151) | 0.55±0.102) |
| SHXXT | 1 | 0.95±0.26 | 0.54±0.12 |
| 2 | 0.99±0.31 | 0.64±0.10 | |
| 5 | 1.16±0.093) | 0.82±0.173) | |
| 10 | 1.29±0.213) | 1.12±0.184) |
3.3 对内皮细胞NLRP3炎症小体活化相关蛋白的影响
与正常组比较,在7-keto刺激下模型组的NLRP3蛋白表达量明显升高(P<0.05),模型组的Caspase-1,IL-1β各自的cle/pro比值显著升高(P<0.01)。与模型组比较,用三黄泻心汤含药血清处理后,NLRP3表达量和Caspase-1,IL-1β的cle/pro比值均明显下降,其中NLRP3蛋白的表达量随着含药血清浓度升高而有较为明显的浓度依赖性下降趋势(P<0.05,P<0.01),而Caspase-1和IL-1则无明显的浓度依赖性变化趋势。见图4和表2。
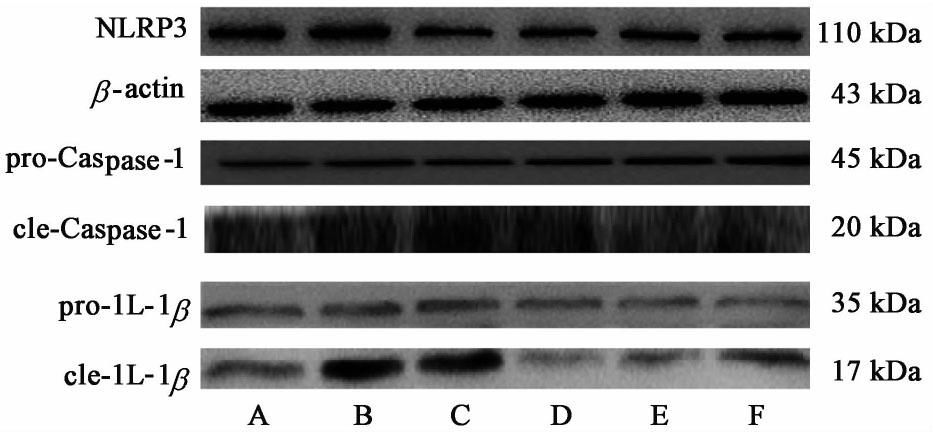
| 组别 | 体积分数/% | NLRP3/β-actin(n=4) | cle-Caspase-1/pro-Caspase-1(n=3) | cle-IL-1β/pro-IL-1β (n=4) |
|---|---|---|---|---|
| 正常 | - | 1 | 1 | 1 |
| 模型 | - | 1.57±0.641) | 1.42±0.132) | 1.64±0.372) |
| SHXXT | 1 | 1.47±0.41 | 1.33±0.34 | 1.54±0.59 |
| 2 | 0.75±0.233) | 1.44±0.25 | 0.74±0.174) | |
| 5 | 0.74±0.323) | 1.21±0.21 | 0.84±0.144) | |
| 10 | 0.57±0.233) | 0.88±0.164) | 1.00±0.454) |
3.4 对抑制内皮NLRP3活化起到恢复内皮NO的影响
与模型组比较,有效浓度的ISO能使受7-keto刺激而降低的eNOS表达量和NO浓度恢复(P<0.01),接近正常组水平,与上述5%含药血清作用效果相近;而未经造模即加入ISO或5%含药血清不会引起eNOS和NO水平的变化。用ISO和5%三黄泻心汤含药血清同时处理内皮细胞,eNOS表达和NO浓度与ISO和5%三黄泻心汤含药血清相比没有明显升高。见图5和表3。

| 组别 | 体积分数/% | ISO/μmol·L-1 | eNOS/β-actin(n=3) | NO/μmol·L-1(n=6) |
|---|---|---|---|---|
| 正常 | - | - | 1 | 1 |
| 7-keto | - | - | 0.64±0.231) | 0.51±0.062) |
| ISO | - | 4.4 | 0.90±0.17 | 1.01±0.14 |
| ISO+7-keto | - | 4.4 | 0.96±0.41 | 0.75±0.072,3) |
| SHXXT | 5 | - | 1.09±0.54 | 1.05±0.13 |
| SHXXT+7-keto+ISO | 5 | 4.4 | 0.99±0.62 | 1.00±0.103) |
4 讨论
本实验证明三黄泻心汤含药血清能有效恢复7-keto引起的内皮依赖性血管舒张功能损伤,其作用可能是通过抑制内皮NLRP3炎症小体活化介导的NO信号通路实现的。
三黄泻心汤由大黄、黄连和黄芩组成,首载于东汉时期张仲景《金匮要略》,研究显示此方具有降血压,改善血黏度及抗动脉粥样硬化的作用[9]。另有研究表明该复方能够显著降低AS大鼠血清TG,TC和LDL水平,升高HDL水平,影响NO的水平[10]。而7-keto作为一种氧化型胆固醇,是动脉粥样硬化常见的标志物,是研究高血脂和动脉粥样硬化常用的造模试剂。离体血管由Ach和Snp介导的在微血管张力测试系统体现的血管舒张水平是经典的血管功能评价指标,其中Ach是血管内皮eNOS特异性刺激剂,而Snp则是NO的化学供体,能直接产生NO,分别称为内皮依赖性和非内皮依赖性血管舒张功能检测。根据实验结果,7-keto刺激下小鼠离体主动脉血管环的内皮依赖性舒张功能明显降低,不同浓度三黄泻心汤含药血清处理后,血管舒张率较模型组显著恢复,且有浓度依赖性趋势,5%含药血清处理的血管舒张率恢复最为明显。非内皮依赖性血管舒张功能无明显变化,说明造模和药物治疗可能直接通过影响内皮细胞实现。由此可推断该中药复方能有效地抑制7-keto造成的内皮细胞功能紊乱,恢复eNOS的活性,从而恢复内皮依赖性血管舒张功能。
接下来进一步探究eNOS和NO在7-keto造模和给药处理后的变化趋势。众所周知,NO对血液循环系统的正常功能起着重要的调节作用[11-13],NO合成不足可引起高血压、动脉粥样硬化等心血管疾病。催化NO生物合成的酶成为NOS,eNOS广泛分布于动脉、静脉和毛细血管网络,提高eNOS的活性可减缓和减少内皮细胞的衰老[14],改善血管内皮功能对于维持血管张力、防治高脂血症引起的心血管疾病发生发展至关重要[15],因此本实验将eNOS表达和NO生成量作为检测指标。实验结果显示,模型组的eNOS表达量显著低于正常组,而模型组内皮细胞培养基上清液的NO浓度也显著低于正常组。用不同浓度含药血清处理后,eNOS表达量明显恢复;而NO浓度随着三黄泻心汤含药血清浓度增加而恢复显著,具有浓度依赖性。此结果表明上述内皮依赖性血管舒张功能在7-keto造模后受到损伤而用三黄泻心汤给药处理后显著恢复,其可能是通过影响eNOS/NO通路实现的。
文献报道在高脂血症时7-keto浓度的上升常伴随着不同程度的血管炎症反应,各类炎症因子会损伤血管舒张功能,降低eNOS表达量,但其中7-keto与NLRP3炎症小体的相关研究较少,是否7-keto激活了NLRP3炎症小体进而降低eNOS表达量和损伤血管舒张功能还有待探究。新近研究指明NLRP3炎症小体的活化与脂质代谢疾病的病理过程密切相关[16],NLRP3炎症小体是NOD样受体家族炎症小体中的一个重要的成员,其能够识别人体内各种危险因子产生的危险信号并被激活[17],NLRP3炎症小体的各组成部分分布相当广泛[18],主要分布在巨噬细胞等免疫细胞,但在血管内皮细胞和平滑肌细胞等功能性细胞中也有表达。NLRP3活化后,凋亡相关斑点样蛋白(ASC) C端Caspase募集域CARD与细胞凋亡蛋白(Caspase-1)CARD结构域结合形成一种多聚复合体[19],与此同时,NLRP3炎症小体复合体进一步活化并激活Caspase-1,促进IL-1β的成熟及释放[2,20-22],极有可能介导7-keto诱导的内皮功能紊乱。由此推论,NLRP3炎症小体通路是抗炎药物的潜在靶点,用以治疗高脂作用下的血管内皮功能损伤[23],因此在本研究中,将探究三黄泻心汤含药血清是否能抑制7-keto诱导的NLRP3相关蛋白的表达。实验结果显示,模型组NLRP3表达量明显大于正常组,同时模型组的Caspase-1,IL-1β各自的cle/pro比值明显高于正常组,而用三黄泻心汤含药血清处理后则明显下降,证明7-keto确实能够激活和增加NLRP3相关炎症蛋白的表达,而三黄泻心汤含药血清能够抑制上述炎症蛋白的表达。
最后,笔者探究使用抑制剂抑制NLRP3表达之后,是否能恢复eNOS活性和NO生成量。为验证假设,笔者使用NLRP3抑制剂ISO和5%有效浓度的三黄泻心汤含药血清来进行实验。结果显示,ISO处理后,eNOS表达量较用7-keto造模时有显著增加,其水平与用5%有效浓度含药血清组处理后的结果相似,NO含量也在加入ISO处理后显著恢复。而若未添加7-keto,仅加入ISO或5%含药血清,则并不会引起eNOS表达和NO浓度过度增加。使用ISO和5%三黄泻心汤含药血清共同处理内皮细胞,eNOS表达量和NO浓度与单独用一种试剂处理相比没有明显升高,无协同作用。所以笔者认为,三黄泻心汤可能通过抑制血管内皮NLRP3炎症小体的活化和表达,进而一定程度恢复eNOS活性和NO生成水平。
综上所述,7-keto通过激活NLRP3炎症小体,切割pro-Caspase-1,活化IL-1β,同时可以抑制eNOS活性,导致NO生成量减少和内皮功能紊乱。而三黄泻心汤含药血清则可以抑制NLRP3相关炎症蛋白的表达和激活,从而部分恢复eNOS活性,进而促进NO生成,保护血管内皮功能。
Roles of inflammation, oxidative stress, and vascular dysfunction in hypertension
[J]. Biomed Res Int, 2014, doi: 10.1155/2014/406960.
