神经病理性疼痛(NP)是一种包括痛觉感知、认知异常的复杂难治性疼痛,患病率为6.9%~10%[1],在临床NP患者中,痛与情绪障碍的共病率高达47%[2]。痛与情绪的共病被认为是NP复杂且难治性原因。最新研究显示,在NP患者及实验动物中发现海马神经元兴奋性和突触可塑性降低,其中海马退行性病变被认为是痛共情绪障碍的关键诱因[3],而海马神经元兴奋性与可塑性损伤修复有望成为NP中痛与情绪共治的突破点[4]。
中药方剂成分复杂,具有多成分、多靶点、多途径整体调节发挥作用的特点,能对机体进行全方位调节,在慢性疼痛的治疗中显现出独特的优势。乌头汤源于东汉名医张仲景《金匮要略》,由制川乌、黄芪、麻黄、白芍和炙甘草5味中药组成,有通痹散寒止痛之效[5],临床主要用来治疗类风湿性关节炎、腰椎间盘突出症、肩关节周围炎等多种炎症相关疾病[6-7],对三叉神经痛等神经病理性疼痛亦具有良好的镇痛效果[8]。本课题组前期研究发现,乌头汤对实验性脊神经结扎(SNL)小鼠痛与情绪共病有很好的缓解作用,能增高SNL小鼠海马内异常降低的BDNF蛋白表达量[9],相关作用与缓解海马神经元兴奋性及可塑性的修复有关[10],但具体的分子途径尚不明确。
已知脑源性神经营养因子(BDNF)在疼痛、抑郁症、外界压力等多种疾病中参与了海马神经元损伤的发生及修复[11],而BDNF/原肌球蛋白受体激酶B(TrkB)是BDNF发挥关键药效的信号通路。本研究拟采用NP国际经典的动物模型SNL小鼠模型,通过海马CA3区显微注射BDNF/TrkB通路受体拮抗剂ANA12的方式,探究乌头汤调控海马BDNF/TrkB通路以缓解NP的痛共情绪症状的初步作用机制。
1 材料
1.1 动物
雄性ICR小鼠48只,SPF级,8周龄,体质量28~30 g,购自北京大学医学部(实验动物科学部),合格证号SCXK(京)2011-0012。动物标准饲养,动物房空调控温,温度22~24 ℃,相对湿度70%~80%,日光灯控明,动物自由摄食饮水。
1.2 药品与试剂
制川乌产自四川江油,黄芪产自山西,麻黄产自内蒙古,白芍产自安徽,炙甘草产自内蒙古,均购自北京同仁堂药房,经中国中医科学院中药研究所张村研究员鉴定符合2015年版《中国药典》规定;普瑞巴林(PGB)胶囊(美国辉瑞公司,批号M57973);盐酸氟西汀(FLU)胶囊(法国Patheon Fance公司,批号6603A);ANA12(美国MCE公司,批号HY12497);FD快速高尔基染色试剂盒(美国FD Neuro Technologies公司,批号PK401);异戊烷(天津市大茂化学试剂厂,批号2011428);OCT包埋剂(美国Lti-Pack公司,批号202468);中性树胶(上海麦克林生化科技有限公司,批号822941);二甲苯(武汉博士德生物工程有限公司,批号AR1022);无水乙醇(北京化工厂,批号20150504)。
1.3 仪器
XTS20/30型连续变倍体视显微镜(北京泰克仪器有限公司);Aesthesio型Von Frey纤维细丝机械刺激针(法国Bioseb公司);68505型脑室立体定位仪(深圳瑞沃德生命科技有限公司);62004型套管(深圳瑞沃德生命科技有限公司);BX41型正置荧光显微镜(德国Olympus公司);疼痛测试钢架、铁丝网眼垫、旷场实验箱、悬尾实验箱(均为中国中医科学院中药研究所中药药性理论实验室自制)。
2 方法
2.1 分组
采用随机数字表法,将小鼠分为假手术(sham)组,SNL模型组,乌头汤组,乌头汤-ANA12拮抗剂组,PGB组,FLU组,每组8只。
2.2 动物模型制备
2.2.1 左侧腰椎第五脊神经结扎(SNL)模型
小鼠适应3 d后进行模型制备。动物以异氟烷进行气体麻醉后,根据参考文献方法[12],暴露L5横突,游离L5神经并以6号眼科线结扎,以无菌生理盐水及青霉素处理伤口后缝合。除假手术组外,其余各组小鼠制备SNL模型。假手术sham组仅暴露并拔除L5横突,但不结扎神经。所有小鼠在手术后,观察其行动状态,剔除运动行为受损的动物。
2.2.2 背测海马立体定位注射模型
根据Paxinos&WaTson脑立体定位图谱确定海马CA3区立体定位坐标。将小鼠俯位固定于定位仪上,暴露前囟以标记海马CA3,放置给药套管,再用骨水泥固定,缝合伤口。各组小鼠均安装脑定位给药套管。
2.3 药品制备
乌头汤水煎液制备:按原方比例,将黄芪108 g,白芍108 g,炙甘草108 g,麻黄108 g,制川乌72 g加蒸馏水5 L文火煎煮1.5 h,滤出上清;再加蒸馏水4 L,继续煎煮1 h,滤出上清,合并2次上清液并用纱布过滤药液。浓缩至400 mL,即得终质量浓度为1.26 g·mL-1的乌头汤水煎液。PGB生理盐水溶液配置:将PGB溶解于生理盐水中,配制成终质量浓度为2.5 g·L-1的溶液。FLU生理盐水溶液配置:将FLU溶解于生理盐水中,配制成终质量浓度为0.3 g·L-1的溶液。为保证药物的稳定性及实验结果的可重复性,实验所需乌头汤水煎液一次性制备好,分装置于-20 ℃冰箱储存备用,给药前复温,并避免反复冻融;PGB和FLU现用现配。
2.4 给药
所有给药剂量按照人∶小鼠=1∶9比例,其中乌头汤按照临床用于治疗类风湿性关节炎的2倍剂量,PGB按照临床治疗神经病理性疼痛的1倍剂量,FLU按照临床治疗抑郁症的1倍等效剂量计算。造模成功后,以10 mL·kg-1小鼠体质量灌胃,乌头汤组及乌头汤-ANA12拮抗剂组以12.6 g·kg-1乌头汤水煎液,PGB组以0.025 g·kg-1 PGB溶液,FLU组以3 mg·kg-1 FLU溶液,sham组及SNL模型组灌胃等体积生理盐水,每天1次,连续给药21 d。术后10 d,乌头汤-ANA12拮抗剂组进行连续7 d的ANA12(50 nmol·L-1)套管给药,其余组给予等体积的生理盐水。
2.5 Von Frey法检测小鼠机械痛敏
根据文献[13],采用Von Frey法,在手术前、后1,4,7,9,12,14,17,21 d分别检测小鼠机械痛敏,检测步骤如下:测试前将小鼠置于位于镂空金属网格架上的有机玻璃箱内适应1 h使小鼠处于安静平息状态,用Von Frey纤维丝刺激术侧后肢足底L5神经反射区,持续刺激3~4 s,测试后爪收缩阈值。首次收缩阈值测试后,再次测试小鼠的收缩阈值,每次需间隔5 min,共测试6次。50%缩足阈值=[10(Xf+kθ)]×10 000-1,其中Xf为末次动物收缩所使用的Von Frey纤维细丝对应的质量值(g),k为阳性/阴性反应测试对应的值,θ为纤维细丝刺激之间的均值差,为固定值0.224。50%缩足阈值的降低代表机械痛敏感症状的发生,反之,50%缩足阈值增高表明机械痛敏感症状的改善。
2.6 旷场实验检测小鼠焦虑情绪
旷场实验是评价实验动物在新异环境中自主行为、探究行为与紧张度最常用的方法,主要用于评估分析小鼠的运动能力,智力和焦虑相关的情绪行为[14]。本研究选用旷场实验分别在手术前、术后7,21 d检测小鼠焦虑情绪,实验操作如下:将小鼠置于高50 cm,边长100 cm,周边和底面均为黑色、底面中心区域边长为30 cm的方形旷场分析箱中,自然光照,室内安静。将每只动物头朝分析箱壁放入箱内底面边缘,统计4 min内小鼠在中心区停留时间。每次统计后,用75%乙醇清洗并擦干箱内壁及底面。小鼠旷场中心区停留时间越短,代表小鼠紧张度和焦虑情绪越严重。
2.7 悬尾实验检测小鼠抑郁情绪
选用悬尾实验分别在手术前、术后21 d检测小鼠抑郁情绪,利用小鼠悬尾后企图逃脱但又无法逃脱,从而放弃挣扎,进入特有的抑郁不动状态,记录小鼠不动时间来反映抑郁状态[15]。步骤如下,将小段光滑吸管头套入小鼠尾巴,防止小鼠顺其尾巴向上爬,再用长1 cm×10 cm透明胶带在离尾尖端5 mm将小鼠尾巴倒挂黏附在黑色悬尾箱上,黑色悬尾箱置于水平地面上,两边用重物固定防止悬尾箱晃动造成实验误差。每2只小鼠间用挡板挡住间隔20 cm。摄像机记录6 min内小鼠的行为,计算每只小鼠实验过程中后4 min的不动时间。小鼠悬尾不动时间越长表示小鼠获得性无助的症状,即抑郁情绪越严重。
2.8 动物取材及切片
高尔基染色固定液固定脑组织后冰冻切片,小鼠以异氟烷麻醉,剥取脑组织后用蒸馏水洗净血渍,再用高尔基染色剂逐步染色固定;将固定后的脑组织置于预冷后的冰冻切片机内用OCT包埋剂包埋后,沿冠状面将处理好的脑组织切为厚度为200 μm的脑组织切片。
2.9 高尔基染色法检测小鼠神经元形态
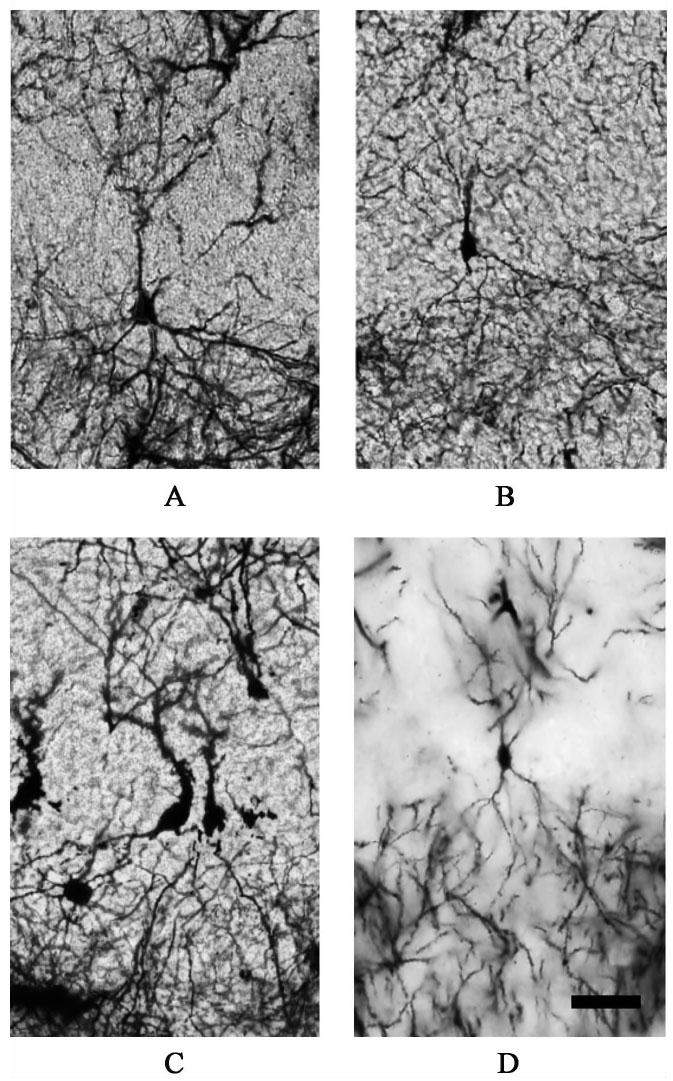
高尔基染色法是一种观察体内神经元形态学经典检测方法。操作步骤如下:双蒸水冲洗组织切片后把组织切片置于高尔基染色液中染色;用蒸馏水冲洗,乙醇梯度脱水,二甲苯透化后用中性树脂进行封片,全程避光操作;将封片好的脑组织片置于400倍透视显微镜下观察海马CA3区椎体神经元形态,并进行图像采集合成,采用Image J软件描绘神经元树突形态,并对顶部和基部神经元分支数统计分析。
2.10 统计学分析
采用Graphpad Prism 5软件对数据进行统计分析,所有数据均用
3 结果
3.1 对小鼠机械痛敏的影响
与假手术组比较,SNL模型组小鼠术后1~21 d 50%缩足阈值均显著降低(P<0.01);与SNL模型组比较,PGB组小鼠在术后4~21 d,FLU组小鼠在术后12~21 d,乌头汤组在术后9~21 d的机械痛阈值较SNL模型组均明显增高(P<0.05,P<0.01);乌头汤-ANA12拮抗剂组的机械痛阈值在术后9 d较SNL模型组显著增高(P<0.01),通过套管进行ANA12干预后,乌头汤-ANA12拮抗剂组的机械痛阈值持续降低,在术后14~21 d降至与SNL组无统计学差异。见表1。
| 组别 | 剂量/mg·kg-1 | 50%缩足阈值/g | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 手术前 | 术后1 d | 术后4 d | 术后7 d | 术后9 d | 术后12 d | 术后14 d | 术后19 d | 术后21 d | ||
| sham | - | 0.40±0.06 | 0.39±0.07 | 0.43±0.09 | 0.43±0.02 | 0.40±0.09 | 0.42±0.11 | 0.41±0.08 | 0.41±0.07 | 0.40±0.10 |
| SNL模型 | - | 0.41±0.04 | 0.17±0.032) | 0.04±0.022) | 0.04±0.012) | 0.03±0.012) | 0.02±0.012) | 0.04±0.012) | 0.02±0.012) | 0.03±0.012) |
| PGB | 25 | 0.40±0.05 | 0.16±0.04 | 0.23±0.124) | 0.24±0.114) | 0.20±0.084) | 0.24±0.084) | 0.26±0.094) | 0.22±0.094) | 0.17±0.074) |
| FLU | 3 | 0.41±0.08 | 0.14±0.05 | 0.07±0.04 | 0.06±0.03 | 0.07±0.03 | 0.11±0.054) | 0.11±0.054) | 0.13±0.044) | 0.14±0.054) |
| 乌头汤 | 126 | 0.43±0.02 | 0.18±0.03 | 0.07±0.05 | 0.04±0.04 | 0.17±0.094) | 0.24±0.084) | 0.31±0.024) | 0.33±0.044) | 0.35±0.134) |
| 乌头汤-ANA12拮抗剂 | 126 | 0.39±0.09 | 0.15±0.04 | 0.08±0.03 | 0.04±0.01 | 0.21±0.114) | 0.14±0.113) | 0.10±0.04 | 0.05±0.02 | 0.06±0.03 |
3.2 对小鼠焦虑情绪的影响
与假手术组比较,术后7~21 d,SNL模型组小鼠中心区停留时间显著减少(P<0.01);与SNL模型组比较,术后7~21 d,PGB组小鼠与模型组无统计学差异,FLU及乌头汤组小鼠在术后7 d中心区停留时间均显著增加,并持续至第21天(P<0.05,P<0.01);乌头汤-ANA12拮抗剂组在术后7 d的中心区停留时间较SNL模型组明显升高(P<0.05),在术后21 d与SNL模型组无统计学差异。见表2。
| 组别 | 剂量/mg·kg-1 | 中心区停留时间/s | |
|---|---|---|---|
| 术后7 d | 术后21 d | ||
| sham | - | 25.39±6.97 | 26.62±9.36 |
| SNL模型 | - | 7.97±6.392) | 6.26±3.532) |
| PGB | 25 | 3.65±1.58 | 6.20±3.99 |
| FLU | 3 | 16.07±7.563) | 21.95±4.614) |
| 乌头汤 | 126 | 24.26±6.994) | 23.54±5.374) |
| 乌头汤-ANA12拮抗剂 | 126 | 23.10±6.684) | 9.67±3.89 |
3.3 对小鼠抑郁情绪的影响
与假手术组比较,SNL模型组小鼠术后21 d悬尾不动时间显著增加(P<0.01);与SNL模型组比较,PGB组术后21 d小鼠悬尾不动时间与SNL组无统计学差异,FLU组及乌头汤组小鼠在术后21 d悬尾不动时间较SNL组显著降低(P<0.01);乌头汤-ANA12拮抗剂组通过套管进行海马ANA12干预后,术后21 d悬尾不动时间与SNL组无统计学差异。见表3。
| 组别 | 剂量/mg·kg-1 | 不动时间/s | |
|---|---|---|---|
| 手术前 | 术后21 d | ||
| sham | - | 59.98±15.74 | 64.53±14.50 |
| SNL模型 | - | 59.95±11.50 | 152.00±34.452) |
| PGB | 25 | 58.79±14.54 | 124.56±32.03 |
| FLU | 3 | 60.05±16.11 | 67.95±13.354) |
| 乌头汤 | 126 | 54.35±14.83 | 102.29±25.784) |
| 乌头汤-ANA12拮抗剂 | 126 | 61.85±15.98 | 138.28±32.89 |
3.4 对小鼠海马CA3区神经元的影响
与假手术组比较,SNL模型组小鼠海马CA3区椎体神经元顶部和底部树突分支数明显减少(P<0.05,P<0.01);与SNL模型组比较,乌头汤组小鼠海马CA3区椎体神经元顶部和底部树突分支数均明显增加(P<0.05,P<0.01),乌头汤-ANA12拮抗剂组小鼠海马CA3区椎体神经元顶部和底部树突分支数与SNL组无统计学差异。见图1,表4,表5。
| 组别 | 剂量/mg·kg-1 | 海马神经元顶部树突分支数/个 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 20 μm | 40 μm | 60 μm | 80 μm | 100 μm | 120 μm | 140 μm | 160 μm | 180 μm | ||
| sham | - | 1.60±0.13 | 2.37±0.20 | 3.13±0.26 | 3.75±0.31 | 3.92±0.36 | 3.77±0.38 | 3.12±0.38 | 2.78±0.27 | 2.44±0.31 |
| SNL模型 | - | 1.70±0.16 | 2.28±0.16 | 2.45±0.20 | 2.22±0.201) | 2.10±0.182) | 2.00±0.172) | 1.86±0.182) | 1.23±0.121) | 1.13±0.131) |
| 乌头汤 | 126 | 1.50±0.16 | 1.82±0.28 | 2.66±0.34 | 3.25±0.383) | 3.38±0.383) | 3.49±0.343) | 2.91±0.323) | 2.70±0.303) | 1.88±0.18 |
| 乌头汤-ANA12拮抗剂 | 126 | 1.24±0.11 | 1.69±0.19 | 1.97±0.22 | 2.17±0.22 | 2.41±0.27 | 2.50±0.26 | 2.17±0.27 | 2.19±0.25 | 2.12±0.19 |
| 组别 | 剂量/mg·kg-1 | 海马神经元底部树突分支数/个 | ||||||
|---|---|---|---|---|---|---|---|---|
| 20 μm | 40 μm | 60 μm | 80 μm | 100 μm | 120 μm | 140 μm | ||
| sham | - | 2.57±0.22 | 4.34±0.32 | 5.29±0.33 | 5.53±0.38 | 5.24±0.38 | 4.69±0.39 | 4.17±0.35 |
| SNL模型 | - | 1.80±0.13 | 2.13±0.162) | 2.38±0.212) | 2.74±0.232) | 2.73±0.272) | 2.23±0.352) | 1.83±0.362) |
| 乌头汤 | 126 | 2.30±0.21 | 4.05±0.284) | 5.69±0.304) | 6.01±0.354) | 5.67±0.394) | 4.92±0.444) | 4.61±0.414) |
| 乌头汤-ANA12拮抗剂 | 126 | 1.80±0.21 | 2.73±0.22 | 2.68±0.23 | 2.50±0.23 | 2.07±0.32 | 1.56±0.29 | 1.75±0.25 |
4 讨论
本课题组的前期研究显示,ANA12注射能显著降低BDNF/TrkB通路中诸如BDNF,AKT和CREB等关键分子的表达量,海马ANA12注射具有良好的海马BDNF/TrkB通路拮抗作用。本研究采用海马CA3区定位注射ANA12的方法,通过检测小鼠机械痛阈值、焦虑与抑郁情绪以及海马神经元形态,旨在探究乌头汤对NP痛与焦虑、抑郁症状缓解的关键途径。实验结果显示,SNL模型小鼠机械痛阈值和旷场中心区停留时间显著降低,悬尾不动时间显著增高,显现出典型的痛与情绪共病症状,这些共病症状稳定、持续、动物个体差异小,和之前相关文献报道的特点相似[16-17],为后续进一步探究机制提供了良好的基础。根据NP临床用药指南[18],本研究选用治疗NP的一线药物PGB为机械痛敏的阳性对照,选用治疗NP抑郁、焦虑情绪的一线药物FlU为情绪的阳性对照来评价乌头汤对NP痛与情绪的治疗作用,结果显示,PGB具有较好的镇痛效果,FlU能改善NP焦虑与抑郁情绪但镇痛效果较差,而乌头汤能同时改善SNL模型小鼠痛与焦虑、抑郁共病症状,但小鼠海马CA3区套管ANA12干预后,小鼠的机械痛敏、焦虑和抑郁情绪均与SNL模型组无统计学差异,从行为学角度,提示了海马CA3区ANA12的注射阻断WTD对SNL小鼠机械痛与焦虑、抑郁共病症状的缓解。
海马是痛觉感知、认知形成的关键核团,也是调控情绪的关键部位,海马神经元退行性病变的发生被认为是NP共病的关键病理环节。现有病理研究显示,改善海马椎体神经元的退行性病变能有效缓解NP痛共情绪障碍的发生[19]。本课题组前期研究显示,乌头汤在缓解NP痛共情绪障碍和修复海马椎体神经元损伤的同时,也能特异性地改善SNL模型小鼠海马CA3区BDNF蛋白表达量的异常降低[20],但BDNF通路是否是乌头汤发挥共治药效和改善海马神经元退行性病变的药理途径尚不清楚。因此,本研究中,笔者以海马神经元退行性病变的发生及改善作为药效途径研究的辅助证据,以实验数据正、反向验证了乌头汤对海马BDNF/TrkB通路的调控是其神经修复、共病症状改善的关键途径。
本课题组前期建立了从外围损伤部位-脊髓-脑整合探究乌头汤治疗NP的多靶向优势,建立了痛与情绪共治的药效评价标准[21]。本研究从脑神经核团入手,以脑神经核团显微注射的方式,建立了正、反向研究的模式来探索乌头汤在NP治疗中具有痛与情绪的共治的独特优势,在后续研究中,本课题组将从乌头汤入脑成分分析入手,进一步探索乌头汤干预海马BDNF/TrkB通路的药理途径,为乌头汤在临床的应用提供参考。

