膝骨关节炎(KOA)是以关节软骨的破坏及滑膜炎症为主要特征的一种关节软骨的退行性疾病,是骨关节炎(OA)中最常见的一种类型。随着老龄化人口的剧增,KOA的发病率逐年升高[1],有调查发现,我国骨关节炎女性的发病率高于男性,且其患病率随着年龄的增长而增加,40岁以上的患病率10%~17%,60岁以上约50%,75岁以上约80%[2]。目前治疗KOA的首选药物主要是镇痛药,非甾体抗炎药和皮质类固醇类药物,但治疗缺乏特异性。中医认为,KOA属于“痹证”和“痿证”范畴,肝肾亏虚、长期劳损及外感风寒湿邪是其主要病机。右归丸摘自《景岳全书》,主要由熟地黄、山茱萸、枸杞子、山药、附子、肉桂、鹿角胶、菟丝子、杜仲、当归组成,方中附子、肉桂、鹿角胶培补肾中元阳,温里祛寒,为君药。熟地黄、山茱萸、枸杞子、山药滋阴益肾,养肝补脾,填精补髓,取“阴中求阳”之义,为臣药。再用菟丝子、杜仲补肝肾,强腰膝,配以当归养血和血,共补肝肾精血,为佐药。诸药合用,以温肾阳为主而阴阳兼顾,肝脾肾并补,妙在阴中求阳,使元阳得以归原。具有温补肾阳,填精止遗的功效。有调查发现,KOA的证型有肾虚髓亏型、阳虚寒凝型和瘀血阻滞型等[3];研究也发现,右归丸对KOA治疗有效[4]。故本研究拟通过改良Hulth法复制KOA大鼠模型,观察右归丸对KOA模型大鼠的白细胞介素-6(IL-6)/信号转导和转录激活因子3(STAT3)信号通路的干预作用,并探究其与软骨细胞炎症反应调控机制的相关性,旨在为KOA的临床治疗提供依据。
1 材料
1.1 动物
SPF级SD大鼠60只,雌雄各半,体质量(180±20) g,购自我校科研实验动物饲养中心。动物质量许可证号SYXK(甘)2015-0005。本动物实验经甘肃中医药大学动物伦理委员会批准进行,实验动物符合甘肃中医药大学科研实验中心伦理委员会规定(批准号2015-027)。
1.2 药物及试剂
右归丸(仲景宛西制药股份有限公司,批号151108);硫酸氨基葡萄糖片(保节力,新兴同仁药业有限公司,批号160302);青霉素(华北制药股份有限公司,批号F6042103);水合氯醛(天津市光复精细化工研究所,批号20150105);乙醇(天津市富宇精细化工有限公司,批号20181020);苏木素、伊红染色液(北京索莱宝科技有限公司,批号分别为329D0312,G1100);反转录试剂prime script RT master mix(大连宝生物工程有限公司,批号AI20775A);荧光定量SYBR P Remix EX TaqⅡ(美国Promega公司,批号0000304040);β-肌动蛋白(β-actin)和IL-6引物序列由日本Takara公司设计并合成,β-actin引物序列上游5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游5′-GACT CATCGTACTCCTGCTTGCTG-3′,产物长度150 bp;IL-6引物序列上游5′-ATTGTATGAACAGCGATG ATGCAC-3′,下游5′-CCAGGTAGAAACGGAACTCC AGA-3′,产物长度111 bp;甘油醛-3-磷酸脱氢酶(GAPDH)抗体,兔抗鼠STAT3多克隆抗体(美国Immuno Way公司,批号分别为B4501,B51001);兔抗鼠Wnt抑制因子1(WIF1),超氧化物歧化酶3(SOD3)多克隆抗体(北京博奥森生物技术有限公司,批号分别为AC01084578,AG11175544)。
1.3 仪器
BioMATE 3S型蛋白、核酸浓度测定仪(美国Thermo公司);BX53型显微镜(日本Olympus公司);ChemiDocTM XRS+型凝胶成像分析系统,Mini-PROTEAN Tetra型小型垂直蛋白电泳仪,Trans-Blot Turbo型全能型蛋白快速转印仪(美国Bio-Rad公司);TGL16M型台式高速冷冻离心机(凯达集团成员高科技公司);OSE-Y10型电动组织研磨器(上海Tiangen公司);C1000型PCR热循环仪(美国ABI公司);LightCycler 96型实时荧光定量聚合酶链式反应(Real-time PCR)仪(美国罗氏公司)。
2 方法
2.1 给药剂量设置
右归丸人的临床用量为27 g·kg-1·d-1,按照人与大鼠的体表面积换算法为27 g·kg-1×0.018×5≈2.4 g·kg-1,作为中剂量。故而设定右归丸高、中、低剂量分别为4.8,2.4,1.2 g·kg-1;硫酸氨基葡萄糖片按照人与大鼠的体表面积换算法为1.884 g·kg-1×0.018×5≈0.17 g·kg-1。
2.2 动物分组、造模及给药
60只SD大鼠适应性饲养1周后,随机分为6组,分别为假手术组、模型组、硫酸氨基葡萄糖组、右归丸高、中、低剂量组,每组10只。参照文献[5-6],模型组及干预组采用改良Hulth法复制KOA模型。假手术组SD大鼠从膝关节内侧只打开关节腔,不破坏韧带和半月板,并保留关节软骨面。术后连续3 d肌肉注射青霉素20万U·d-1,各组大鼠均在相同条件下,自由饮水,摄食。手术造模6周后通过苏木素-伊红(HE)染色观察软骨细胞的形态变化以判定模型是否成功,造模成功后给予药物干预,硫酸氨基葡萄糖组灌服硫酸氨基葡萄糖(0.17 g·kg-1),右归丸高、中、低剂量组分别按4.8,2.4,1.2 g·kg-1灌服相应的药物,干预8周。股动脉采血处死各组动物,摘取双侧膝关节,左侧膝关节固定于4%多聚甲醛,右侧膝关节于-80 ℃冰箱保存备用。
2.3 指标测定
2.3.1 HE染色观察骨形态学变化
动物处死后取完整膝关节,对左侧膝关节脱钙处理并脱蜡至水,采用石蜡包埋法制作蜡块,并用切片机切片,切片厚度约5 μm,HE染色,封片、镜检并进行Mankin评分,具体评分标准参考文献[7]进行。评分标准为软骨结构如常,软骨细胞数量如常,基质染色正常,潮线比较完整记为0分;软骨表面有不规则裂隙,软骨细胞数量弥漫性增多,基质染色减退,出现多重潮线记为1分;软骨裂隙深达肌层,软骨细胞成簇生长,基质染色明显减退,软骨下血管浸入肌层记为2分;软骨裂隙深达辐射层,软骨细胞数量明显减少,基质染色明显减退记为3分;软骨裂隙深达钙化层,基质染色完全消失记为4分;软骨层脱落记为5分。
2.3.2 Real-time PCR检测各组大鼠软骨组织IL-6 mRNA表达
用RNA抽提试剂提取软骨组织RNA,蛋白、核酸浓度测定仪测定RNA含量。用Promega试剂盒说明书步骤合成cDNA第一链,按Promega实时荧光定量试剂盒操作说明书进行PCR反应,反应条件为95 ℃预变性2 min,95 ℃变性15 s,58 ℃退火45 s,60 ℃延伸1 min。共45个循环。每个样品各重复3次,数据经2-ΔΔCt法处理后进行IL-6 mRNA相对表达量分析。
2.3.3 免疫组化法观察软骨组织STAT3,WIF1,SOD3蛋白表达
4%多聚甲醛固定膝关节软骨并脱钙,将石蜡切片进行脱蜡、脱水后放入配制好的枸橼酸缓冲液盒中进行微波修复;3%H2O2室温孵育30 min;5%山羊血清封闭30 min;滴加50 μL的STAT3,WIF1和SOD3抗体(一抗的稀释浓度分别为1∶100,1∶200,1∶200),同时用磷酸盐缓冲液(PBS)代替一抗设立阴性对照,将切片放入湿盒中,4 ℃过夜;滴加山羊抗兔的二抗(1∶1 000),室温下放置30 min;滴加ABC工作液,37 ℃孵育60 min;DAB显色;苏木素复染;二甲苯透明,封固。染色以软骨基质表层和中层的软骨细胞胞浆出现棕黄色颗粒为阳性染色,由甘肃中医药大学病理教研室工作人员采用双盲法进行阅片。应用美国Image-Pro Plus 6.0全自动图像分析系统对软骨细胞阳性染色的积分吸光度IA进行定量分析,以其中一个具有代表意义阳性结果的视野的棕黄色颗粒为标准自动检测所有视野的阳性结果[5]。
2.3.4 蛋白免疫印迹法(Western blot)测定软骨组织WIF1蛋白表达
用RIPA裂解液提取软骨组织蛋白质,蛋白质含量的测定用BCA法,并调整点样的蛋白质质量浓度为5 g·L-1,10 μL/每孔,作SDS-PAGE,转膜,封闭,滴加抗WIF1一抗(1∶300)孵育,滴加山羊抗兔IgG二抗(1∶2 000)孵育。采用ECL Plus超敏发光液染色观察,将溶液A和B等体积混匀后,按约0.125 mL·cm-2膜面积进行染色,室温反应1 min后置于Image Lab 3.0进行曝光,曝光条件为单个曝光时间10 s,总曝光时间60 s。用Image Lab软件分析获取各组大鼠的蛋白条带表达灰度值。
2.4 统计学分析
采用SPSS 17.0统计软件分析,实验数据用
3 结果
3.1 对KOA大鼠膝关节软骨组织形态学的影响
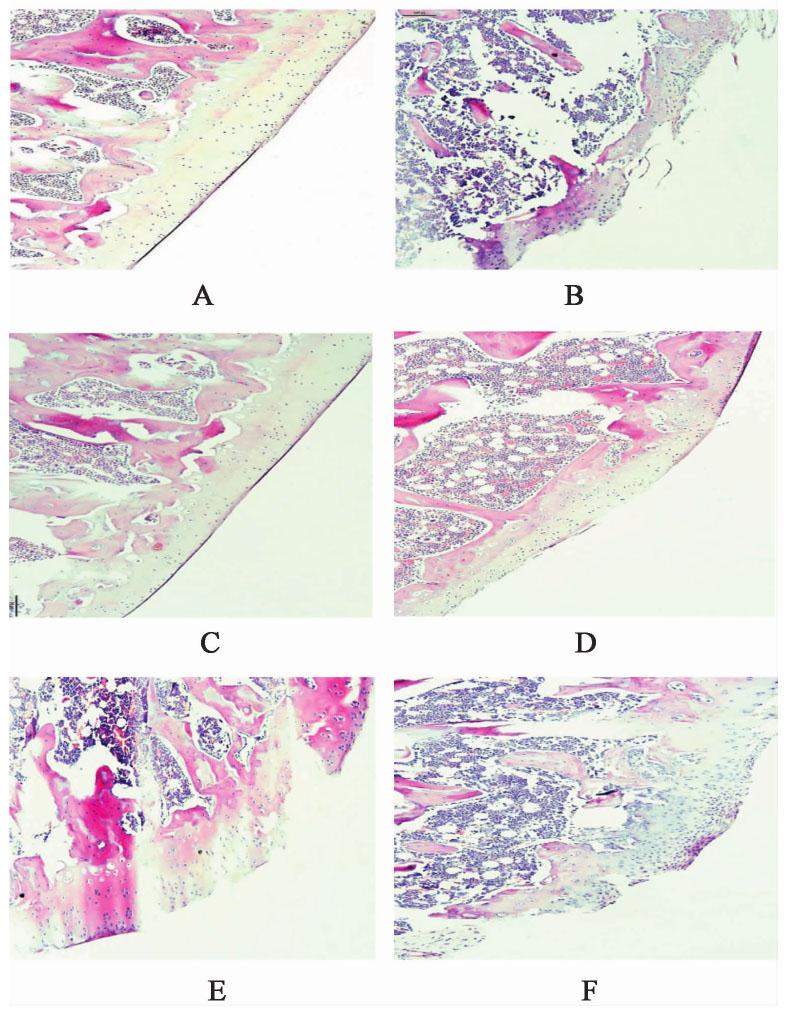
假手术组大鼠关节面及滑膜结构完整,软骨细胞呈水平排列,关节软骨边缘光滑;模型组大鼠关节软骨边缘严重破坏,软骨细胞排列紊乱;右归丸低、中剂量组关节软骨边缘不平整,软骨细胞排列紊乱;右归丸高剂量组和硫酸氨基葡萄糖组大鼠软骨结构趋于正常,软骨细胞分布偶见不均,关节软骨表面欠光滑。与假手术组比较,模型组及各干预组大鼠Mankin评分均升高(P<0.01);与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠Mankin评分均明显降低(P<0.05,P<0.01)。见图1和表1。
| 组别 | 剂量/g·kg-1 | Makin评分/分 |
|---|---|---|
| 假手术 | - | 0.33±0.073 |
| 模型 | - | 4.92±0.5391) |
| 硫酸氨基葡萄糖 | 0.17 | 2.76±0.3171,3) |
| 右归丸 | 4.8 | 3.05±0.2531,2) |
| 2.4 | 4.14±0.1591) | |
| 1.2 | 4.38±0.6211) |
3.2 对KOA大鼠软骨组织IL-6 mRNA表达的影响
与假手术组比较,模型组大鼠软骨组织IL-6 mRNA表达均显著升高(P<0.01);与模型组比较,右归丸各干预组和和硫酸氨基葡萄糖组大鼠软骨组织IL-6 mRNA表达显著下降(P<0.01)。见表2。
| 组别 | 剂量/g·kg-1 | IL-6 |
|---|---|---|
| 假手术 | - | 1.00±0.04 |
| 模型 | - | 4.66±0.021) |
| 硫酸氨基葡萄糖 | 0.17 | 1.22±0.073) |
| 右归丸 | 4.8 | 1.15±0.043) |
| 2.4 | 1.65±0.053) | |
| 1.2 | 2.27±0.093) |
3.3 对KOA大鼠软骨组织STAT3,WIF1和SOD3蛋白表达的影响
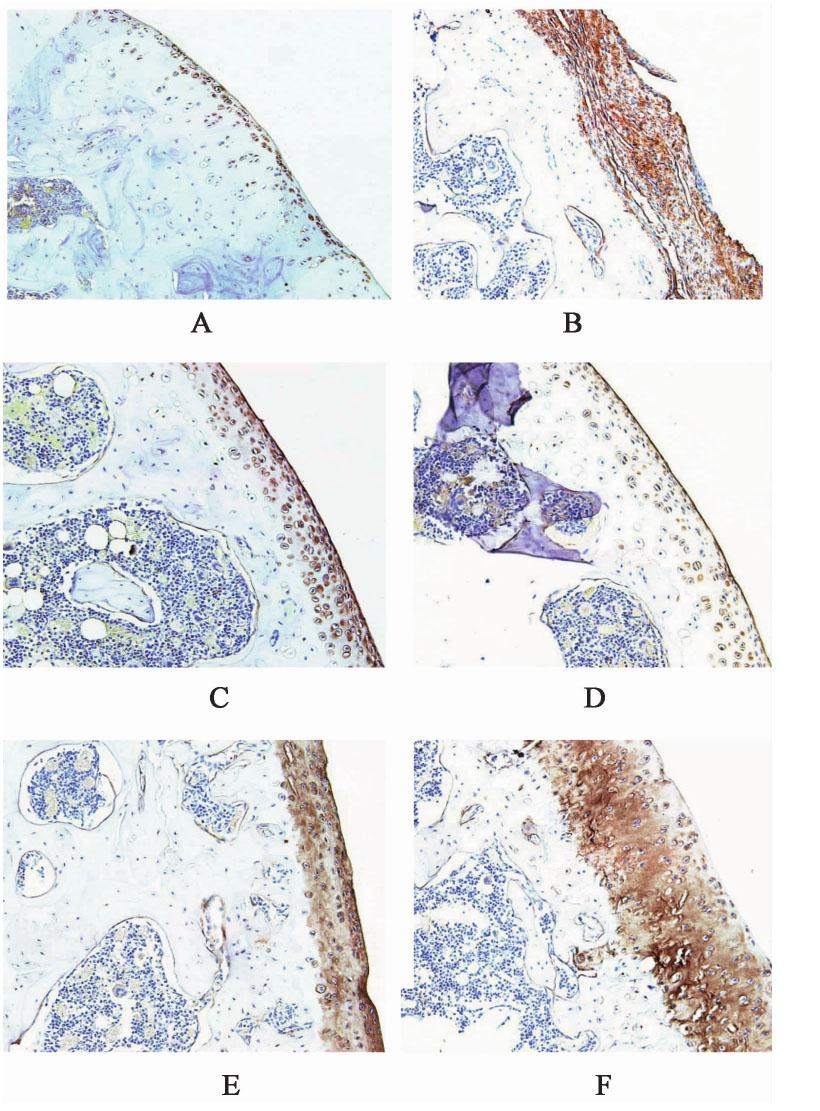
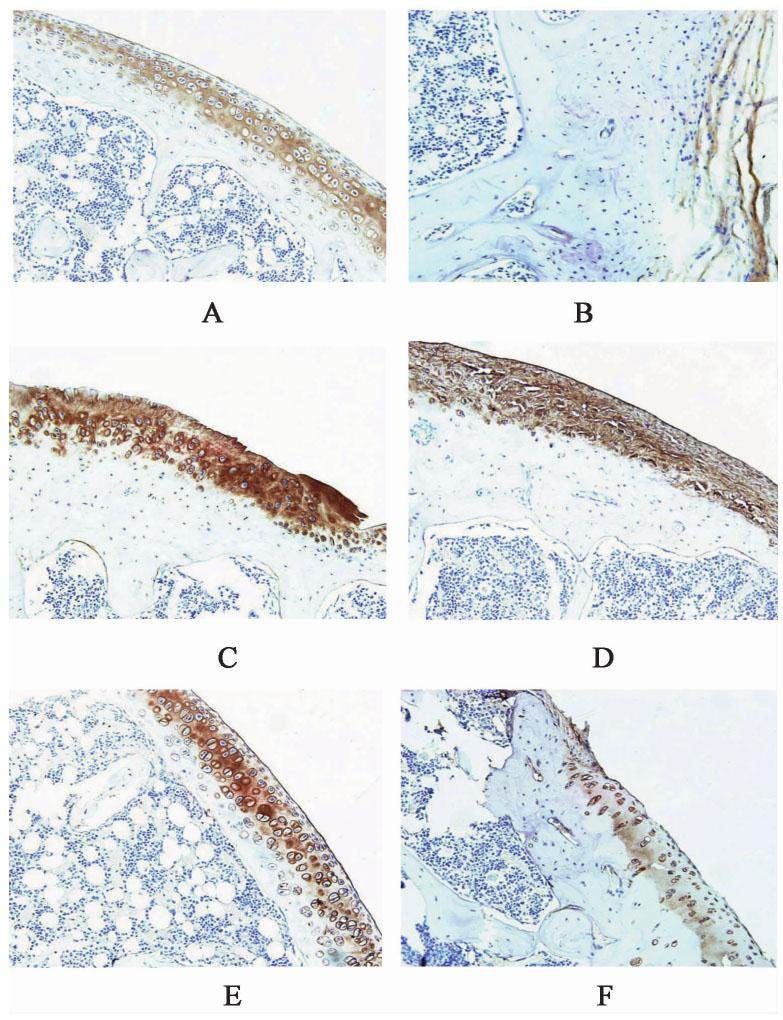
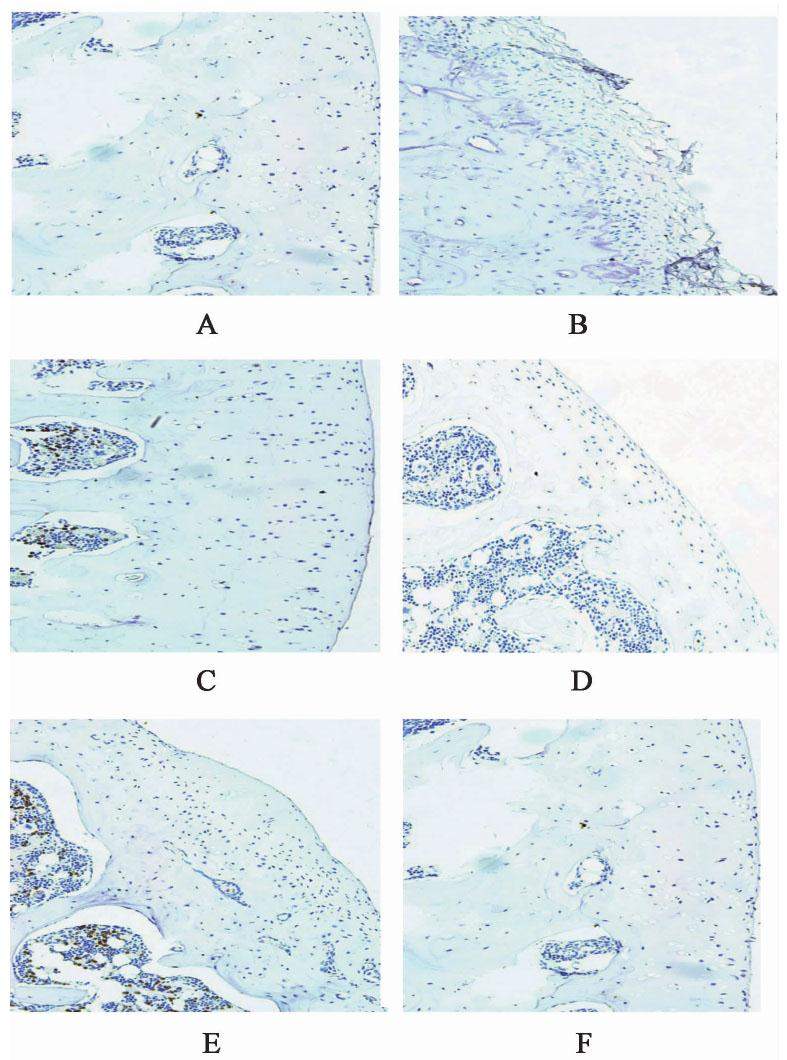
染色以软骨基质表层和中层的软骨细胞胞浆出现棕黄色颗粒为阳性染色。假手术组大鼠关节软骨细胞胞浆STAT3呈弱阳性表达,WIF1均呈阳性表达。模型组大鼠关节软骨细胞胞浆STAT3强阳性表达,WIF1呈弱阳性表达。右归丸高剂量组和硫酸氨基葡萄糖组大鼠关节软骨细胞胞浆STAT3弱阳性表达,右归丸各干预组和硫酸氨基葡萄糖组大鼠关节软骨细胞胞浆WIF1呈强阳性或阳性表达。与假手术组比较,模型组大鼠关节软骨细胞胞浆STAT3蛋白表达IA值明显升高,WIF1蛋白表达IA值显著降低(P<0.01);与模型组比较,右归丸高剂量组和硫酸氨基葡萄糖组大鼠关节软骨细胞胞浆STAT3蛋白表达IA值显著降低,而右归丸各干预组和硫酸氨基葡萄糖组大鼠关节软骨细胞胞浆WIF1蛋白表达IA值均明显升高(P<0.05,P<0.01)。SOD3的蛋白表达在假手术组、模型组、右归丸各干预组和和硫酸氨基葡萄糖组大鼠关节软骨细胞胞浆均无表达,无统计学意义。见表3和图2,图3,图4。
| 组别 | 剂量/g·kg-1 | STAT3 | WIF1 |
|---|---|---|---|
| 假手术 | - | 265 197.6±67 848.58 | 488 925.8±53 270.1 |
| 模型 | - | 611 795.2±89 857.241) | 193 296.2±26 184.191) |
| 硫酸氨基葡萄糖 | 0.17 | 403 248.4±64 829.353) | 653 377.2±38 227.373) |
| 右归丸 | 4.8 | 367 876.0±75 055.553) | 745 106.8±25 966.53) |
| 2.4 | 451 112.4±76 153.96 | 468 892.8±53 270.13) | |
| 1.2 | 527 592.0±88 418.18 | 364 786.6±60 632.82) |
3.4 对KOA大鼠软骨组织WIF1蛋白表达的影响
与假手术组比较,模型组大鼠软骨组织WIF1蛋白表达显著降低(P<0.01);与KOA模型组比较,右归丸各干预组和硫酸氨基葡萄糖干预组WIF1的蛋白表达显著升高(P<0.01)。见表4和图5。
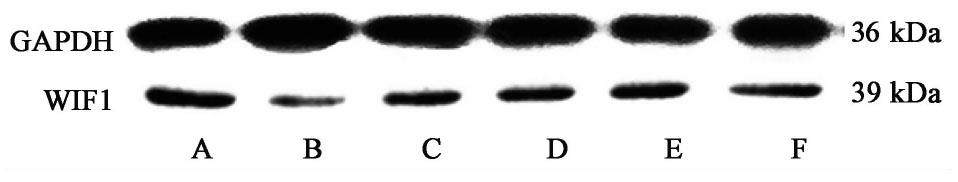
| 组别 | 剂量/g·kg-1 | WIF1/GAPDH |
|---|---|---|
| 假手术 | - | 0.79±0.02 |
| 模型 | - | 0.23±0.031) |
| 硫酸氨基葡萄糖 | 0.17 | 0.71±0.013) |
| 右归丸 | 4.8 | 0.69±0.023) |
| 2.4 | 0.65±0.033) | |
| 1.2 | 0.57±0.023) |
4 讨论
KOA属于中医的“痹证”“骨痹”“膝痹”等范畴。中医认为,KOA的主要病机特点是肝肾亏虚、气滞血瘀、痰湿凝聚等。因此,在治法中宜采用“补肝肾、强筋骨、活血祛瘀”等中药来治疗KOA。作为补肾的经典方药右归丸,主要由“熟地黄、山茱萸、枸杞子、山药、附子、肉桂、鹿角胶、菟丝子、杜仲、当归”组成,方中附子、肉桂、鹿角胶培补肾中元阳,温里祛寒,为君药。熟地黄、山茱萸、枸杞子、山药滋阴益肾,养肝补脾,填精补髓,取“阴中求阳”之义,为臣药。再用菟丝子、杜仲补肝肾,强腰膝,配以当归养血和血,共补肝肾精血,为佐药。诸药合用,以温肾阳为主而阴阳兼顾,肝脾肾并补,妙在阴中求阳,使元阳得以归原。有研究发现,补肾活血中药可显著改善KOA大鼠膝关节肿胀、软骨形态和软骨退变的作用,提示补肾活血中药治疗KOA可能具有缓解症状和修复结构的效果[8]。本实验结果也发现,假手术组大鼠关节面及滑膜结构完整,软骨细胞呈水平排列,关节软骨边缘光滑;模型组大鼠关节软骨边缘严重破坏,软骨细胞排列紊乱;给予右归丸干预后,右归丸低、中剂量组关节软骨边缘不平整,软骨细胞排列紊乱;右归丸高剂量组和硫酸氨基葡萄糖组大鼠软骨结构趋于正常,软骨细胞分布仅偶见不均,关节软骨表面欠光滑。说明右归丸治疗KOA有效,但具体机制不明。
信号转导与转录激活因子(STAT)家族成员主要包括STAT1,STAT2,STAT3,STAT4,STAT5a,STAT5b和STAT6等[9],STAT蛋白的结构中有SH2结构域,可以与干扰素-γ(IFN-γ),IL-4,IL-6和IL-21等细胞因子发生结合,在JAK的催化下使STAT发生磷酸化,磷酸化后的STAT与细胞核上的DNA的特定反应元件发生结合,诱导相应靶基因的表达[10-11]。在RA患者和胶原诱导性关节炎小鼠的研究中发现[7],核转录因子Yin Yang1是过度表达的,阻断核转录因子Yin Yang1可抑制JAK/STAT信号通路激活[12]。黄立佳等[13]的研究结果进一步发现,KOA模型鼠血清中肿瘤坏死因子-α(TNF-α)及IL-1β的含量和关节软骨中磷酸化(p)-STAT1和裂解半胱氨酸蛋白酶-3(cleaved Caspase-3)蛋白表达水平均明显升高,说明KOA模型鼠STAT-1/Caspase-3信号通路是激活的,给予阿托伐他汀钙治疗后,其可以明显减少KOA模型鼠TNF-α及IL-1β的分泌来抑制STAT-1/Caspase-3信号通路,达到延缓关节退变的目的。另有研究发现[14-15],促炎因子分泌增加和抗炎因子分泌减少导致了KOA关节软骨合成代谢和分解代谢的失衡,是引发KOA的根本原因。本研究结果发现,模型组大鼠软骨组织IL-6 mRNA表达增加,STAT3的蛋白表达增加,右归丸干预组大鼠软骨组织IL-6 mRNA表达降低,STAT3的蛋白表达降低。说明右归丸对于KOA具有保护作用,其机制可能与干扰IL-6/STAT3信号通路来延缓KOA模型鼠关节软骨退变有关。
WIF1是一种能抑制Wnt信号通路的细胞外蛋白质。WIF1结构中的WD区域是Wnt配体的结合区域,二者形成的复合物可以阻断Wnt配体蛋白与Frizzled受体及辅助受体LRP5/6的结合,从而抑制Wnt信号向细胞核内的传导,使细胞核内Wnt下游的靶蛋白如基质金属蛋白酶和炎症因子IL-6的表达下降,从而抑制炎症反应和细胞增殖,促进细胞凋亡。已有研究发现,WIF1在骨关节炎中的表达是降低的[16-17]。本研究结果也发现,KOA模型鼠软骨组织中WIF1的蛋白表达明显下降,而右归丸干预组大鼠软骨组织中WIF1的蛋白表达明显升高,说明WIF1的高表达可以阻断配体蛋白Wnt与受体蛋白Frizzled的结合,从而促使细胞液中的β-catenin不断发生磷酸化,抑制了β-catenin的表达,从而使Wnt/β-catenin信号通路的活化被阻断[18-19],进一步减少了KOA模型鼠ECM的降解和延缓了其关节软骨的破坏。
因此,右归丸治疗KOA有确切疗效,其可能机制是通过抑制IL-6/STAT3信号通路中IL-6和STAT3的产生来抑制炎症反应或通过促进Wnt信号通路抑制蛋白WIF1蛋白的表达来阻断Wnt信号通路,从而减少细胞外基质(ECM)的降解和延缓关节软骨的破坏,发挥延缓关节软骨组织退变的作用。但是鉴于KOA发病机制的复杂性,右归丸是否仅通过IL-6/STAT3信号通路或Wnt信号通路,或者还有其他信号通路来发挥作用,有待进一步的研究。

