肝衰竭是由多种原因引起的肝脏损害,进而导致肝脏合成、解毒、代谢和生物转化功能严重障碍或失代偿,以短期内出现黄疸、凝血功能障碍、肝性脑病等表现为特征[1]。其中急性肝衰竭进展迅速、病死率极高[2]。目前肝衰竭的内科治疗尚缺乏特效药物和手段[2-3],短时期内出现大量炎性细胞浸润和肝细胞坏死是急性肝衰竭主要的临床病理特点[4-6]。
中医学没有“肝衰竭”病名,根据其临床表现可归属于“急黄”“瘟黄”“血症”“肝瘟”等范畴。古代医家多认为本病在外主要是感受湿热疫疠之邪,在内主要是湿热相搏、瘀热交结[7]。现代中医认为,肝衰竭以正虚标实为证候特点,“毒”“瘀”“湿”“热”胶结,其中正虚乃致病之根本,湿热为致病之病因,血瘀是病理之产物,故治疗上应扶正补虚、清热解毒、活血化瘀等。研究者也按照辨证论治的方法,采用经方或自拟方剂治疗,其中以扶正补虚法、解毒凉血活血法、清热利湿法为典型代表[7-10]。
补中益气汤是金元医家李东垣根据其脾胃理论创立的经典名方,由炙甘草、党参片、白术、北柴胡、当归、升麻和陈皮8味药物组成,是调补脾胃,升阳举陷的古方[11],现代则广泛应用于各科[12-13]。随着对补中益气汤的深入研究,发现其具有广泛的抗肿瘤和免疫调节作用[14-15]。既往研究显示补中益气汤还能缓解慢性萎缩性胃炎,减轻癌性发热,调节支气管哮喘缓解期患儿炎症指标、免疫功能,表明其具有抗炎功能[10-11,16-19]。过度的炎症反应也是急性肝衰竭的病理损伤机制之一,然而,补中益气汤对急性肝衰竭的作用尚未见报道。因此,本研究拟利用刀豆蛋白A(ConA)诱导的急性肝衰竭小鼠模型探讨补中益气汤的保护作用及机制。
1 材料
1.1 动物
80只SPF级C57BL/6小鼠,雄性,6~8周,体质量(20±2)g,购自北京华阜康生物科技股份有限公司,合格证号SCXK(京)2014-0004。小鼠采用标准饲料分笼饲养,自由饮水,室内温度(22±2) ℃,室内湿度45%±5%,光照时间为12 h/12 h明暗交替。动物实验符合首都医科大学附属北京地坛医院伦理委员会标准。
1.2 药物与试剂
补中益气汤:黄芪36 g,炙甘草18 g,党参片12 g,白术18 g,北柴胡12 g,当归6 g,升麻12 g,陈皮12 g,均购自北京同仁堂公司。上述中药饮片水煎浓缩到75 mL,生药质量浓度为1.68 g·mL-1,-20 ℃分装保存;ConA(美国Sigma公司,批号SLBJ740Ⅳ);环孢素A(CsA,美国MCE公司,批号34562);流式微球技术(CBA)细胞因子检测试剂盒,小鼠CD4+T淋巴细胞磁珠分选试剂盒(美国BD公司,批号分别为5126755,5160606598);佛波酯(PMA)/离子霉素复合物(美国Thermo Fisher公司,批号1993948);抗CD3-PerCP,CD4-APC,CD8-FITC流式抗体,BCA蛋白定量试剂盒(美国Thermo Fisher公司,批号分别为44569,7073727,4329219,SE253117A);抗IL-2-PE,IFN-γ-PE,IL-4-PE流式抗体(美国BD公司,批号分别为13533,25374,08528);抗细胞外调节蛋白激酶1/2(ERK1/2),p-ERK1/2,p38丝裂原活化蛋白激酶(p38 MAPK),p-p38 MAPK,甘油醛-3-磷酸脱氢酶(GAPDH)抗体及辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国CST公司,批号分别为14,12,6,10,12,28);苏木素-伊红(HE)染色试剂盒(北京索莱宝科技有限公司,批号20141205)。
1.3 仪器
MEGAFUGE 1.0R型多用途离心机(美国Thermo Fisher公司);FACS Calibur型流式细胞仪(美国BD公司);Bp2215型精密电子分析天平(美国Sartorius公司);Microfuge 22R型低温梯度离心机(美国Hettich公司);SIM-F124型制冰机(日本三洋公司);7020型全自动生化分析仪(日本日立公司);Power Blotter-Semi-dry型转膜仪,Mini Gel Tank型电泳仪(美国Thermo Fisher公司)。
2 方法
2.1 造模、分组及给药
将80只小鼠随机分成5组,每组16只,分别为正常组,模型组,CsA组(50 mg·kg-1),补中益气汤高剂量组(即临床等效剂量组,21 g·kg-1)[14]及补中益气汤低剂量组(10.5 g·kg-1)。临床等效剂量按人与小鼠体表面积比值计算得出,即小鼠剂量为人剂量的9.1倍。除正常组外,其余各组随机选取10只小鼠按15 mg·kg-1静脉注射ConA,分别于造模3,10 h后取材检测。补中益气汤低、高剂量组分别于造模后30 min单次灌胃给药,正常组和模型组给予同体积双蒸水灌胃,CsA组进行单次静脉注射给药。ConA注射8 h后血清肝功能各指标水平达正常小鼠的10倍则为造模成功[20]。
2.2 标本采集及处理
ConA注射3,10 h后,眼球取血,3 000 r·min-1离心20 min取上清液,-80 ℃分装保存,用于血清肝功能和细胞因子检测。留取肝脏最大一片肝叶置于4%多聚甲醛中固定,保持组织结构完整,用于制作病理切片。留取新鲜脾脏用于分选T淋巴细胞。
2.3 全自动生化分析仪检测血清ALT,AST水平
留取造模后10 h的血清,吸取50 μL加入到含有150 μL生理盐水的离心管中稀释,充分混匀后,放进质控后的7020型全自动生化分析仪样品盘中,ALT,AST试剂均为即用液体试剂,直接放入仪器试剂盘中,混匀,37 ℃恒温10 min。在主波长340 nm和副波长405 nm处,准确测定各孔吸光度A。
2.4 CBA法检测血清细胞因子
留取造模后3,10 h的血清50 μL,加入到已混合好6种细胞因子微球的流式管中(包括标准品和阳性对照),加PE检测抗体,充分混匀后,室温下避光孵育2 h。在此期间,进行流式细胞仪的设定步骤。孵育完成后,加入Wash Buffer 1 mL并200×g离心5 min。小心吸走各检测管中的上清,每管加入Wash Buffer 300 μL,重悬微球沉淀物,振荡试管,立即上流式细胞仪检测细胞因子TNF-α,IL-6,IL-12,IFN-γ,MCP-1水平。TNF-α,IL-6,IL-12,MCP-1为造模后3 h检测,IFN-γ为造模后10 h检测。
2.5 HE染色检测肝组织病理变化
肝组织浸泡于4%多聚甲醛溶液室温固定24 h后,按照标准步骤脱水、包埋,切片3 μm,烤片,HE染色、树胶封片等,光学显微镜下观察各组之间肝组织病理学变化。
2.6 流式细胞术检测T淋巴细胞活化
采用小鼠CD4+T淋巴细胞磁珠分选试剂盒分选造模后10 h小鼠脾脏CD4+T细胞,流式细胞术鉴定纯度90%以上方可进行后续实验。细胞按1×105个/L接种于96孔板,除正常组外,其余各组细胞采用PMA/离子霉素复合物刺激5 h,随后采用抗CD3-PerCP,CD4-APC,CD8-FITC抗体进行细胞表面染色,IL-2-PE,IFN-γ-PE,IL-4-PE抗体进行胞内染色,流式检测IL-2,IFN-γ及IL-4的表达情况。
2.7 蛋白免疫印迹法(Western blot)检测小鼠肝脏ERK1/2,p38 MAPK蛋白的表达及磷酸化
提取小鼠肝组织总蛋白,采用BCA蛋白定量试剂盒测定各组蛋白浓度。取总蛋白50 μg进行SDS-PAGE电泳,转膜后封闭1 h,按抗体说明书加入ERK1/2,p-ERK1/2,p38 MAPK,p-p38 MAPK一抗(1∶1 000);GAPDH(1∶3 000)置4 ℃冰箱过夜,洗膜,加入HRP标记的山羊抗兔二抗(1∶5 000),化学发光法曝光。采用Image J软件分析目标条带灰度值。
2.8 统计学分析
本实验数据处理采GraphPad Prism 7软件进行统计学分析。计量资料采用
3 结果
3.1 对ConA致急性肝衰竭小鼠血清肝功能水平的影响
与正常组比较,模型组小鼠血清中ALT和AST水平均显著升高(P<0.01);与模型组比较,CsA组和补中益气汤高剂量组ALT和AST水平明显降低(P<0.05,P<0.01)。见表1。
| 组别 | 剂量/g·kg-1 | ALT | AST |
|---|---|---|---|
| 正常 | - | 27.9±4.0 | 88.6±8.8 |
| 模型 | - | 2 025.1±563.11) | 2 270.0±614.31) |
| 环孢素A | 0.05 | 104.4±35.53) | 300.3±72.92) |
| 补中益气汤 | 10.5 | 1 779.3±391.2 | 1 941.2±523.7 |
| 21 | 159.2±26.83) | 183.0±23.33) |
3.2 对ConA致急性肝衰竭小鼠肝组织病理形态的影响
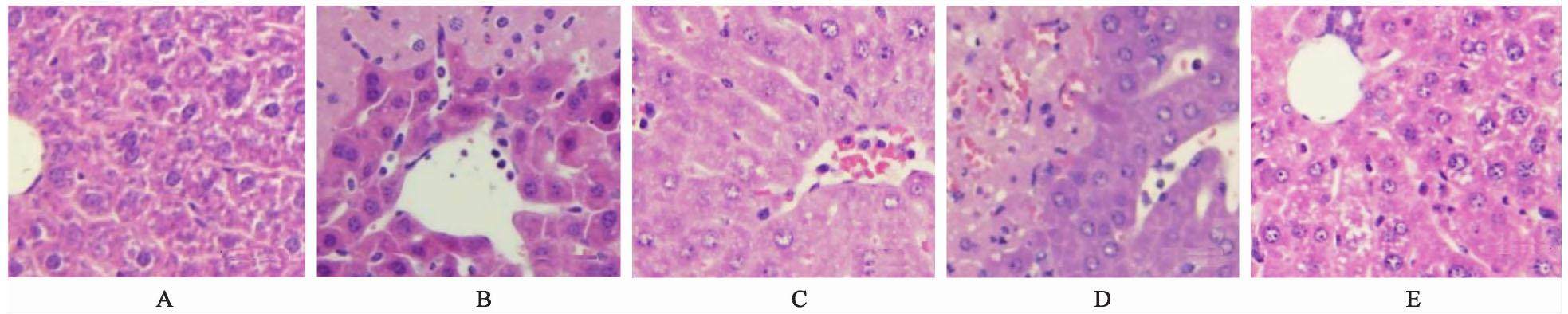
光镜下观察HE染色肝组织形态,正常组小鼠肝小叶形态结构完整,表面光滑,肝索呈放射状,肝血窦及汇管区清晰,无明显炎性细胞浸润;模型组出现广泛的肝细胞变性,肝小叶结构紊乱,大量炎性细胞浸润,甚至出现大片坏死灶;与模型组比较,CsA组肝细胞结构基本完整,仅少量炎性细胞浸润;补中益气汤低剂量组肝细胞变性明显,肝小叶结构紊乱,大量炎性细胞浸润,肝损伤未见明显减轻;补中益气汤高剂量组肝细胞、肝索结构完整,未见明显的炎性细胞浸润和肝细胞坏死。见图1。
3.3 对ConA致急性肝衰竭小鼠炎性细胞因子分泌的影响
与正常组比较,模型组小鼠血清TNF-α,IL-6,IL-12,IFN-γ和MCP-1含量均显著升高(P<0.01);与模型组比较,CsA组和补中益气汤高剂量组TNF-α,IL-6,IL-12,IFN-γ和MRP-1水平均明显降低(P<0.05,P<0.01),补中益气汤低剂量组IL-12水平明显降低(P<0.05),其他指标与模型组比较无明显差异。见表2。
| 组别 | 剂量/g·kg-1 | TNF-α | IL-6 | IL-12 | IFN-γ | MCP-1 |
|---|---|---|---|---|---|---|
| 正常 | - | 0.007±0.001 | 0.025±0.009 | 0.002±0.001 | 0.006±0.001 | 0.024±0.010 |
| 模型 | - | 0.544±0.0491) | 2.084±0.0521) | 0.204±0.0561) | 0.772±0.1511) | 4.961±0.1191) |
| 环孢素A | 0.05 | 0.241±0.0383) | 0.561±0.0433) | 0.125±0.0213) | 0.187±0.0492) | 1.649±0.3132) |
| 补中益气汤 | 10.5 | 0.456±0.228 | 1.815±0.474 | 0.168±0.0392) | 0.621±0.254 | 3.645±1.824 |
| 21 | 0.203±0.0363) | 0.632±0.1043) | 0.110±0.0133) | 0.379±0.0822) | 1.801±0.1683) |
3.4 对ConA致急性肝衰竭小鼠脾脏T淋巴细胞活性的影响
与正常组比较,模型组小鼠脾脏CD4+T淋巴细胞中IL-2,IFN-γ和IL-4表达显著上调(P<0.01);与模型组比较,CsA组小鼠CD4+T淋巴细胞中IL-2,IFN-γ和IL-4表达显著下调(P<0.01);补中益气汤低剂量组与模型组比较无明显差异;补中益气汤高剂量组IL-2和IFN-γ表达明显下调(P<0.05,P<0.01)。见表3。
| 组别 | 剂量/g·kg-1 | IL-2 | IFN-γ | IL-4 |
|---|---|---|---|---|
| 正常 | - | 0.8±0.1 | 0.3±0.1 | 0.2±0.0 |
| 模型 | - | 29.1±0.91) | 4.2±0.31) | 5.5±0.61) |
| 环孢素A | 0.05 | 11.1±1.23) | 0.8±0.13) | 1.9±0.13) |
| 补中益气汤 | 10.5 | 25.5±2.8 | 3.8±0.4 | 5.6±0.8 |
| 21 | 14.4±1.12) | 1.5±0.33) | 4.9±0.3 |
3.5 对ConA致急性肝衰竭小鼠肝脏ERK1/2及p38 MAPK信号通路的影响
与正常组比较,模型组小鼠肝脏ERK1/2,p38 MAPK磷酸化水平显著上调(P<0.01);与模型组比较,CsA组p-ERK1/2水平显著降低,补中益气汤高剂量组p-ERK1/2及p-p38水平显著降低(P<0.05,P<0.01)。见图2,表4。
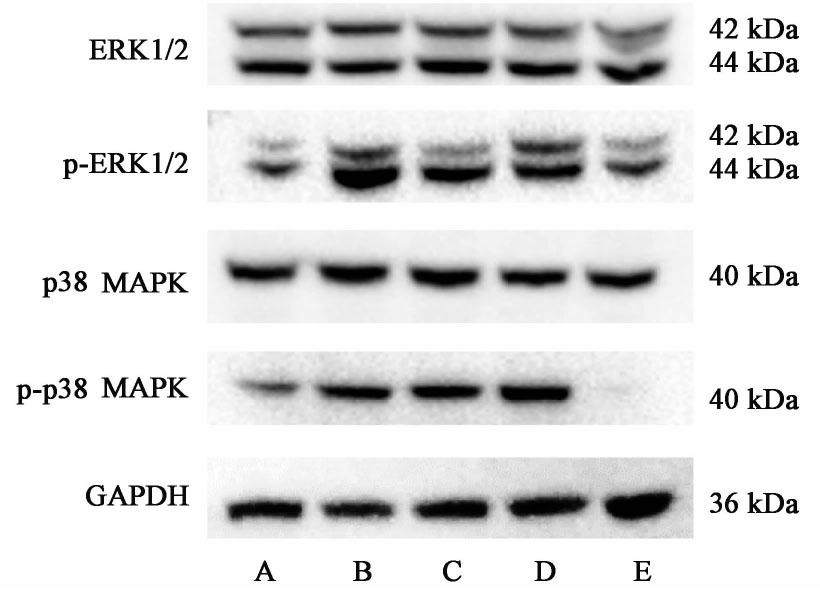
| 组别 | 剂量/g·kg-1 | ERK1/GAPDH | p-ERK1/GAPDH | ERK2/GAPDH | p-ERK2/GAPDH | p38 MAPK/GAPDH | p-p38 MAPK/GAPDH |
|---|---|---|---|---|---|---|---|
| 正常 | - | 0.33±0.06 | 0.09±0.02 | 0.46±0.08 | 0.22±0.04 | 0.45±0.07 | 0.23±0.04 |
| 模型 | - | 0.33±0.05 | 0.26±0.041) | 0.43±0.05 | 0.62±0.111) | 0.54±0.09 | 0.50±0.081) |
| 环孢素A | 0.05 | 0.35±0.07 | 0.19±0.042) | 0.50±0.09 | 0.49±0.052) | 0.50±0.07 | 0.49±0.06 |
| 补中益气汤 | 10.5 | 0.31±0.05 | 0.32±0.05 | 0.44±0.08 | 0.46±0.10 | 0.41±0.06 | 0.54±0.07 |
| 21 | 0.28±0.04 | 0.15±0.032) | 0.40±0.07 | 0.27±0.063) | 0.40±0.06 | 0.07±0.023) |
4 讨论
急性肝衰竭由多种因素引起,在我国主要是以肝炎病毒(尤其是乙型肝炎病毒)为主,其次是药物及自身抗原[2,21]。尽管引起急性肝衰竭的病因复杂,但是肝脏免疫应答紊乱是病毒性肝炎、药物性肝炎和自身免疫性肝炎的共同发病机制[22]。ConA是一种植物来源的凝集素,能快速激活T淋巴细胞(尤其是CD4+T淋巴细胞)并特异性攻击肝脏[20]。采用ConA注射小鼠能很好地模拟急性肝衰竭的病理特点,是国际上广泛应用的动物模型[23-26]。基于ConA致急性肝衰竭小鼠模型的药效分析研究中,血清转氨酶活性和肝组织病理损伤是评价药效的核心指标。本研究采用造模后治疗性给药,通过以上三方面评估,充分证明了高剂量补中益气汤对急性肝衰竭的保护作用。
在肝衰竭发生发展过程中,肝组织依次经历了免疫损伤、缺血缺氧损伤以及内毒素血症三重打击,其中免疫损伤至关重要。肝衰竭发病过程中,天然免疫和适应性免疫均参与了肝脏免疫损伤[27]。临床和基础研究显示,单核-巨噬细胞、中性粒细胞、自然杀伤(NK)细胞、树突状细胞(DC)等天然免疫细胞,以及T淋巴细胞,B淋巴细胞等适应性免疫细胞,均有不同程度的肝脏浸润[28-30]。在ConA诱导的急性肝衰竭模型中,脾中的T淋巴细胞增殖活化,成为效应T细胞,经趋化因子和黏附分子的作用,被肝窦内皮细胞募集至肝窦和肝小叶部位,浸润的效应T细胞持续增殖活化,分泌IL-2,IFN-γ等细胞因子,启动Th1免疫应答[31-32]。研究表明,采用地塞米松,CsA等免疫抑制剂提前处理ConA诱导的急性肝衰竭小鼠,能有效减少肝脏中T淋巴细胞的浸润,减轻肝脏损伤[33-34]。提前注射抗CD4抗体能明显改善肝损伤、降低血清氨基转移酶水平,而注射抗CD8抗体则没有这种保护作用[20]。说明CD4+T细胞是ConA诱导肝损伤的主要效应细胞。本研究结果表明高剂量补中益气汤能显著抑制脾脏CD4+T淋巴细胞活化,降低IL-2,IFN-γ分泌水平,发挥类似免疫抑制剂CsA的效应。
此外,在肝衰竭的发生机制中,细胞因子风暴也具有十分重要的作用。细胞因子风暴不仅表现为多种细胞因子快速释放,更重要地,细胞因子之间还会形成瀑布样级联活化反应,对组织、器官造成严重损伤[35-36]。临床研究表明,肝衰竭患者血清中TNF-α,IL-6和IFN-γ等炎性细胞因子水平显著高于健康人,其中TNF-α和IL-6水平随疾病严重程度的增加而增加,检测其血清水平有助于判断疾病严重程度和预后转归情况[35]。TNF-α,IL-6,IL-12和MCP-1主要由单核-巨噬细胞,DC等髓系细胞分泌,IFN-γ主要来自于活化的NK,T淋巴细胞。高剂量补中益气汤对TNF-α,IL-6,IL-12,IFN-γ以及MCP-1分泌均有显著的抑制作用,表明其具有多靶点的抗炎作用,也体现了中药方剂配伍“多组分、多靶点”的优势。
MAPK通路是一组能被不同的细胞外刺激,如病原分子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶。其中ERK1/2(p44/42),p38 MAPK是重要的家族成员。在受到刺激的情况下,细胞启动一个连续的蛋白激酶三级联反应,由MAP激酶激酶激酶(MAP3K),MAP激酶激酶(MAP2K)和MAP激酶(MAPK)组成。级联反应通过分别使活化环残基Thr202/Tyr204和Thr185/Tyr187磷酸化,从而激活p44和p42,即ERK1/2分子。p38 MAPK也是参与控制细胞因子的关键信号分子,可通过各种细胞应激被激活,包括渗透休克,炎性细胞因子,脂多糖,紫外线和生长因子。本研究中,发现补中益气汤能显著抑制ERK1/2和p38 MAPK磷酸化,表明该方剂对MAPK通路活化起重要的抑制作用,也提示MAPK通路可能是补中益气汤发挥抗炎作用的重要机制。
补中益气汤方中重用黄芪,补中益气,升阳固表,为君药;臣以党参片、炙甘草、白术补气健脾,以增强黄芪补益中气之功;血为气之母,气虚时久,营血亦亏,故用当归养血和营,协党参片、黄芪以补气养血;陈皮理气和胃,使诸药补而不滞;以少量升麻、柴胡升阳举陷,协助君药以升提下陷之中气,共为佐使。诸药合用,共奏补气升阳、甘温除热之功。本研究中,补中益气汤对急性肝衰竭的保护作用,充分体现了该方不仅有补益中气、升阳举陷之功,还具有甘温除热、扶正祛邪之效,也为补中益气汤古方新用拓宽了思路。
综上所述,补中益气汤对ConA所致急性肝衰竭小鼠具有良好的保护作用,其作用机制可能与抑制CD4+T淋巴细胞活化、减轻细胞因子风暴有关。该方对急性肝衰竭的药理机制还体现出多靶点的抗炎作用,通过拆方分析及网络药理学等手段进一步解析药物关键起效成分及作用机制,将有助于促进补中益气汤的现代化应用。

