经典名方在我国有着悠久和丰富的药用历史,开发经典名方对提高临床疗效,维护公众健康,提升中药产业具有积极的意义[1]。2018年5月,国家药品监督管理局发布《古代经典名方中药复方制剂简化注册审批管理规定》(以下简称《管理规定》)明确了经典名方复方制剂开发的研究原则[2]。《管理规定》中明确指出经典名方复方制剂开发必须首先进行物质基准研究,为其后的制剂开发提供依据。由此可见,与其他新药的研发不同,经典名方复方制剂开发是先有“标准”后有产品。“经典名方物质基准”,是指以古代医籍中记载的经典名方制备方法为依据制备而得的中药药用物质的标准,除成型工艺外,其余制备方法应当与古代医籍记载基本一致。该规定充分体现了“经典名方基准物质”研制的意义和重要性。
2019年3月27日,为落实《管理规定》,规范古代经典名方中药复方制剂注册申报工作,国家药品监督管理局组织起草了《古代经典名方中药复方制剂及其物质基准的申报资料要求(征求意见稿)》(以下简称《申报资料(征求意见稿)》)[3]。该文件要求较为明确,进一步推动了经典名方开发进展。然而,“经典名方物质基准”作为药物研发体系中的“新名词”,虽然前有宏观的定义后有政策指导,但由于研究尚处于摸索阶段,尚无注册申报成功案例,其研制过程仍存在一些关键问题未达成统一共识和标准[4]。因此,笔者以为在国家正式出台“物质基准”实施细则前有必要对其有关情况进行深入探讨。本文针对《管理规定》和《申报资料(征求意见稿)》中的有关规定,结合本课题组在该领域的实际工作情况,阐述“经典名方物质基准”研制策略和关键问题,以期为经典名方开发及其政策落地提供启示和参考。
1 研究经典名方物质基准的意义
“物质基准”属于“新瓶装旧酒”,其定义、作用与“标准汤剂”一致[5]。《管理规定》的起草说明中明确指出,对汤剂而言,该经典名方物质基准又可称为“标准汤剂”。因而“物质基准”核心作用就是衡量制剂与中医临床所使用的药用物质是否一致。
《管理规定》指出“经典名方物质基准”应充分考虑药材来源、饮片炮制、制剂生产及使用等各环节影响质量的因素,系统开展药材、饮片、中间体、物质基准对应实物及制剂的质量研究,综合考虑其相关性,并确定关键质量属性,据此建立相应的质量评价指标和评价方法,确定科学合理的药品标准,加强专属性鉴别和多成分、整体质量的控制。由此可见,“经典名方物质基准”具备传承性、追溯性、一致性三大功能属性。传承性指的是其制备方法应与古代医籍记载一致,要求遵循传统的中医药理论,按照古法工艺制备而成;追溯性指的是从源头进行把关,在保证投料质量的同时对制备过程进行控制,讲求全链条的质量控制以保证产品质量均一和稳定;一致性指的是除了成型工艺外,要求经典名方制剂与其申报的物质基准的质量控制指标均基本一致。物质基准是制剂内在质量的实物对照,是大生产提取工艺优化及其制剂质量标准制订的依据。
2 经典名方物质基准研制策略
根据本课题组经典名方开发经验,在分析《管理规定》和《申报资料(征求意见稿)》2个文件内容基础上理解“物质基准”研制过程应涵盖5个阶段:处方考证及历史沿革研究、药味收集和质量评价、饮片炮制方法和质量评价、物质基准的制备和质量研究、物质基准质量标准的起草和制定。五阶段内容环环相扣,互为一体,见图1。
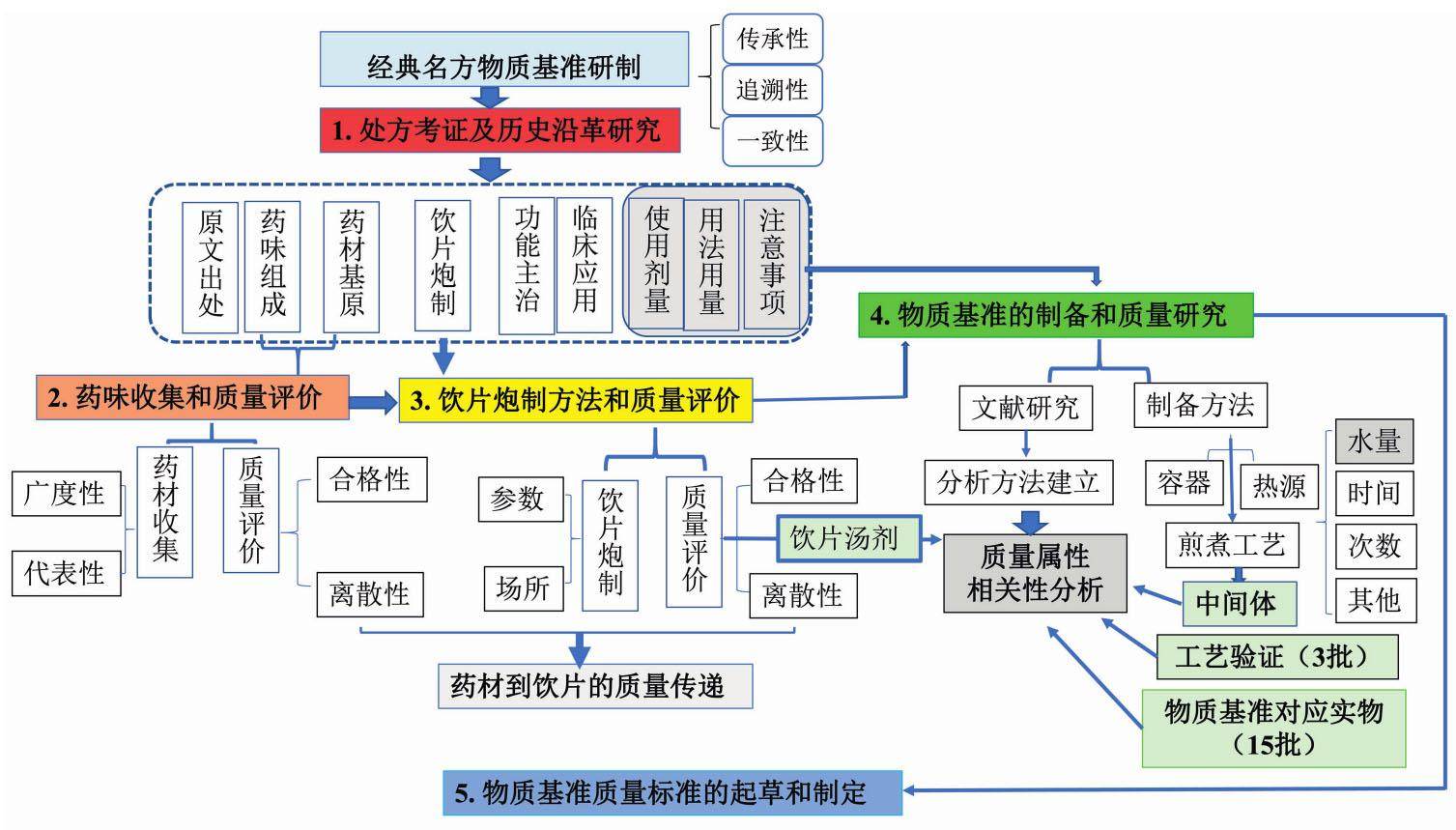
2.1 处方考证及历史沿革研究
2018年4月,国家中医药管理局公布了《古代经典名方目录(第一批)》[6]。这些经典名方是经专家反复论证而遴选出来的,均是源于古代,沿用至今,疗效确切,且具有特色的方剂。然而非常可惜的是,目前经典名方的遴选原则依然不为大众所知。随着年代更迭,组成这些经典名方的不少饮片品种和药用部位都有着或多或少的变化。因此,为了确保古方临床使用的安全性和有效性,确定经典名方中药药味品种和药用部位就显得非常关键。《申报资料(征求意见稿)》中明确要求必须有处方考证及历史沿革研究资料。处方考证及历史沿革研究作为“经典名方物质基准”研制过程的“排头兵”,将决定经典名方后期工作开展的成败,应予以充分重视。
通过处方考证及历史沿革研究,申报者需明确处方原文出处、药味组成、药材基原、饮片炮制、使用剂量、用法用量、注意事项、功能主治、临床应用9项内容,此9项内容可按如上次序进行研究。前8项内容又被统称为“处方来源”考证,需要提供处方原文及著者、颁布朝代或年代;明确原文记载的处方药味组成、炮制方法和剂量、用法用量、功能主治,说明处方中每一药味的规范名称,提供历代本草文献及出处(包括作者、出版年份以及版本情况),整理并收集处方历史沿革资料,提供全面反映处方历史沿革的综述资料;“临床应用”部分,则需要研究者除了要通过文献综述方式总结分析以反映经典名方的有效性和安全性情况外,还要重点阐明其在现代临床应用的价值,并对其市场前景加以论述和预测。
依据前期研究经验,处方考证与历史沿革研究主要依赖于历史文献的查找和整理。张卫等[7]认为应该通过查阅文献、整理文献和选择文献3个关键步骤完成经典名方药材基原的考证,其方法值得借鉴和推广到经典名方考证工作中。处方考证与历史沿革研究将“处方来源及历史沿革”和“临床应用”两部分有机结合起来形成综述文献资料,既能充分展现经典名方历史意义和临床价值,又能排除市场价值低的项目,起到降低研发风险作用。
由于度量衡的变化、资源的变化、用药习惯的变化和著作版本的变化等,处方考证面临的困难超出想象[8]。历史越悠久,考证越困难,尤以《伤寒论》为甚。《申报资料(征求意见稿)》中提及,起草经典名方的说明书时需提供相关依据,如相关专家共识等。通过专家共识解决品种考证争议问题,思路很好。但是目前“专家共识”并非是一个严格的概念,在经典名方注册时如何界定不明确,目前尚无文件针对专家共识所需专家数量和层次等作相应规定,未来将可能存在2个专家团体针对同一问题给出完全不同结论的情形。
2.1.1 处方选用药味的问题
经典名方处方考证和历史沿革研究时常发现古籍文献记载本身的不完整、不明确或不一致,导致原方药味选用时出现基原缺乏、药用部位不一致、炮制工艺差异等问题[9],这些问题若不能妥善处理将影响或阻碍经典名方物质基准的研制。
①处方中某味药材“有无”的差别。以甘草泻心汤为例,其在西晋王叔和整理编制的《伤寒论》中无“人参”药味,在宋代林亿整理校注的《伤寒论》版本中该方原文有“人参”,全国中医药行业高等教育“十二五”规划教材《方剂学》(第九版,中国中医药出版社)所载甘草泻心汤组方中也有“人参”这一药味,但在《古代经典名方目录(第一批)》所载的甘草泻心汤却没有“人参”这味药。②处方中未明确药材药用部位。以桂枝为例,宋代以前(汉唐),桂枝系指桂树的枝皮,实际上与现今的肉桂相同;宋代以后,桂枝的入药部位逐渐上移,以幼嫩的枝条入药,才与现今的桂枝一致[10]。③用传统方法无法区分药材的多基原。例如车前子的基原为车前科植物车前或平车前的成熟干燥种子,传统的鉴别方法无法区别这2种不同基原的种子,只能通过DNA条形码进行区分。据文献报道,多基原品种涉及中成药处方4 847种,占现有中成药总数的68%。其在中成药处方中可能的组合数量大,对中成药影响范围广,应该引起行业和监管部门的重视[11],呼吁尽快出台相应指导意见。④处方所选用的饮片炮制方法存在差异[12-13]。例如地黄,古代“九蒸九晒”,现代“一蒸一晒”;甘草,古代蘸水炙,现代蜜炙;炮制方法“焙”在2015年版《中国药典》无标准操作等。
针对以上情况,笔者建议可采取以下方式应对:①国家有明确结论的东西,以国家结论为准。即当处方出现争议时,以国家中医药管理局颁布的处方为准。因为按照《中华人民共和国中医药法》等相关管理办法,经典名方的名单由国家有关部门发布。既然国家中医药管理局代表国家颁布了经典名方的名单,从经典名方开发的角度,不应该对这些名单进行质疑。比如不应该再讨论某个处方是否应该是或不是经典名方,某个处方药味是否增减问题等。当然,从学术的角度任何有疑问的东西都值得深入讨论,而企业开发经典名方时则无需额外讨论。②由于国家中医药管理局颁布经典名方时,其药味的名称和基原并非与2015年版《中国药典》对应,因而药味需要进行详尽的本草考证。古今用药有差异的品种,如甘草、大黄等品种,本草考证只能确定到属,建议按2015年版《中国药典》收入品种入药;对多基原的药味,可通过现代科技手段甄选出当前主流品种用于经典名方制剂开发;随着朝代的变化,古今不同来源的药物,建议以2015年版《中国药典》收入的品种入药,如阿胶、竹叶等。③炮制方法如果原籍或同时代古籍有明确记载的,应以原籍或同时代古籍为主;如果原籍或同时代古籍没有明确记载,建议以2015年版《中国药典》为主,如果2015年版《中国药典》没有,则需要深入研究其具体的炮制方法,并在申报材料中体现选择依据。
2.1.2 处方使用剂量问题
由于经典名方目录中给出的处方剂量仍以两、钱等表述,因而需要将古代度量衡转换为国际单位[14]。目前,古代度量衡转换为国际单位有比较清楚的研究结论[15],使用时争议最大的是《方剂学》中汉方剂量的换算。《方剂学》[16]在古今度量衡对照表中明确东汉的1两等于13.92 g,而涉及到《伤寒论》的具体处方时均选择1两等于3 g进行换算。原因可能是按照度量衡折算的经典名方剂量多高于2015年版《中国药典》规定剂量,在不敢质疑《中国药典》剂量的前提下,并依据明代李时珍“古一两今用一钱”的说法,将经方药量调整为目前剂量。经典名方本源剂量问题实际上不是科学问题,而是思想观念问题。“解放思想,实事求是”在经典名方剂量的选择上依然有现实意义。因此,建议原方剂量确定以原著作者所在年代的度量衡标准为准,用量折算关系可参考《经方本原剂量问题研究》[14]。
经典名方中有部分处方以实物个数比拟药物的质量,如“个”(桃仁、杏仁),“枚”(大枣),“粒”(五味子),“升”(半夏),“寸”(灯心草),“片”(生姜),“一弹大”(竹茹)等均难以明确折算到现代剂量“g”。对于这类剂量的换算可通过参考文献考证,同时批量测定取平均值而得客观数值,如白果(10枚),可分别称取15批以上药材各100枚,算出每批10枚质量后再取平均值。
2.2 处方药味收集和质量评价
根据《申报资料(征求意见稿)》,经典名方申报资料需提供针对不少于3个产地(包含道地药材产地、主产区)的不少于15批次药材的质量进行分析研究,因此,开展此项工作涉及单味药材的收集和药材质量评价两方面工作。
2.2.1 处方药味的收集问题
处方药味收集主要从其代表性和广度性考虑,建议优先在传统道地产区收集,其次是主产区。对于道地产区发生变迁的药材,可结合实际情况做出调整,并附上相应说明性文件。例如黄芪在两千多年的历史发展中存在由西南逐渐往东北变迁的过程。秦汉时期,主要可能使用川黄芪;隋唐时期,认为“蜀汉不复采用之”,自魏晋南北朝开始使用西北产黄芪,且认为陇西、固原、铜川等地所产黄芪质量好;宋代开始出现山西产的绵芪,此后便一直认为山西(特别是山西绵上及其附近县市)所产黄芪质量好;清代又出现了内蒙古产黄芪,民国进一步扩大至东北,当代则认为黄芪以产于山西和内蒙古质量为最佳[17]。另外,有些药材在古代道地产区资源已经枯竭,也应结合现实情况选用新的道地产区。如川牛膝为著名川产道地药材之一,传统道地产区为四川天全,目前主产区变为宝兴、金口河、兴隆、红椿、恩施等地[18]。
为保障药味收集的质量,建议申报企业指派专人负责,收集药材至少15批以上,应注意药材的广泛性,不应仅收道地产区药材;另外,对药材基原、产地批次、采收期、产地加工形式、种养方式、储存养护等信息来源应有准确把握和完善的记录,以防错收错记,增加后期研究工作困难。
2.2.2 处方药味质量评价
处方药材的质量评价研究目的是确定药材的合格性和关键质量属性。对于在2015年版《中国药典》有相应标准的药材,应严格按照其规定,针对所收集药材进行必要的采样检测。以性状检验作为首要检验关卡,借用显微镜等仪器对药材的外表特征进行仔细观察和初步鉴别,然后采用薄层色谱法进行深入鉴别,当确定药材合格后,再进行其他项目的检查,同时对含量进行测定,所有检验操作必须严格按照2015年版《中国药典》的要求实施。对于传统方法无法鉴别或区分的药材基原,建议采用DNA条形码检测,该技术的应用对控制中药材品质起到了决定性作用[19]。对于在现行版《中国药典》中没有相应标准的药材,建议根据药材的质量特点,参考已有的其他药材标准,研究确定药材标准中各检测项目的质量要求,建立或完善药材标准,并作为物质基准的附件进行申报说明。
2.3 饮片炮制和质量评价
2.3.1 饮片炮制
明代陈嘉谟在《本草蒙筌》中记载:“凡药制造,贵在适中,不及则功效难求,太过则气味反失”,简短几句话概括了饮片炮制程度的重要性[20]。中药饮片炮制工艺是否合理、方法是否恰当,会直接影响后期复方制剂的临床疗效。因此,“经典名方物质基准”研究中有必要通过其历史演变考证确定处方所含药味的饮片炮制工艺,若采用的炮制方法与古代医籍记录不一致,还应提供选择依据。饮片炮制工艺包括净制、切制、炒、炙等详细过程及具体的炮制参数。炮制用辅料应有明确的名称、用量以及执行的国家级标准等;若无质量标准的辅料,如麦麸,国家尚未建立其明确的质量标准,则需要研究建立并出具检验报告。炮制方法如果原籍或同时代古籍没有明确记载,建议参考2015年版《中国药典》相应内容进行炮制[21]。例如易黄汤中所用“车前子(酒炒)”为酒制品,而历版《中国药典》和现代文献中给出的车前子多为盐炒品,对酒制工艺记载不多。笔者经过处方考证,发现酒炒法从唐代开始,炒制方法差异不大,多采用黄酒拌匀,用微火炒至略带火色。因此,最后确定车前子(酒炒)参照2015年版《中国药典》(0213炮制通则)项下的酒炙法进行炮制。
《申报资料(征求意见稿)》中对饮片炮制涉及场所没有明确的规定,部分研究者对是在实验室还是在药品生产质量管理规范(GMP)车间炮制存在争议,笔者认为从保障炮制饮片一致性和安全性角度出发,炮制选择在规范的GMP车间进行较好。
2.3.2 饮片质量评价
饮片质量评价包含两方面内容:①饮片质量研究的试验资料及文献资料;②建立饮片标准。《申报资料(征求意见稿)》中指出,由收集药材(15批以上)炮制而得的饮片应“采取措施控制其质量波动”。这句话可理解为3种意思:①通过“控制炮制过程”进行控制“饮片的质量波动”,②通过“筛选药材”控制“饮片的质量波动”,③通过“混批”实现“饮片质量波动控制”。由于原文阐述不清晰和开发者理解不同,研究过程中存在较大的意见分歧。
实际市场上的药材和饮片的质量差异较大,经常出现收集到15批药材虽然符合国家标准,检验合格,但品质差距大,含量测定时其指标成分含量出现离散数据(超过3倍RSD或在均值的70%~130%以外)现象。药材收集时希望具有广泛的代表性,而饮片又要求“控制质量波动”,这二者相互矛盾。控制饮片质量波动的要求在制剂生产时更为合理。
对于《申报资料(征求意见稿)》“7.3饮片标准”提到“饮片标准质控水平较低,应研究完善饮片标准”,笔者认为这可能是对以2015年版《中国药典》为代表的国家标准体系的误解。很多饮片不是质量控制水平低,而是技术难度大。例如淀粉含量较高的一类饮片,如芡实、山药、茯苓、莲子(不含芯)等,难以找到合适的质控成分。国家药典委员会基本上囊括了中药研究水平最高的群体,如果他们都无法提出有效的解决方法,寄希望于经典名方开发来解决这一问题是不现实的,建议有关方面删除相关表述。
2.4 物质基准的制备和质量研究
经典名方物质基准的制备方法以处方考证而得的古籍记载方法为依据,依次明确饮片前处理方法、煎煮用饮片批次、投料规格及每煎饮片量等。需要前处理的饮片一般事先通过研究或参考文献确定其处理方法及工艺参数,如白果、滑石等需粉碎的药味除确定其处理方法外,还需关注粉粹后的粒度等对煎煮的影响。每煎饮片量一般按考证的每日服用量取样,若每日服用量特殊,需要根据实际情况进行增减,并说明原由。
2.4.1 物质基准制备方法确定
经典名方制备方法应该重点关注是否加盖、煎煮次数、煎煮时间、加水量、汤剂体积等对质量具有较大影响的参数。煎煮用具一般认为对质量影响较小,古籍原文一般记载相对比较粗泛,同样是煎药用的陶瓷锅,厚薄程度、大小尺寸等很少记载。古籍对煎煮程度记载也不明确,有的处方仅明确煎煮的加水量,未明确煎几分或者煎至多少等煎煮程度;古代煎药有加盖的也有不加盖;煎煮次数而言,张仲景的方剂煎煮多为一煎,煎煮效率不如现代临床两煎高。以上诸多疑问给基准物质研制带来了很大困扰,不同研究者可能会采用不同来源药材,不同容器、热源或煎煮工艺,必然将导致最后开发的质量不一致。
物质基准的煎煮工艺考察不宜过细,比如煎煮容器的材质(陶瓷、不锈钢、玻璃器皿等),热源的种类(柴火、炭火、煤气等)以及煎煮用水的种类(饮用水、纯净水、井水等)。研究这些问题有吹毛求疵之嫌。实际对物质基准研究而言,没有太大的学术和应用价值。物质基准代表了中医临床用药的一般状态。由于中药饮片性质差异较大,加之中医临床煎煮一直缺乏规范性,因而只需要建立一个稳定的、具有代表性的合理工艺,就能够满足物质基准制备的需求。
针对《申报资料(征求意见稿)》“8.2.2煎煮”中要求提供煎煮容器的厚薄,笔者以为并没有实际意义。当前所使用的容器均为工业制品,同一类型的容器其厚薄基本一致,且厚薄并不会对煎煮过程造成本质影响。过分追求细枝末节,并不利于经典名方开发,建议删除此项内容。研究经典名方应该抓住主要问题、主要矛盾,过于纠结细节并非科学的态度。
煎煮方法、工艺参数在考证古籍记载的基础上,建议参照《医疗机构中药煎药室管理规范》和《中药饮片标准汤剂》[22]有关参数进行细节优化。确定煎煮所用的容器,加热设备及条件;浸泡次数、煎煮次数、加水量、煎煮时间、是否加盖、是否有先煎、后下或包煎等特殊煎煮要求;煎煮过程涉及火力或火候的控制、加热至沸腾的时间需要细化考察;煎煮液得量、相对密度和pH等变化信息;煎煮液过滤的条件(滤材材质、孔径、压力、温度等);浓缩的温度、时间、设备(包括关键工艺参数等),浓缩前后药液(中间体)的体积、相对密度;制成干燥品所用的干燥方法、温度、时间、干燥设备,说明稳定性的干膏粉得量、水分等上下限[23]。此处关于“稳定性”的规定,部分研究者对其考察内涵可能存疑,笔者理解“物质基准”不是药用物质,也不同于对照品,而是一种“方法”和“参照”,建议重点关注存储条件和存储时间的考察,不做加速稳定性和长期稳定性研究。
2.4.2 物质基准质量标准的研究
质量标准研究和制定是经典名方物质基准研制的核心和关键。发布的《申报资料(征求意见稿)》针对其文献和试验研究进行了较为详细的规定。前者主要通过查找文献了解物质基准可能的化学成分及关键质量属性,为试验研究提供基础;后者则涵盖三部分研究内容,即质量相关性研究、分析方法研究、质量分析。
《申报资料(征求意见稿)》对物质基准的研究内容要求非常详尽,对经典名方开发具有推动和指导意义。然而,通过一段时间的实际研究,笔者对其中部分内容存在一定疑议。例如“物质基准分析方法研究”提供的表5检测项目下,将“外源性污染物检查”作为检测项目。物质基准严格意义上并不供药用,不需批量生产,并不做长期保存,涉及外源性污染几率小,要求将其作为指标不具实际意义。另外,物质基准“对应实物的质量分析”中要求提供“同批次饮片制备的多批次对应实物”,如果在工艺研究中进行了工艺稳定性考察,在物质基准研究时提供同批次饮片制备的多次对应实物没有实际意义。
此外,《申报资料(征求意见稿)》指出对于“物质基准”应在系统研究的基础上,建立能较为全面反映对应实物的检测项目,原则上要求含量测定或指纹图谱等项目中体现各药味的信息。笔者经过前期研究发现,建立能较全面反映对应实物的检测项目具有一定难度。建议根据药味的实际情况,选择有针对性的检测方法,达到处方中每一味药都在质量标准中有体现,比如2015年版《中国药典》中无含量测定指标的药味,且在汤剂中找不到合适化学指标的药味,可采用薄层色谱法鉴别项作为定性指标列入物质基准标准,而有含量测定指标,且其指标成分质量分数超过万分之五以上,符合液相色谱法分离要求的,采用含量测定项列入标准。另外,还可采用指纹图谱作为物质基准的定性标准,将定性和定量相结合,形成对应实物的检测项目,达到《申报资料(征求意见稿)》对所有药味的全面质量控制的要求。同时应尽量避免检测重复的质量信息,比如已有定量的指标不需在鉴别项下体现,避免徒增工作量。
2.5 物质基准质量标准的起草和制定
经过前面四阶段的研制,经典名方物质基准的申报材料基本可参照《申报资料(征求意见稿)》整理而得。申报者可参考2015年版《中国药典》收载的中成药质量标准的格式形成经典名方物质基准正文和起草说明,同时邀请中药注册评审方面专家进行申报资料初步评审和给予专业性建议。
物质基准正文需全面反映对应实物的质量信息,包括处方、制法、性状、鉴别、检查、指纹图谱或特征图谱、浸出物、含量测定等。起草说明主要用于简述相关文献资料、研究数据、方法学验证结果等,如各检测项的设立理由、检测项上下限确定依据、未纳入标准的原因等。若对应实物制备中选用药材、饮片不同于2015年版《中国药典》的规定,需进行详细说明,并附有执行标准、检测报告及参考文献。
3 经典名方物质基准研制中关键问题
3.1 经典名方复方制剂开发的可行性
《古代经典名方目录(第一批)》虽然详细列出了100首经典名方的方名、出处、处方、制法及用法、剂型5项内容,但“处方”一项中给出的是古代剂量,并未明确折合后的现代剂量,可能也未考虑处方的成药性。比如四妙勇安汤,含金银花、元参各三两,当归二两,甘草一两,若按明代1两折合37 g换算,处方量较大,出膏率高,难以制成现代制剂。在毒性研究中发现,该处方的灌胃量在未达到规定剂量时就已经出现动物死亡,说明该处方的成药性较差。
由此可见,已发布的100首经典名方未必都能开发成现代复方制剂,有关部门在颁布名单时应充分考虑开发的可行性,以避免申报者盲目开发,浪费有限的科研经费。此外,期望国家后续能尽快出台经典名方相应的现代剂量折算标准,否则将导致未来同一经典名方各企业申报的物质基准剂量完全不同,甚至出现5倍剂量差异,届时将进一步加大药物评审工作的难度,使得“经典名方物质基准”标准难以统一。
3.2 处方药味资源评估实施的难度性
2017年12月26日,原国家食品药品监督管理总局颁布了《中药资源评估技术指导原则》(以下简称《评估原则》),明确中药资源评估是“中药生产企业对未来5年内中药资源的预计消耗量和预计可获得量之间的比较,以及中药产品生产对中药资源可持续利用可能造成的潜在影响进行的科学预估”,并要求新药注册和再注册时开展中药资源评估,目的是促进药品上市许可持有人或生产企业树立起“中药工业生产应先保证中药资源产量和质量”的理念[24]。
经典名方虽然实施的是简化注册政策,但从国家以往发布政策信息上看,其对于处方药味的资源评估仍有明确规定。针对此项规定,有人极力推举,认为中药资源评估对中药产品及企业发展的非常重要,企业应正确认识。也有人强烈质疑,认为资源评估属于公益的、复杂的事情,应该由政府举国家之力来做,而不应企业来承担。以上2种观点都有一定的可取性。因为药材资源不足而导致产品无法生产的情况也许会有,但目前来看肯定是少之又少。开展药材资源评估,不仅是申报者,国家有关部门也应充分评估其复杂性和难度。国家管理部门应充分考虑企业的资源评估能力,考虑企业提交的资源评估结果和数据的可靠性、参照性。建议国家全面公开所掌握的中药材资源信息,企业通过信息共享方式了解所需中药材野生资源分布,栽培中药材分布、产量以及栽培基地等数据和信息,之后再结合企业自身情况形成初步的药材资源评估资料。
资源问题不仅要考虑资源量,更要考虑使用量。目前难以评估经典名方将来的市场份额,即使将来经典名方的市场份额很大,每个企业的市场份额也不一样。对大宗药材而言,经典名方的用量能否引起药材用量的快速提升是存疑的。因此,笔者建议,有关部门可针对使用资源量不足、面临资源问题的品种提供相应名单,涉及这些品种的经典名方需要申报企业提供合理的来源。故而认为中药材资源评估政策应该是一般常规药材可以不评估,濒危的动植物药材需要谨慎对待和评估,鼓励企业使用优质药材为原料。
3.3 药材质量相关性研究中不合理性
《管理规定》明确提出,在复方制剂的研究过程中,申报单位要系统开展药材、饮片、中间体、物质基准所对应实物及制剂的质量研究,综合考虑其相关性,并确定关键质量属性,据此建立相应的质量评价指标和评价方法,确定科学合理的药品标准。
笔者理解关键质量属性,着重点在于评价方法及指标的选择。中药复方制剂的原料是饮片。经典名方制剂属于中药复方制剂的范畴,因而其原料也应该是饮片。要求开展药材的质量研究,实际是要求考察原料使用情况。为了生产优质的产品,需要进行更为全面的考察。但是对于药监部门,其批准的标准是优质标准还是合格标准?该部门有无权限批准优质标准?这些问题都需要讨论。即使要求研究药材的标准是合理的,但是认为中成药生产企业比中药材种植企业更懂种植,其种植的药材质量更高;认为中成药生产企业比药材销售企业更了解药材质量,其购买的药材质量更好;认为中成药生产企业比饮片生产企业更懂炮制,其炮制的饮片质量更高,此逻辑值得商榷。产业链分工不同,要求中成药生产企业进行饮片加工,是从行政命令增加企业负担,与当前国家宏观政策不符。如果监管部门认为当前药材和饮片的质量堪忧,应该针对此问题出台专门的文件。希望通过经典名方复方制剂开发,解决当前药材和饮片的质量问题,可能不具备可行性。因而要求经典名方生产企业必须亲自进行中药材采购、饮片炮制,其合理性、必要性等需要进行深入探讨。
根据前期实际开发经验,针对《申报资料(征求意见稿)》提及的“药材与饮片、中间体、对应实物”的质量相关性、关键质量属性确定等研究,笔者建议分两阶段进行:①“药材-投料饮片”质量研究,按照2015年版《中国药典》的方法检测,分析药材到饮片的质量传递,保障药材和饮片质量合格;②“投料饮片-中间体-物质基准的对应实物”质量研究。按照新研究建立的物质基准质量分析方法进行检测,分析“投料饮片-中间体-物质基准的对应实物”的相关性,确定关键质量属性。两阶段结合可满足当前中药的质量可溯源性要求。
4 结论与展望
经典名方物质基准作为经典名方制剂的质量基准和衡量其质量的标准参照物,在经典名方开发中承担了对照物质的角色,其较对照药材或对照品更接近药味本身,不但体现了所含药味的整体物质基础,也蕴含了制备工艺过程的影响因素。采用物质基准作为标准优化而来的生产工艺,其生产的经典名方制剂最接近于临床实际情况,充分保证了产品内在质量的稳定性,并保障了其临床疗效,同时还可为中药经典名方开发和应用提供数据支撑。
本文在研究经典名方有关政策基础上,结合经典名方实际开发经验,阐述“经典名方物质基准”研制意义、研究策略,提出关键问题,以期为后期经典名方开发和政策制定提供启示和参考。由于笔者水平有限,其中涉及观点未必完全准确,文中未尽之处,恳请同行们批评指正,后期本课题组将针对经典名方研发个案开展更为深入和具体的讨论。
经典名方物质基准研制过程周期长,所涉内容较为复杂,目前仍存在很多关键问题待解决,希望国家能尽快就现代剂量标准、资源评估、质量属性等关键问题出台更具体的、可操作的规范性要求,避免经典名方物质基准申报时出现众说纷纭、难以统一的现象。期待有关经典名方的后续政策早日落地。经典名方开发是一项艰巨的任务,需要政府、科技界、企业共同的努力,愿不久将来经典名方开发焕发出应有的活力。
古代经典名方中药复方制剂简化注册审批管理规定
[EB/OL].http://www.nmpa.gov.cn/WS04/CL2093/228247.html,古代经典名方中药复方制剂及其物质基准申报资料要求(征求意见稿)
[EB/OL].http://www.nmpa.gov.cn/WS04/CL2101/335926.html,古代经典名方目录(第一批)
[EB/OL].http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107.html,
