肝衰竭是临床危急重症,以黄疸、腹水、凝血功能障碍、器官严重衰竭为主要表现,预后极差,病死率高[1]。肝衰竭时炎症反应应答决定着肝组织损伤的严重程度,而抑炎与促炎因子失衡引起“炎症反应失控”,加重了肝损伤。调节性T淋巴细胞(Treg),辅助性T淋巴细胞(Th)17细胞作为辅助性CD4+T淋巴细胞的新亚群,分别以叉头样转录因子3(FoxP3),维甲酸相关核孤儿受体γt(ROR-γt)为特异性转录因子,其与炎症反应调控的关系日益受到重视[2]。相关研究表明,Treg/Th17细胞失衡及其特异性转录因子表达异常与慢性乙型肝炎、慢加急性肝衰竭(ACLF)的免疫学发病机制、患者生存率密切相关。肝衰竭属于中医“黄疸”“急黄”范畴,黄疸常以阴阳为纲,阳黄常用清热利湿法(简称清法),阴黄常用温阳健脾法(简称温法)[3-6]。课题组长期临床实践发现,肝衰竭后期湿、热、瘀、虚,相互交织[7],强调以“温阳健脾”法为代表的温法全程干预,治疗上重视在清热利湿基础上配合温阳健脾(简称清温并用法),并由清法、温法代表方剂茵陈蒿汤和茵陈术附汤化裁形成清温并用法代表方温阳解毒化瘀方。前期研究证明清温并用法对ACLF疗效确切,可降低Treg/Th17相关细胞因子水平,以减轻肠源性内毒素血症(IETM)[8-9]。但是否与调节其转录因子FoxP3,ROR-γt的表达有关,尚不清楚。为明确二者的相关性,实验拟观察清温并用法对ACLF模型大鼠结肠组织FoxP3,ROR-γt表达的影响,探究其减轻肝衰竭IETM的可能机制,为中医药治疗肝衰竭提供一定理论依据。
1 材料
1.1 动物
130只健康SD大鼠,体质量(140±10) g,均为雄性,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2016-0002。实验在湖南中医药大学动物实验中心开展,经湖南中医药大学动物伦理委员会批准,编号HN-LL-2017-016。
1.2 药物
茵陈蒿汤(茵陈30 g,栀子10 g,大黄10 g,甘草片6 g);茵陈术附汤(茵陈30 g,肉桂3 g,附子10 g,干姜5 g,白术15 g,甘草片6 g);温阳解毒化瘀方(茵陈30 g,赤芍60 g,丹参30 g,黑附片10 g,白术30 g,薏苡仁30 g)。中药饮片均由湖南中医药大学第一附属医院中药房提供,药材质量经本单位药学部张志国主任药师鉴定均为正品。
1.3 试剂
牛血清白蛋白,D-氨基半乳糖,脂多糖(Solarbio公司,批号分别为630G056/518H052,210E052,426H032);原位杂交试剂盒(Boster公司,批号MK2402);免疫组化试剂盒(中杉金桥公司,批号PV-9000);弗氏不完全佐剂(Sigma公司,批号1002453350);FoxP3多克隆抗体,ROR-γt多克隆抗体(ABclonal公司,批号分别为A8024,A10240);CD4,白细胞介素(IL)-17A,FoxP3抗体试剂盒(BD公司,批号分别为561005,560486,560045);YBR Green PCR剂盒(KAPA Biosystems公司,批号KM4101);逆转录试剂盒(TAKARA公司,批号639505)。
1.4 仪器
JY92-Ⅱ型超声波细胞粉碎机(宁波新芝公司);FACSCanto Ⅱ型流式细胞仪(美国BD公司);Real-Time System型荧光定量PCR仪(美国Bio-Rid公司);FA型电子天平(上海台之横公司);Centrifuge 5424 R型离心机(德国Eppendorf公司);RM2235型轮转石蜡切片机(德国徕卡公司);SW-CJ-2D型超净工作台(苏州净化设置有限公司);YD-A型生物组织摊片机(上海五相公司);DHP-9052型37 ℃恒温培养箱(上海齐欣公司);PiPet-Lite型微量移液枪(美国Rainin公司);BA410研究型显微镜(中国Motic公司)。
2 方法
2.1 分组及造模
大鼠适应性饲养1周后,按体质量随机分组,正常组10只,剩余120造模。参考文献[10]并加以改进,采用皮下多点注射牛血清白蛋白致敏法,血清白蛋白乳化液0.5 mL/次(其中牛血清白蛋白4 mg),于第1,15,25,35天注射,共4次,建立免疫性肝纤维化大鼠模型。再以尾静脉注射牛血清白蛋白(含量从2 mg/次增加到4 mg/次后维持,每次增加0.5 mg)注射,每周2次,共6周。第6周末,予以D-氨基半乳糖+脂多糖液(含D-氨基半乳糖400 mg·kg-1,脂多糖100 μg·kg-1)腹腔注射急性攻击,最终制备ACLF大鼠模型。大鼠氨基转移酶及胆红素变化符合肝细胞大片坏死时的功能改变,光镜下观察肝脏病理表现为肝硬化再生结节内发生大块或亚大块坏死,纤维间隔保留则表示模型制备成功。模型制备成功81只,按体质量随机分为模型组、清法组、温法组各20只,清温并用法组21只。急性攻击后,各组在1,12,24 h各时间点处死大鼠,采集血液及结肠组织标本。
2.2 给药
清法组予茵陈蒿汤、温法组予茵陈术附汤、清温并用法组予温阳解毒化瘀方灌胃。每剂中药均以传统煎药方法煎煮后浓缩成100 mL,参考文献[11],以大鼠与人的给药剂量系数6.17计算,上述各组分别按生药含量6.68,7.09,19.53 g·kg-1·d-1给药。各组在第6周开始时予相应灌胃处理,持续至急性攻击前,共1周。
2.3 流式细胞仪检测Treg,Th17细胞比例
采集大鼠外周血2 mL于肝素钠真空抗凝管中,加入CD4抗体10 μL,室温避光孵育20 min;400 ×g离心5 min,去上清,清洗;加入IC Fixation buffer 100 μL,混匀,避光孵育40 min,加入Permeabilization buffer 2 000 μL,400 ×g离心5 min,去上清;加IL-17A PE抗体5 μL,混匀,室温避光孵育4 min;加300 μL的PBS,涡旋,避光存放,上机检测。Treg细胞检测方法相同,采用CD4,FoxP3抗体标记。
2.4 实时荧光定量聚合酶链式反应(Real-time PCR)检测结肠组织FoxP3,ROR-γt mRNA的表达
试剂盒提取组织中总RNA,检测RNA的完整性以及RNA的纯度、浓度,放入-80 ℃冰箱备用;经总RNA中DNasel和DNA的消除,反转录合成cDNA,反转录产物于-20 ℃存放备用。将制备好的cDNA进行PCR扩增。反应参数为95 ℃ 3 min,95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s,39个循环;65 ℃ 5 s,95 ℃ 50 s。使用qbase plus分析结果,以2-ΔΔCt表示mRNA相对表达量。PCR引物序列由武汉华联生物技术有限公司设计合成,见表1。
| 引物 | 序列 | 长度/bp |
|---|---|---|
| FoxP3 | 上游5′-TTGTTTGCTGTGCGGAGA-3′ | 118 |
| 下游5′-TGGCATAGGTGAAAGGGG-3′ | ||
| ROR-γt | 上游5′-CAGCAGGACTTTAAGCGCGA-3′ | 116 |
| 下游5′-TCGTGCAGATCACCATTGGC-3′ | ||
| β-actin | 上游5′-CGTTGACATCCGTAAAGAC-3′ | 110 |
| 下游5′-TAGGAGCCAGGGCAGT-3′ |
2.5 原位杂交检测结肠组织FoxP3,ROR-γt mRNA表达
取结肠组织(厚度≤4 mm)固定、脱水、石蜡包埋、切片;然后处理玻片、石蜡切片、脱蜡至水、暴露mRNA核酸片段、固定;进行预杂交、杂交后洗涤;依次滴封闭液、生物素化鼠抗地高辛,SABC,生物素化过氧化物酶后予以DAB显色、梯度乙醇脱水、二甲苯透明、封片、阅片。
2.6 免疫组化检测结肠组织FoxP3,ROR-γt蛋白表达
取结肠组织固后脱蜡、水化组织切片、预处理;滴加一抗(FoxP3,ROR-γt,1∶200),37 ℃孵育1~2 h,滴加二抗,37 ℃孵育30 min,DAB显色、冲洗,复染,脱水,透明,封片。Lecia Applaction Stiue图像系统采集分析。
2.7 统计学方法
采用SPSS 17.0进行统计学分析,计量资料以
3 结果
3.1 清温并用法对大鼠外周血Treg/Th17的影响
与正常组比较,模型组大鼠外周血Treg/Th17在1,12,24 h各时间点均显著降低(P<0.01);与模型组比较,清法组、温法组Treg/Th17在时间点无明显改变,清温并用法组Treg/Th17在各时间点有所增高(P<0.05)。见表2。
| 组别 | 剂量/g·kg-1 | n | Treg/Th17 | ||
|---|---|---|---|---|---|
| 1 h | 12 h | 24 h | |||
| 正常 | - | 10 | 2.43±0.26 | 2.43±0.26 | 2.43±0.26 |
| 模型 | - | 5 | 0.81±0.422) | 0.79±0.422) | 0.75±0.252) |
| 清法 | 6.68 | 6 | 0.76±0.41 | 0.81±0.25 | 0.84±0.43 |
| 温法 | 7.09 | 6 | 0.77±0.42 | 0.77±0.41 | 0.79±0.32 |
| 清温并用法 | 19.53 | 7 | 0.91±0.353) | 0.94±0.363) | 1.02±0.263) |
3.2 清温并用法对大鼠结肠组织FoxP3,ROR-γt mRNA体外扩增的影响
与正常组比较,模型组FoxP3,ROR-γt mRNA表达在1,12,24 h各时间点显著增多(P<0.01);与模型组比较,清法组、温法组、清温并用法各组FoxP3,ROR-γt mRNA在上述时间点都所下降(P<0.05, P<0.01);清温并用法FoxP3,ROR-γt mRNA在上述时间点较清法组、温法组有所降低(P<0.05)。见表3。
| 组别 | 剂量/g·kg-1 | n | FoxP3 | ROR-γt | ||||
|---|---|---|---|---|---|---|---|---|
| 1 h | 12 h | 24 h | 1 h | 12 h | 24 h | |||
| 正常 | - | 10 | 3.28±0.782 | 3.28±0.782 | 3.28±0.782 | 2.69±1.242 | 2.69±1.242 | 2.69±1.242 |
| 模型 | - | 5 | 20.13±2.3922) | 24.94±3.0442) | 30.98±3.3582) | 21.99±1.1622) | 27.13±3.2842) | 32.95±3.5052) |
| 清法 | 6.68 | 6 | 10.97±3.1213) | 15.17±3.423) | 17.07±4.0023) | 14.64±3.023) | 17.55±3.7913) | 22.17±3.7913) |
| 温法 | 7.09 | 6 | 10.41±1.8633) | 14.54±1.863) | 16.43±2.7143) | 13.57±2.8823) | 17.01±3.3513) | 20.37±3.9473) |
| 清温并用法 | 19.53 | 7 | 4.36±1.653,5,7) | 7.50±2.123,5,7) | 9.99±2.024,5,7) | 6.17±1.554,5,7) | 7.98±2.174,5,7) | 9.89±2.894,5,7) |
3.3 清温并用法对大鼠结肠组织FoxP3,ROR-γt mRNA表达的影响
与正常组比较,模型组FoxP3,ROR-γt mRNA表达在1,12,24 h各时间点均显著升高(P<0.01);与模型组比较,清法组、温法组FoxP3,ROR-γt mRNA表达各时间点表达均有降低(P<0.05),其中清温并用法组显著下降(P<0.01)。清温并用法FoxP3,ROR-γt mRNA表达较清法组、温法组有所下降(P<0.05)。见表4,图1,图2。
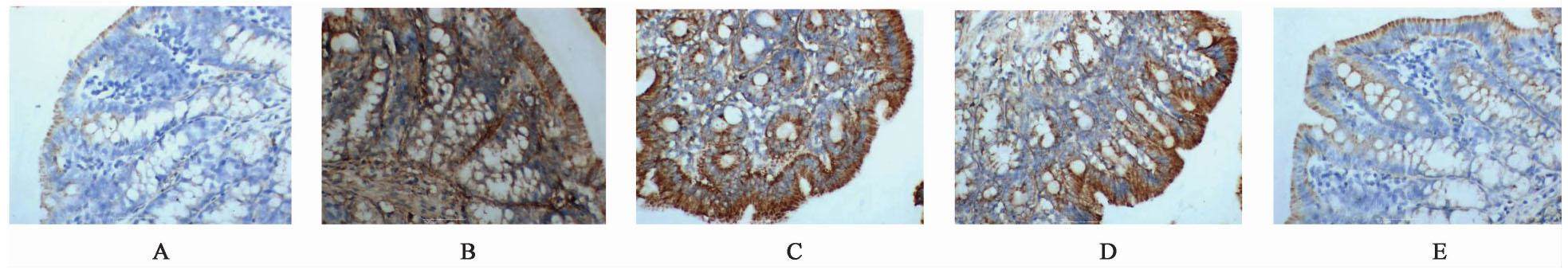

| 组别 | 剂量/g·kg-1 | n | FoxP3 | ROR-γt | ||||
|---|---|---|---|---|---|---|---|---|
| 1 h | 12 h | 24 h | 1 h | 12 h | 24 h | |||
| 正常 | - | 10 | 0.247±0.021 | 0.247±0.021 | 0.247±0.021 | 0.205±0.026 | 0.205±0.026 | 0.205±0.026 |
| 模型 | - | 5 | 0.406±0.042) | 0.573±0.0632) | 0.631±0.0722) | 0.388±0.0372) | 0.588±0.0632) | 0.657±0.0772) |
| 清法 | 6.68 | 6 | 0.350±0.043) | 0.500±0.0593) | 0.560±0.0663) | 0.340±0.0363) | 0.510±0.0593) | 0.571±0.0673) |
| 温法 | 7.09 | 6 | 0.352±0.043) | 0.511±0.0663) | 0.570±0.0623) | 0.342±0.0493) | 0.518±0.0543) | 0.579±0.0653) |
| 清温并用法 | 19.53 | 7 | 0.292±0.044,5,7) | 0.420±0.0494,5,7) | 0.480±0.0574,5,7) | 0.262±0.0454,5,7) | 0.432±0.0464,5,7) | 0.471±0.0514,5,7) |
3.4 清温并用法对大鼠结肠组织FoxP3,ROR-γt蛋白表达的影响
与正常组比较,模型组FoxP3,ROR-γt蛋白表达在1,12,24 h各时间点显著升高(P<0.01);与模型组比较,清法组、温法组FoxP3,ROR-γt蛋白表达有所下降(P<0.05),清温并用法组显著减少(P<0.01);清温并用法FoxP3,ROR-γt蛋白表达低于清法组、温法组(P<0.05)。见表5,图3,图4。
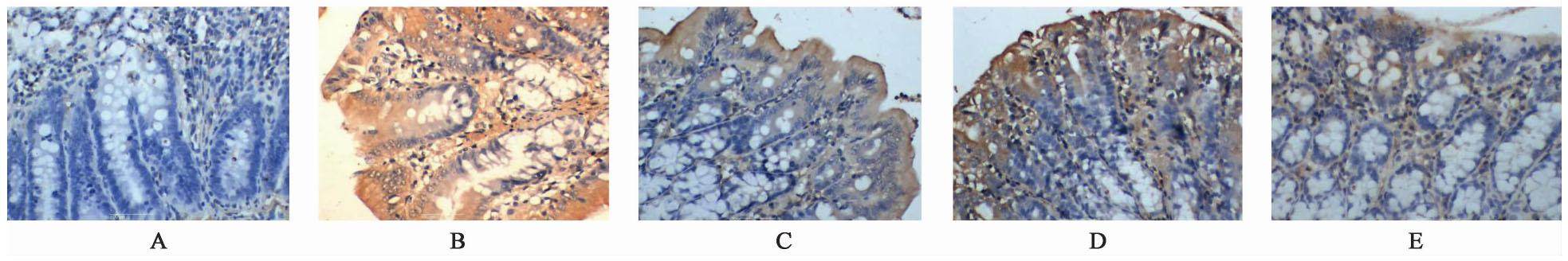
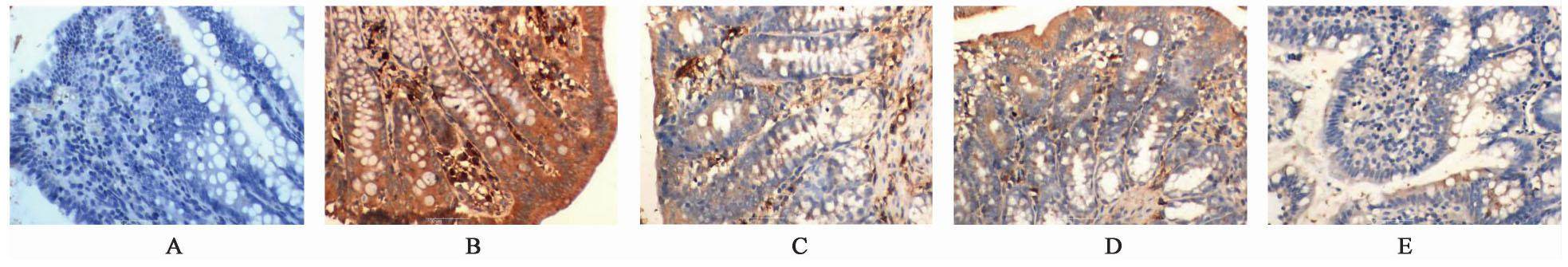
| 组别 | 剂量/g·kg-1 | n | FoxP3 | ROR-γt | ||||
|---|---|---|---|---|---|---|---|---|
| 1 h | 12 h | 24 h | 1 h | 12 h | 24 h | |||
| 正常 | - | 10 | 0.181±0.015 | 0.181±0.015 | 0.181±0.015 | 0.153±0.014 | 0.153±0.014 | 0.153±0.014 |
| 模型 | - | 5 | 0.326±0.0392) | 0.483±0.0492) | 0.546±0.0532) | 0.310±0.0442) | 0.501±0.0502) | 0.580±0.0692) |
| 清法 | 6.68 | 6 | 0.282±0.0293) | 0.411±0.0553) | 0.472±0.0523) | 0.261±0.0303) | 0.448±0.0573) | 0.508±0.0603) |
| 温法 | 7.09 | 6 | 0.284±0.0393) | 0.421±0.0483) | 0.484±0.0683) | 0.260±0.0303) | 0.452±0.0533) | 0.511±0.0683) |
| 清温并用法 | 19.53 | 7 | 0.241±0.0364,5,7) | 0.357±0.0394,5,7) | 0.396±0.0444,5,7) | 0.210±0.0374,5,7) | 0.375±0.0414,5,7) | 0.394±0.0464,5,7) |
4 讨论
肝衰竭时,由于肠道菌群失调、内毒素、炎症介质等损伤肠黏膜屏障,使肠黏膜通透性增高,造成肠道细菌和内毒素无法有效代谢而易位,通过门静脉进入肝脏,形成IETM。在肝衰竭病程进展中,约93.3%~100%的患者会出现IETM[12]。IETM介导的“二次打击”在肝衰竭中后期会引起肝细胞大量坏死,使肝功能严重受损。此外,IETM可成为炎症介质的起源,进而诱发全身炎症反应,进一步加重病情,严重影响肝衰竭的治疗和预后[13]。因此,肝衰竭中后期的治疗重点在于如何有效的防治IETM。
Treg,Th17细胞作为CD4+细胞新亚群,是目前炎症反应调控研究的热点[14]。Treg细胞和Th17细胞源于初始的CD4+T细胞(Th0)在分化与功能上相互拮抗,二者可由特异性转录因子FoxP3,ROR-γt调控分化,分别起着促进炎症和抑制炎症的作用,关系密切,其平衡变化影响着免疫应答及炎症反应的结局。Treg可表达影响转录因子FoxP3,主要通过释放细胞因子IL-10,TGF-β,IL-35等,发挥抑炎作用。Th17可表达影响转录因子ROR-γt,主要分泌IL-17A,IL-17F及低水平的IL-23,TNF-α,IL-6,诱发炎症反应,发挥促炎作用。在正常情况下,机体内Treg和Th17细胞及Treg/Th17是保持平衡的,确保机体的免疫反应处于稳定状态。但肝衰竭时,Treg/Th17细胞比例失衡,Treg细胞数目减少,Th17细胞增多,促炎作用占主导地位。针对HBV-ACLF患者Treg/Th17细胞失衡,早期干预促进平衡恢复,对调控免疫炎症反应,减轻肝损伤,降低肝衰竭病死率具有重要意义。
肝衰竭的中医病机演变规律可归纳为“湿热-热毒致瘀-瘀毒互结”,早期以实证为主,以湿、热、瘀、毒显著,中晚期则虚实夹杂,瘀、毒、虚交织[7,15],治疗以清热利湿,解毒化瘀为主,辅以温阳健脾[16-17]。温阳解毒化瘀方(即清温并用法)由茵陈、白术、黑附片、丹参、赤芍、薏米组成。方中重用赤芍以活血化瘀,配茵陈以利湿退黄,共为君药;丹参功能活血凉血、袪瘀止痛。附片大辛大热,温补脾肾,可防茵陈、赤芍、丹参寒凉太过,共为臣药。再佐以白术、薏米以燥湿健脾益气,防诸药损伤脾胃,诸药合用,共奏热利湿,解毒化瘀,温阳健脾的之功。
本实验通过观察肝衰竭IETM大鼠外周血Treg/Th17及结肠组织FoxP3,ROR-γt表达,造模后,与正常组比较,模型组大鼠Treg/Th17细胞比例失衡,向Th17方向偏移,结肠组织FoxP3,ROR-γt表达增多,FoxP3/ROR-γt mRNA倒置。通过清法、温法、清温并用法干预后,仅清温并用法可有效调节Treg/Th17细胞失衡向Treg方向恢复,使Treg/Th17细胞比值升高。与模型组比较,清法、温法、清温并用法各组ROR-γt,FoxP3表达均下降,其中以清温并用法组降低最明显,且对ROR-γt表达的抑制作用高于FoxP3。
综上所述,肝衰竭Treg/Th17细胞失衡,FoxP3,ROR-γt表达异常,导致炎症反应失控,加重病情。清温并用法可改善肝衰竭IETM,其机制可能与通过调控FoxP3,ROR-γt的表达,促进Treg/Th17细胞失衡向Treg方向恢复有关。本研究阐释了FoxP3,ROR-γt与肝衰竭IETM的相关性,为中医药防治肝衰竭IETM提供新的治疗思路及方法,但是否还存在其他调控通路有待进一步研究。
[编者按]
湖南中医药大学第一附属医院中医肝胆病学科立足传统中医理论基础,通过对老中医临床经验的继承与挖掘,运用现代流行病学调查方法,发现在肝衰竭黄疸症证候分布与演变过程中存在一种以“脾虚”为本,虚实夹杂的特殊证候阶段,提出“阴阳黄证”证候名,并依据清温并用治法制定“温阳解毒化瘀方”,发展与丰富了肝衰竭黄疸症的中医学基础理论与治疗体系。该法经全国多中心临床研究证实能有效降低肝衰竭病死率,并根据肠-肝轴理论,从肠道菌群、肠道屏障功能和T淋巴细胞免疫功能等,揭示炎症反应在肝衰竭发病中的作用机制,及其与中医证候“阳黄-阴阳黄-阴黄”的相关性,发现中医常用治法清热化湿法和温阳健脾法能调节肝衰竭患者肠道菌群,有效保护肠道屏障功能,从而有效改善肠源性内毒素血症。并进一步选择与肝衰竭炎症反应密切相关的T淋巴细胞亚群Treg/Th17细胞为研究切入点,探讨肝衰竭不同分期和不同中医证候的细胞免疫学特征,并通过动物实验和体外细胞培养模拟了人体肝衰竭的进展期和平台期炎症反应状态,研究清法、温法、清温并用法对其Treg/Th17细胞及细胞因子表达的影响,以期从肝衰竭炎症反应的免疫学调控机制,逐步阐明清温并用法抗肝衰竭的作用靶点及可能机制。

