胆南星在我国药用历史悠久,具有清热化痰、息风定惊的功效,胆南星中的胆汁具有清热润燥、止咳平喘、解毒的功效[1-2]。胆南星最早见于宋代《圣济总录》,十余方中记有天南星“牛胆制”。《小儿药证直诀》《太平惠民和剂局方》和《本草纲目》均记载了同一胆南星的制法——牛胆汁制。《普济本事方》首次记载了羊胆制。古法上多用牛胆汁制胆南星,且《修事指南》有“牛胆汁制去燥烈而清润”的记载。历版《中国药典》记载胆南星是由生天南星细粉与牛、羊或猪胆汁经发酵加工而成。本课题组前期对多家企业及市场进行调研后发现,市场上以猪胆汁制备的胆南星为主,其原因多是因为相较于牛胆汁和羊胆汁,猪胆汁获取更加容易、价格相对低廉。但不同胆汁制成的胆南星在品质及药效方面的差异性尚不明确,“牛胆汁制去燥烈而清润”的科学内涵也未得到阐释。因此,本课题组拟对不同胆汁及其制成的胆南星进行对比研究,以期为胆南星的胆汁种类选择和饮片等级评价提供参考。
本课题组前期对比了不同胆汁及其制成的胆南星在清热作用、抗惊厥作用以及胆酸类成分等方面的差异,结果表明不同胆汁制成的胆南星中胆酸类成分差异明显,药效上也存在一定差异[3-5]。从中医学角度来看,急性肺损伤实为“外邪犯肺、肺失宣降、气机逆乱”,从而导致痰、瘀、热毒等病理产物蕴积于肺,进一步影响气机[6-7],且广泛使用清热解毒类方药进行预防治疗,改善肺部气息功能[8]。猪胆汁、牛胆汁、羊胆汁及其制成的胆南星都具有清热、解毒、化痰的功效,很好地体现了“清热化痰”的治疗原则。现代药理研究表明猪胆汁、牛胆汁、羊胆汁及其制成的胆南星具有痰热咳喘、抗炎镇痛、抗菌、抗氧化等药理作用,而急性肺损伤的临床表现也常伴有发热、咳喘、炎症等症状,从药效学角度提示猪胆汁、牛胆汁、羊胆汁及其制成的胆南星可应用于急性肺损伤的临床治疗,但胆南星是否对急性肺损伤(ALI)有治疗作用以及其作用机制尚无相关报道,并且不同胆汁及其制成的胆南星之间是否存在差异也未见报道。因此,本实验拟考察不同胆汁及其制成的胆南星对脂多糖引起的ALI大鼠保护作用的差异,为胆南星饮片的分级及胆南星中胆汁的选择提供实验依据。
1 材料
HZ-A6002型电子天平(瑞安市金讯贸易有限公司),FA1004B型电子天平(上海精密科学仪器有限公司),Milli-Q Integral型纯水仪(大连烽木源科技有限公司),FSH-2型可调高速电动匀浆器(江苏金坛市佳美仪器有限公司),H1650-W型离心机(湖南湘仪试验仪器开发有限公司),LC-E109S型电磁炉(广东顺德忠臣电器有限公司),HWS-080型恒温恒湿培养箱(上海精宏实验设备有限公司),Multiskan MK3型酶标仪(美国赛默飞世尔科技有限公司),BX51型显微镜(日本Olympus公司)。
虎掌南星购自山东省菏泽市,经辽宁中医药大学尹海波教授鉴定为天南星科植物掌叶半夏Pinellia pedatisecta的干燥块茎;猪、牛、羊新鲜胆汁均购自大连开发区农贸市场;脂多糖(LPS,美国Sigma-Aldrich公司,批号Lot#057M4013V),0.9%生理盐水注射液(辰欣药业股份有限公司,批号1811122823),乌拉坦(北京Solarbio公司,批号Lot.No.330H031);超氧化物歧化酶(SOD),丙二醛(MDA),谷胱甘肽过氧化物酶(GSH-Px),肿瘤坏死因子-α(TNF-α),白细胞介素-6(IL-6),血栓素B2(TXB2),基质金属蛋白酶-9(MMP-9)酶联免疫吸附法(ELISA)试剂盒均购自上海朗顿生物技术有限公司,批号分别为BPE30267,BPE30266,BPE30800,BPE30635,BPE30646,BPE30421,BPE30434。
清洁级健康雄性Wistar大鼠96只,体质量(200±20) g,购自辽宁长生生物科技有限公司,合格证号SCXK(辽)2017-0001,实验动物饲养于辽宁中医药大学SPF级动物房。本实验涉及的动物实验均在辽宁中医药大学动物伦理委员会的批准下进行,批准号2018YS(DW)-043-01。
2 方法
2.1 样品的制备
2.1.1 胆南星[2]
取虎掌南星细粉过五号筛,加入净胆汁(经绢布滤过),约1∶1比例混合,置温度32 ℃,相对湿度80%的恒温恒湿培养箱中发酵15 d取出,至蒸制容器中蒸1 h至透,趁热切成1.5~2 cm的小块,晒至黑褐色,即得。
2.1.2 不同胆汁及其制成的胆南星水提物
分别取一定量的胆南星样品,加10倍量水回流提取3次,每次1 h,4层纱布过滤,合并滤液,即得生药质量浓度均为0.252 g·mL-1的水提物。分别取一定量胆汁样品,加水配成0.252 g·mL-1胆汁药液。
2.1.3 LPS溶液
无菌条件下,取一定量的LPS溶于0.9%氯化钠注射液中,配成2.5 g·L-1 LPS溶液,备用。
2.2 大鼠的分组与给药
Wistar大鼠适应性饲养1周,自由饮食和饮水,按随机数字表法随机分为8组,包括空白组,模型组,猪胆汁组,牛胆汁组,羊胆汁组,胆南星(猪胆汁制)组(简称猪胆南星组),胆南星(牛胆汁制)组(简称牛胆南星组),胆南星(羊胆汁制)组(简称羊胆南星组),每组12只,各组大鼠间体质量经方差分析无显著差异。各给药组给药剂量均为2.52 g·kg-1,灌胃体积均为10 mL·kg-1,空白组和模型组每天灌胃同体积的生理盐水,共8 d。第8天各给药组灌胃给予相应药液1 h后,除空白组外,其余各组大鼠均腹腔注射2.5 g·L-1 LPS(2 mg·kg-1)开始造模[9-12]。8组造模后3,6,24 h[10]各取4只大鼠按剂量40 mg·kg-1腹腔注射2.5%乌拉坦麻醉,仰卧位固定于手术台,腹主动脉取血和摘取肺组织。
2.3 评价指标的检测
2.3.1 肺系数、肺含水量以及肺组织湿重/干重比值
大鼠处死后打开胸腔,暴露肺组织,取右肺下叶,称取湿重(W),再置于80 ℃烘箱中烘24 h,称取干重(D),计算肺组织湿重/干重比值(W/D),肺系数(肺系数=W/体质量×100%)和肺含水量[肺含水量=(W-D)/W×100%]。
2.3.2 血清指标
所有动物处置前,腹主动脉取血5 mL,置于试管中,不抗凝,室温下静置1 h,8 000 r·min-1离心10 min,分离血清,测定血清中TNF-α,IL-6和TXB2的含量,具体操作按照试剂盒内说明进行。
2.3.3 肺组织SOD,GSH-Px活性及MDA,MMP-9的含量
取各组大鼠剩余右肺组织0.1 g放入10 mL的离心管中,用移液枪吸取肺组织质量9倍量的磷酸盐缓冲液(PBS,pH 7.2~7.4)制成10%组织匀浆,加入离心管中并用高速匀浆机匀浆。再将匀浆液放入离心机中,于4 ℃,3 000 r·min-1离心20 min,取上清液测定肺组织SOD,GSH-Px的活性及MDA,MMP-9的含量,具体操作按照试剂盒内说明进行。
2.3.4 大鼠肺组织的分离与标本的制备
将固定于解剖台的大鼠保留自主呼吸,暴露胸腔取出肺组织,用生理盐水冲洗干净,分离全肺和心脏,取左肺中叶约1 cm×1 cm×1 cm大小组织块,用10%甲醛固定,予以常规石蜡包埋、切片、苏木素-伊红(HE)染色,光镜下观察肺组织病理学变化。
2.3.5 大鼠肺组织标本病理评分[13]
综合4项指标(①肺泡充血;②出血;③间隙或血管壁中性粒细胞浸润或聚集;④肺泡间隔增厚或透明膜形成)进行肺损伤评分。根据每项指标病变轻重进行0~4分半定量分析,0分表示极轻微病变;1分表示轻度病变;2分表示中度病变;3分表示重度病变;4分表示极重度病变,累加各项评分的总分作为ALI的病理评分。每张病理切片各取8个高倍视野(×400)评分,取8次评分均值作为该张切片的病理评分,分值越高表示炎症病变程度越严重。
2.4 统计学分析
实验结果以
3 结果
3.1 一般体征观察
LPS造模后,模型组大鼠均出现了不同程度的变化,自主活动明显减少、聚堆、精神萎靡、呼吸频率加快,个别大鼠出现严重腹泻现象。经给药组治疗后均能够减轻上述症状,空白组则均未出现上述症状。
3.2 对ALI大鼠肺系数,W/D及肺含水量的影响
与同时间点空白组比较,各个时间点模型组大鼠肺系数、肺含水量及W/D均明显升高(P<0.01);与同时间点模型组比较,猪胆汁、牛胆汁、羊胆汁及其制成的胆南星给药组大鼠肺系数、肺含水量及W/D均降低,且大部分具有显著性差异(P<0.05,P<0.01)。牛胆汁组和羊胆汁组对肺组织的改善效果均比猪胆汁组好,牛胆南星组和羊胆南星组对肺组织的改善效果均比猪胆南星组好。见表1。
| t/h | 组别 | 剂量/g·kg-1·d-1 | W/D | 肺系数/% | 肺含水量/% |
|---|---|---|---|---|---|
| 3 | 空白 | - | 1.672±0.1182) | 0.065±0.0042) | 39.975±4.1242) |
| 模型 | - | 2.341±0.111 | 0.110±0.009 | 57.218±1.931 | |
| 猪胆汁 | 2.52 | 2.199±0.175 | 0.088±0.0072) | 54.305±3.720 | |
| 牛胆汁 | 2.52 | 2.055±0.1132) | 0.087±0.0062) | 51.232±2.6891) | |
| 羊胆汁 | 2.52 | 2.108±0.0652) | 0.089±0.0022) | 52.539±1.471 | |
| 猪胆南星 | 2.52 | 2.057±0.1172) | 0.091±0.0052) | 51.274±2.7751) | |
| 牛胆南星 | 2.52 | 2.020±0.0602) | 0.094±0.0052) | 50.458±1.4772) | |
| 羊胆南星 | 2.52 | 2.069±0.1202) | 0.088±0.0062) | 51.556±2.8021) | |
| 6 | 空白 | - | 1.699±0.0962) | 0.066±0.0032) | 41.014±3.3272) |
| 模型 | - | 2.801±0.100 | 0.113±0.002 | 64.268±1.232 | |
| 猪胆汁 | 2.52 | 1.885±0.0992) | 0.084±0.0112) | 46.845±2.7842) | |
| 牛胆汁 | 2.52 | 1.739±0.1962) | 0.081±0.0032) | 41.967±6.4562,3) | |
| 羊胆汁 | 2.52 | 1.803±0.1032) | 0.080±0.0052) | 44.416±3.0762) | |
| 猪胆南星 | 2.52 | 2.076±0.1112) | 0.086±0.0102) | 51.732±2.7092) | |
| 牛胆南星 | 2.52 | 1.835±0.1322,6) | 0.085±0.0092) | 45.297±3.8962,6) | |
| 羊胆南星 | 2.52 | 1.893±0.0712,5) | 0.077±0.0102,5) | 47.114±1.9392) | |
| 24 | 空白 | - | 1.689±0.0302) | 0.066±0.0012) | 40.765±1.0432) |
| 模型 | - | 2.234±0.152 | 0.094±0.007 | 55.080±3.038 | |
| 猪胆汁 | 2.52 | 1.758±0.1342) | 0.077±0.0102) | 42.887±4.1812) | |
| 牛胆汁 | 2.52 | 1.651±0.1332) | 0.073±0.0062) | 39.114±5.3122) | |
| 羊胆汁 | 2.52 | 1.572±0.1152,3) | 0.075±0.0092) | 36.156±4.5192,4) | |
| 猪胆南星 | 2.52 | 1.982±0.1412) | 0.083±0.0051) | 49.362±3.5751) | |
| 牛胆南星 | 2.52 | 1.648±0.0382,6) | 0.067±0.0032,6) | 39.296±1.4092,6) | |
| 羊胆南星 | 2.52 | 1.716±0.1702,6) | 0.081±0.0082) | 41.293±5.7532,6) |
3.3 对ALI大鼠血清TNF-α,IL-6及TXB2水平的影响
与同时间点空白组比较,模型组大鼠血清TNF-α,IL-6和TXB2含量均明显增加(P<0.05,P<0.01);与同时间点模型组比较,猪胆汁、牛胆汁、羊胆汁及其制成的胆南星给药组大鼠血清TNF-α,IL-6和TXB2含量降低,且大部分差异具有统计学意义(P<0.05,P<0.01)。牛胆汁组和羊胆汁组治疗效果明显优于猪胆汁组,牛胆南星组和羊胆南星组治疗效果明显优于猪胆南星组。见表2。
| t/h | 组别 | 剂量/g·kg-1·d-1 | TNF-α | IL-6 | TXB2 |
|---|---|---|---|---|---|
| 3 | 空白 | - | 156.679±3.3182) | 6.274±0.3152) | 112.773±2.0162) |
| 模型 | - | 229.893±26.032 | 17.233±2.554 | 238.909±31.896 | |
| 猪胆汁 | 2.52 | 211.143±28.859 | 19.620±4.072 | 165.500±43.3542) | |
| 牛胆汁 | 2.52 | 167.929±26.8211) | 15.654±12.376 | 143.455±37.7792) | |
| 羊胆汁 | 2.52 | 197.571±24.338 | 13.023±7.133 | 121.409±22.5072) | |
| 猪胆南星 | 2.52 | 219.179±23.743 | 15.015±5.188 | 151.409±44.8282) | |
| 牛胆南星 | 2.52 | 177.929±33.1711) | 13.229±3.444 | 144.818±67.6162) | |
| 羊胆南星 | 2.52 | 169.893±30.6191) | 6.519±2.4471,5) | 141.636±69.2202) | |
| 6 | 空白 | - | 157.750±1.3522) | 6.350±0.1672) | 114.136±3.9542) |
| 模型 | - | 335.429±37.821 | 26.180±2.915 | 281.636±36.654 | |
| 猪胆汁 | 2.52 | 172.393±2.8792) | 15.259±7.7702) | 156.182±41.0372) | |
| 牛胆汁 | 2.52 | 168.107±10.6172) | 15.203±3.3902) | 144.818±32.5162) | |
| 羊胆汁 | 2.52 | 163.643±39.5172) | 8.756±4.7202) | 128.227±10.0242) | |
| 猪胆南星 | 2.52 | 257.929±54.5582) | 14.207±6.5942) | 102.091±40.0692) | |
| 牛胆南星 | 2.52 | 199.893±31.7752,5) | 11.914±3.6402) | 97.318±19.5742) | |
| 羊胆南星 | 2.52 | 117.571±36.7492,6) | 9.188±5.0592) | 88.682±48.8232) | |
| 24 | 空白 | - | 156.857±3.5232) | 6.180±0.2381) | 111.182±3.8571) |
| 模型 | - | 264.179±59.771 | 14.658±4.565 | 166.636±32.448 | |
| 猪胆汁 | 2.52 | 149.893±30.4082) | 8.455±10.422 | 46.636±21.1182) | |
| 牛胆汁 | 2.52 | 125.250±66.5712) | 5.842±1.8311) | 56.636±39.6542) | |
| 羊胆汁 | 2.52 | 92.393±52.3962,3) | 4.677±2.7311) | 78.000±21.5712) | |
| 猪胆南星 | 2.52 | 129.893±77.7782) | 12.778±14.493 | 102.545±64.6091) | |
| 牛胆南星 | 2.52 | 52.214±21.0932,6) | 3.793±7.3162,5) | 68.227±25.7172) | |
| 羊胆南星 | 2.52 | 115.608±25.5562) | 4.940±4.3311) | 70.273±23.2492) |
3.4 对ALI大鼠肺组织匀浆GSH-Px和SOD活力的影响
与同时间点空白组比较,模型组大鼠肺组织匀浆GSH-Px和SOD的活力均明显降低(P<0.05,P<0.01)。与同时间点模型组比较,猪胆汁、牛胆汁、羊胆汁及其制成的胆南星给药组大鼠肺组织匀浆GSH-Px和SOD活力升高,且大部分差异具有统计学意义(P<0.05,P<0.01)。牛胆汁组和羊胆汁组肺组织匀浆GSH-Px和SOD活力明显优于猪胆汁组,牛胆南星组和羊胆南星组肺组织匀浆GSH-Px活力优于猪胆南星组。见表3。
| t/h | 组别 | 剂量/g·kg-1·d-1 | GSH-Px/U·mL-1 | SOD/μg·L-1 |
|---|---|---|---|---|
| 3 | 空白 | - | 178.864±10.6032) | 48.580±0.5372) |
| 模型 | - | 117.727±10.674 | 25.247±3.802 | |
| 猪胆汁 | 2.52 | 121.515±10.458 | 41.313±5.1482) | |
| 牛胆汁 | 2.52 | 154.924±25.9302,4) | 44.247±6.2232) | |
| 羊胆汁 | 2.52 | 147.954±33.8101,3) | 41.847±7.7892) | |
| 猪胆南星 | 2.52 | 143.712±12.0511) | 41.147±1.1132) | |
| 牛胆南星 | 2.52 | 150.090±8.8332) | 46.847±5.4112) | |
| 羊胆南星 | 2.52 | 144.318±20.9881) | 29.702±0.734 | |
| 6 | 空白 | - | 179.773±6.2172) | 49.747±0.5552) |
| 模型 | - | 114.848±12.820 | 23.113±2.151 | |
| 猪胆汁 | 2.52 | 132.576±16.577 | 40.481±1.9912) | |
| 牛胆汁 | 2.52 | 176.818±11.8402,4) | 45.180±4.8642) | |
| 羊胆汁 | 2.52 | 151.061±22.4962) | 42.213±13.0172) | |
| 猪胆南星 | 2.52 | 156.493±15.5632) | 39.947±3.2192) | |
| 牛胆南星 | 2.52 | 176.288±12.3052) | 41.813±3.2712) | |
| 羊胆南星 | 2.52 | 166.894±9.9352) | 27.924±1.689 | |
| 24 | 空白 | - | 178.561±8.4102) | 48.347±0.5601) |
| 模型 | - | 116.742±43.144 | 24.680±3.142 | |
| 猪胆汁 | 2.52 | 123.030±7.233 | 33.413±12.9211) | |
| 牛胆汁 | 2.52 | 156.515±3.8892,4) | 37.680±3.6312) | |
| 羊胆汁 | 2.52 | 170.152±9.0332,4) | 44.180±7.6772,4) | |
| 猪胆南星 | 2.52 | 157.652±33.0902) | 40.980±5.3302) | |
| 牛胆南星 | 2.52 | 161.894±21.8302) | 41.380±5.1982) | |
| 羊胆南星 | 2.52 | 160.530±7.5912) | 33.258±4.4711) |
3.5 对ALI大鼠肺组织匀浆MMP-9和MDA含量的影响
与同时间点空白组比较,模型组大鼠肺组织匀浆MMP-9和MDA含量明显增加(P<0.05,P<0.01);与同时间点模型组比较,猪胆汁、牛胆汁、羊胆汁及其制成的胆南星给药组大鼠肺组织匀浆MMP-9和MDA含量降低,且大部分差异具有统计学意义(P<0.05,P<0.01)。牛胆汁组和羊胆汁组均比猪胆汁组改善效果好,牛胆南星组和羊胆南星组均比猪胆南星组改善效果好。见表4。
| t/h | 组别 | 剂量/g·kg-1·d-1 | MMP-9/μg·L-1 | MDA/μmol·L-1 |
|---|---|---|---|---|
| 3 | 空白 | - | 20.147±2.4202) | 1.991±0.2872) |
| 模型 | - | 45.531±5.214 | 4.621±0.794 | |
| 猪胆汁 | 2.52 | 33.513±3.3811) | 2.975±0.3502) | |
| 牛胆汁 | 2.52 | 28.481±9.0172) | 2.625±0.8012) | |
| 羊胆汁 | 2.52 | 29.731±3.8422) | 2.849±0.4322) | |
| 猪胆南星 | 2.52 | 41.077±3.123 | 3.032±0.4612) | |
| 牛胆南星 | 2.52 | 22.551±18.1012,6) | 2.121±1.1202) | |
| 羊胆南星 | 2.52 | 17.359±4.8042,6) | 1.659±0.5172,6) | |
| 6 | 空白 | - | 22.583±1.4102) | 2.080±0.1412) |
| 模型 | - | 55.115±3.463 | 6.361±0.379 | |
| 猪胆汁 | 2.52 | 42.455±4.6761) | 3.983±1.3261) | |
| 牛胆汁 | 2.52 | 34.859±6.3312) | 3.910±1.3192) | |
| 羊胆汁 | 2.52 | 35.212±0.4842) | 1.971±1.0842,4) | |
| 猪胆南星 | 2.52 | 41.910±10.6491) | 1.853±0.5312) | |
| 牛胆南星 | 2.52 | 28.545±6.9312,5) | 1.076±0.4392) | |
| 羊胆南星 | 2.52 | 14.709±6.4692,6) | 1.404±0.1312) | |
| 24 | 空白 | - | 20.628±1.7442) | 2.060±0.2691) |
| 模型 | - | 35.372±1.734 | 4.133±1.101 | |
| 猪胆汁 | 2.52 | 32.423±6.721 | 3.702±0.829 | |
| 牛胆汁 | 2.52 | 25.019±0.436 | 3.658±0.698 | |
| 羊胆汁 | 2.52 | 28.513±1.556 | 1.727±0.2102,4) | |
| 猪胆南星 | 2.52 | 25.756±23.690 | 2.816±0.3602) | |
| 牛胆南星 | 2.52 | 16.526±3.3372) | 2.678±0.2272) | |
| 羊胆南星 | 2.52 | 15.222±1.2842) | 2.526±0.0622) |
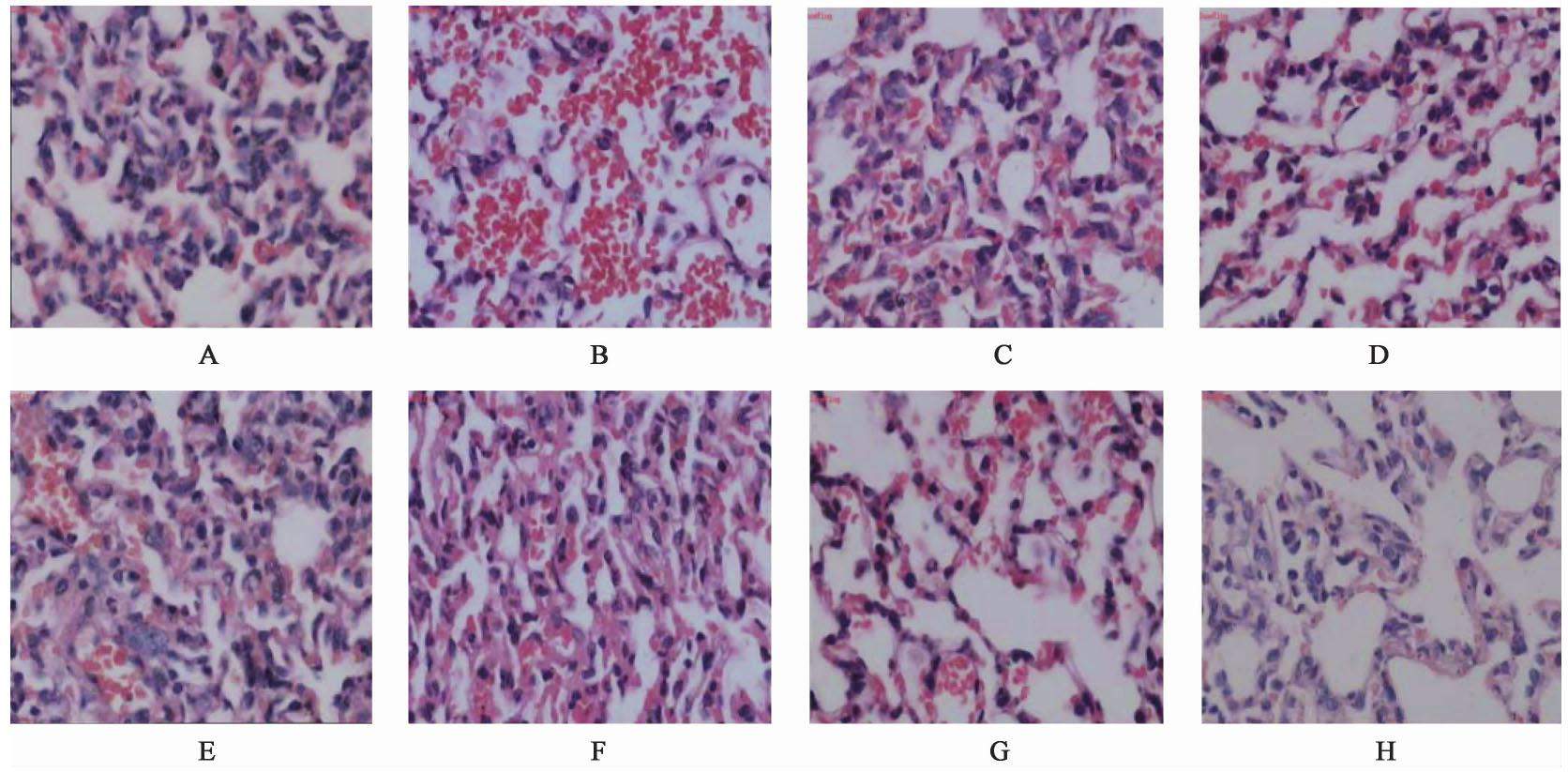
3.6 对ALI大鼠肺组织的病理评分及病理形态观察
光镜下观察显示,空白组大鼠肺组织由肺泡、肺内支气管分支及间质组成,其形态基本正常,肺泡组织呈粉红色,结构完整,表面光滑,未见明显病变。模型组大鼠肺泡组织间隔增宽,肺泡腔内有大量红细胞渗出,肺间质血管扩张、充血,部分肺泡因受损而变小。与模型组比较,猪胆汁组大鼠肺泡组织间隔增宽,肺间质轻度充血水肿,部分肺泡变小;牛胆汁组大鼠变化明显减轻,肺间质出现轻度充血水肿,少量炎症细胞浸润和肺泡组织间隔轻度增宽;羊胆汁组大鼠肺泡间隔增宽,肺间质血管扩张充血,局部肺泡闭合消失出现小灶肺实变,外围肺泡融合。与模型组比较,猪胆南星组大鼠肺泡组织间隔增宽,肺间质充血水肿,有大面积肺泡塌陷,甚至闭合;牛胆南星组和羊胆南星组大鼠均出现肺泡间隔轻度增宽,肺间质轻度充血、水肿,肺泡腔内可见少量红细胞渗出及肺泡上皮脱落。见图1和表5。
| 组别 | 剂量/g·kg-1·d-1 | 病理评分/分 | ||
|---|---|---|---|---|
| 3 h | 6 h | 24 h | ||
| 空白 | - | 0.625±0.1262) | 0.700±0.1412) | 0.650±0.1292) |
| 模型 | - | 3.000±0.408 | 3.875±0.250 | 3.250±0.957 |
| 猪胆汁 | 2.52 | 2.000±0.816 | 2.750±1.2581) | 2.250±1.258 |
| 牛胆汁 | 2.52 | 1.875±1.1811) | 1.500±1.0002,3) | 2.000±0.8161) |
| 羊胆汁 | 2.52 | 1.750±0.9571) | 1.125±0.2502,4) | 2.250±0.5001) |
| 猪胆南星 | 2.52 | 3.000±0.816 | 2.250±0.9572) | 2.500±1.000 |
| 牛胆南星 | 2.52 | 1.250±0.5002,6) | 1.750±0.5002) | 1.500±0.5772) |
| 羊胆南星 | 2.52 | 1.500±1.0002,6) | 2.125±0.2502) | 1.875±0.2502) |
4 讨论
胆汁一般被认为是制备胆南星的辅料,但从胆汁的用量、最终去向,以及对药性的影响来看,笔者认为,胆南星中的胆汁应是制备原料之一,而非仅作为辅料。且《药品化义》中亦有记载:“胆星,意不重南星而重胆汁,借星以收取汁用,非如他药监制也……”。说明胆汁的种类和用量对胆南星的功效有很大影响,对不同胆汁及其制成的胆南星进行对比研究,有助于揭示胆南星的炮制原理,以确保胆南星的品质和疗效。
TNF-α在ALI发展过程极为重要,其可以激活中性粒细胞,释放氧自由基,导致肺组织损伤。LPS可促进多种炎症性因子的合成和释放,如TNF-α,IL-6等[14-16]。研究报道,SOD和GSH-Px是生物体内重要的抗氧化酶,MDA的测定常常与SOD的测定相互配合[17]。因此,本实验将TNF-α,IL-6,TXB2,SOD,MDA,GSH-Px作为观察指标。本研究的ELISA检测结果显示,LPS可诱导肺组织中SOD活性和GSH-Px含量减低,MDA含量升高;而给予猪胆汁、牛胆汁、羊胆汁及其制成的胆南星后,SOD活性和GSH-Px含量升高,MDA含量降低。猪胆汁、牛胆汁、羊胆汁及其制成的胆南星可降低促炎症因子TNF-α,IL-6,TXB2的含量,减轻LPS诱导的ALI的炎症反应,说明给药后能有效减轻LPS诱导的ALI的氧化应激损伤。
研究表明,猪胆汁、牛胆汁、羊胆汁及其制成的胆南星均对LPS诱导的ALI大鼠具有保护作用,能够改善肺组织的病理形态和氧化应激造成的损伤,其可能是通过抑制炎症因子的释放从而对ALI大鼠起到保护作用,具体抗炎、抗氧化机制还需要进一步探究。猪胆汁、牛胆汁、羊胆汁及其制成的胆南星对LPS诱导的ALI大鼠均有明显的治疗作用,提示这3种胆汁均可用于制备胆南星。其中牛胆汁和羊胆汁以及二者制成的胆南星在治疗ALI方面较猪胆汁及猪胆南星表现出了一定优势,建议在胆南星饮片商品分级中可作为优质产品使用。
本实验所用胆南星是参照当前市场上主流产品的生产工艺,按天南星质量与胆汁体积约1∶1的比例单次发酵制成,实验中各胆汁组的给药剂量与制备胆南星时所用胆汁量相当,研究结果表明等量胆汁经与天南星发酵制成胆南星后,作用得到保留或有所增强,由此推测古法多次添加胆汁、多次发酵的“九转南星”能够“借星以收取汁用”,增强疗效。基于此,本课题组后续将对按古法所制胆南星的药效学进行评价。

