随着核技术在各领域的应用与日俱增,人们与电离辐射接触的机会日益增多,长时间接触辐射会产生累积损伤,可能会导致机体系统功能发生紊乱,甚至是不可逆损伤[1]。辐射损伤的自然修复过程十分漫长,因此,研究低毒、安全、有效的辐射防护药物显得极其重要。
灵芝为真菌赤芝Ganoderma lucidum或紫芝G. sinense的干燥子实体,归心、肝、肺、肾经,具有补气安神、止咳平喘的功效[2]。现代化学研究证明,灵芝含有多种生物活性成分,如多糖类、三萜类、甾醇类、核苷类、生物碱类等[3]。灵芝多糖是灵芝中一类主要的功效成分,与灵芝的多种药理活性有关,具有提高机体免疫能力、抗肿瘤、抗癌症、抗衰老、调节血脂、抗辐射、提高机体耐缺氧能力等作用[4]。近年来,关于灵芝多糖功效和机制的分析已成为国内外研究热点。
代谢组学技术通过分析体液和组织中内源性代谢物的变化,研究正常条件下以及疾病和药物影响下机体代谢网络的变化[5-7]。代谢组学技术应用于电离辐射损伤研究,对于寻找敏感的诊断指标以及损伤机制研究具有潜在的应用前景[8]。辐射损伤是机体受到电离辐射后引起的一种病理状态,基于辐射损伤会导致一系列代谢产物变化。代谢组学研究部分证实了辐射损伤的经典途径,包括氧化应激和随后的DNA分解[9]。其中很多研究内容基于寻找代谢产物中与辐射剂量相关的生物标志物,以用于辐射损伤早期诊断和预警。
目前研究表明灵芝多糖具有抗辐射损伤的生理作用,但相关机制研究较少[10-13]。本实验拟建立X射线辐射损伤小鼠模型,应用基于UPLC-Q-TOF-MS的代谢组学方法,测定和分析辐射敏感免疫器官胸腺辐照前后其组织代谢物的变化,发现和确定与辐射作用相关的代谢标志物,根据检测获得的数据分析和探究灵芝多糖发挥辐射防护作用的可能分子机制。
1 材料
ACQUITY™型超高液相色谱仪和LCT Premier XE型Q-TOF质谱仪(美国Waters公司),KDC-160HR型台式高速冷冻离心机(科大创新股份有限公司中佳分公司),CLINAC21EX型医用电子直线加速器(美国Varian公司),AG135型电子天平[梅特勒-托利多仪器(上海)有限公司]。
灵芝多糖[陕西慈缘生物技术有限公司,批号20170809,是真菌赤芝的干燥子实体经提取、纯化干燥、粉粹制得。按2015年版《中国药典》(一部)灵芝项下灵芝多糖含量测定方法检测,灵芝多糖质量分数70.89%],亮氨酸-脑啡肽(美国Sigma-Aldrich公司,批号L9133),水为屈臣氏蒸馏水,乙腈、甲酸、甲醇为色谱级,其他试剂均为分析纯。
清洁级Balb/C小鼠,体质量(20.0±2.0) g,雌雄各半,由黑龙江中医药大学药物安全性评价中心提供,许可证号SCXK(黑)2018-003。小鼠于屏障环境动物室内标准条件下饲养,小鼠适应环境1周后开始试验。本文涉及的动物实验经黑龙江中医药大学实验动物使用与管理委员会批准,批准号2018052325。
2 方法与结果
2.1 动物分组及灌胃剂量
30只小鼠随机分为3组(每组10只),即正常组,模型组和灵芝多糖组(剂量96 mg·kg-1,经折算相当于2015年版《中国药典》中记载的人体临床生药有效量10 g)。灵芝多糖组小鼠灌胃给予灵芝多糖,正常组和模型组给予生理盐水,每天1次,给药体积均为0.02 mL·g-1,连续14 d。给药7 d后2 h,除正常组外,模型组和灵芝多糖组均以X射线进行全身一次性照射(电子直线加速器对小鼠进行1次X射线全身照射,源皮距100 cm,剂量率2.0 J·kg-1·min-1,辐照剂量5.0 J·kg-1),照射后灵芝多糖组小鼠继续灌胃给予灵芝多糖,正常组和模型组继续给予生理盐水。
2.2 胸腺的采集与制备
于末次给药24 h后,取出的新鲜胸腺组织于4 ℃生理盐水中洗去浮血,滤纸吸干水分,剪取胸腺组织,在1 mL冰冷的甲醇-生理盐水(1∶9)混合液中低温匀浆,于4 ℃,4 000 r·min-1离心15 min,取上清液100 μL,加入预冷至4 ℃的甲醇400 μL,旋涡混匀30 s,室温静置10 min,于4 ℃,13 000 r·min-1离心15 min,取上清液并转移到微量进样管中,4 ℃冰箱放置待测。
2.3 代谢组学样本分析方法的建立
2.3.1 色谱条件
采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),进样量2 μL,流速0.4 mL·min-1,柱温40 ℃,样品仓温度4 ℃。流动相0.05%甲酸乙腈溶液(A)-0.05%甲酸水溶液(B)梯度洗脱(0~15 min,2%~100%A;15~17 min,100%A;17~18 min,100%~2%A;18~20 min,2%A)。
2.3.2 质谱条件
正离子扫描模式:电喷雾离子源(ESI),毛细管电压1.3 kV,样本锥孔电压40 V,离子源温度110 ℃,脱溶剂气温度350 ℃,脱溶剂气流量750 L·h-1,锥孔气流量20 L·h-1;负离子扫描模式:ESI,毛细管电压1.5 kV,样本锥孔电压70 V,离子源温度110 ℃,脱溶剂气温度350 ℃,脱溶剂气流量750 L·h-1,锥孔气流量20 L·h-1。应用LockSpray™校正系统进行亮氨酸脑啡肽在线质量校正,锁定质量浓度为1.0 μg·L-1,流速30 μL·min-1。数据采集范围m/z 100~1 500,采用全扫描方式。
2.3.3 多元数据分析及潜在标志物鉴定
运用Progenesis QI软件将每个代谢产物的离子强度进行“归一化”处理,将获得的数据筛除外源性的成分干扰后导入EZinfo 2.0软件,对各组数据进行非监督型主成分分析(PCA),进行多维数据的统计分析和降维处理,采用有监督的正交偏最小二乘法-判别分析(OPLS-DA)将待测样品进行强制分组分析,以弱化组内差异和个别异常值对分析结果的影响。绘制反映组间离散度的S-plot和变量重要性投射(VIP)-plot,观察代谢物轨迹是否在各自组内相似度较好,根据得分图筛选特征性代谢产物,在同一标准下鉴定出具有明显差异性的表达代谢物,筛选VIP值>1且P≤0.05的离子作为潜在的特征性生物标志物,通过人类代谢组数据库(HMDB)和京都基因与基因组百科全书(KEGG)等数据库,分析这些生物标志物的生物学意义。
2.4 小鼠造模后的一般表现
正常组小鼠运动灵敏,毛色光泽,无松毛、掉毛等现象,也无死亡情况;模型组小鼠进食减少,体质量下降,毛色枯槁,易脱落,精神萎靡,行动缓慢;与模型组比较,灵芝多糖组小鼠毛色和精神状态等方面有所改善。与正常组比较,模型组小鼠免疫器官胸腺、脾脏产生了显著性萎缩,表明造模成功;灵芝多糖组小鼠的胸腺、脾脏指数明显高于模型组(P<0.05),表明灵芝多糖能较好地促进免疫器官的恢复。见表1。
| 组别 | 胸腺指数 | 脾脏指数 |
|---|---|---|
| 正常 | 2.375±0.439 | 2.713±0.574 |
| 模型 | 0.921±0.2011) | 1.138±0.2642) |
| 灵芝多糖 | 1.539±0.3883) | 1.495±0.2223) |
2.5 PCA轮廓分析
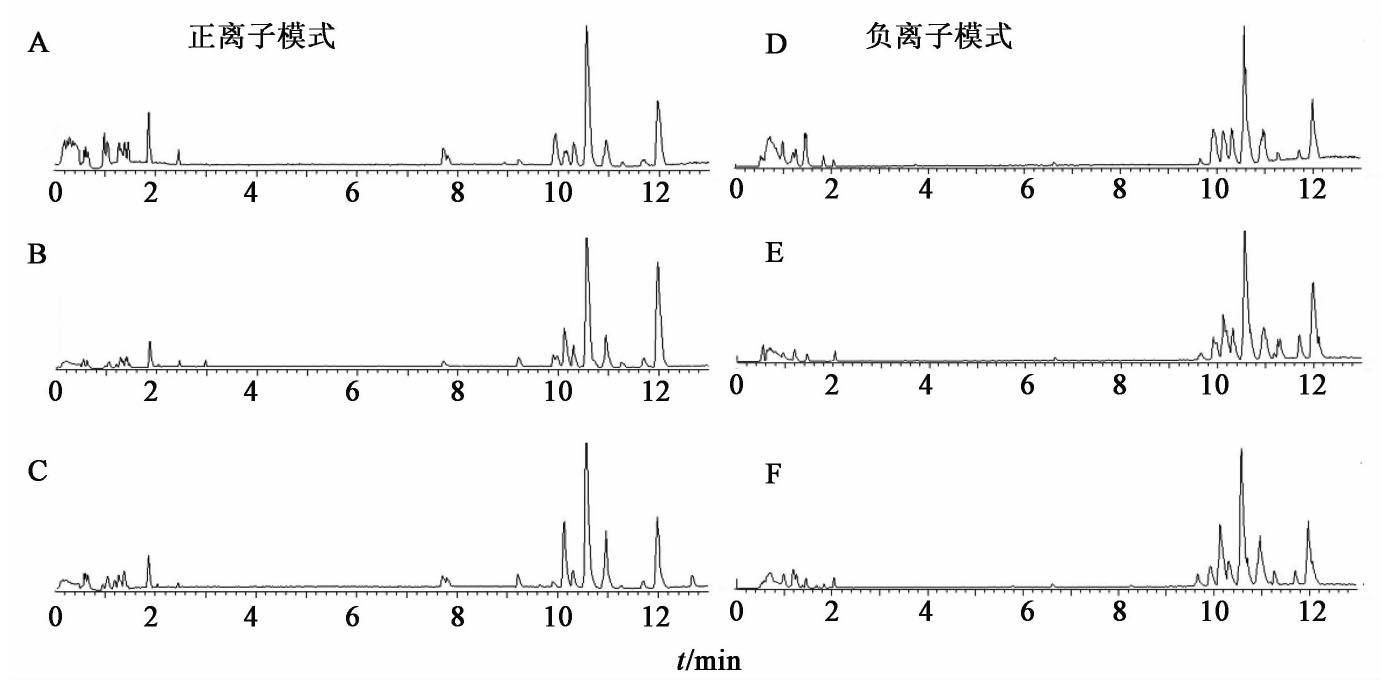
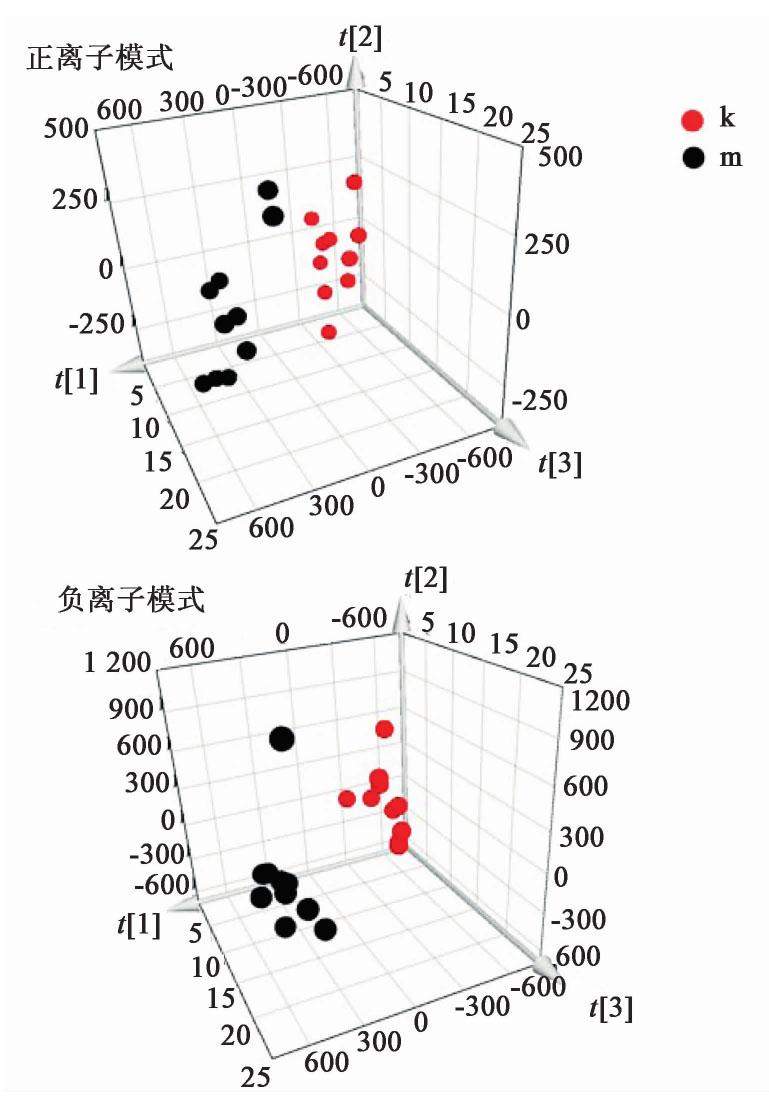
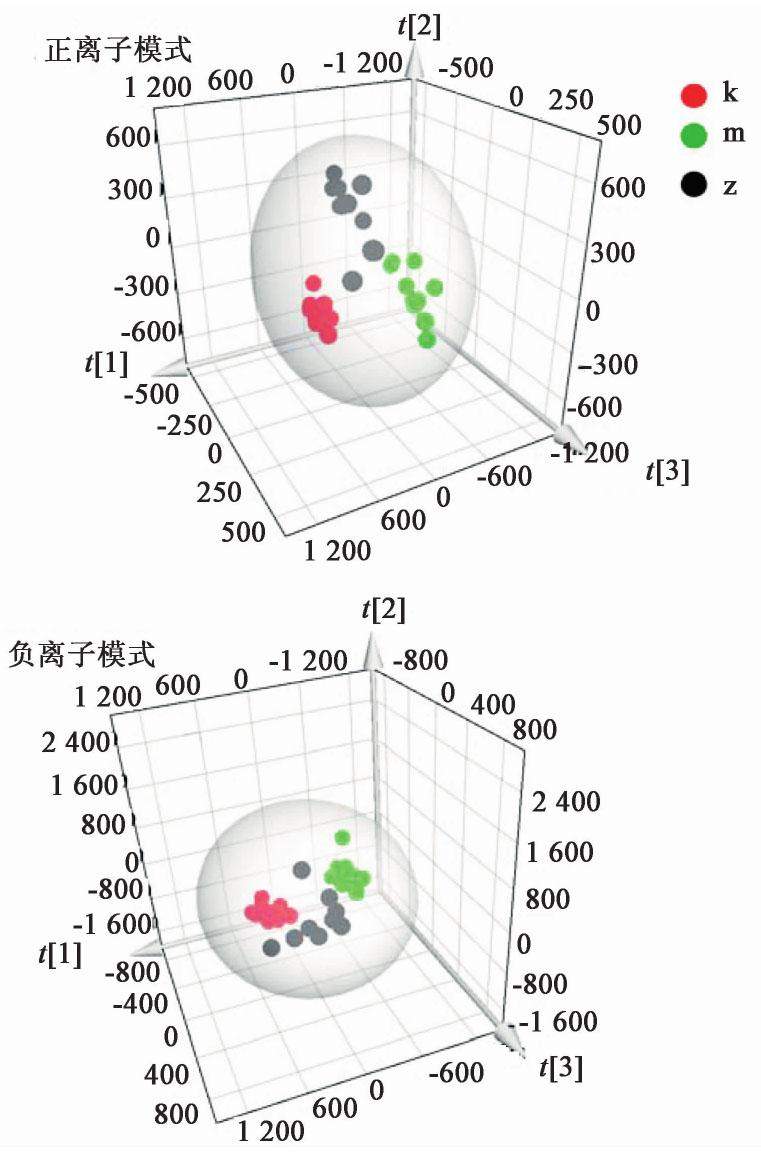
由质谱轮廓基峰强度(BPI)图谱可知,在正、负离子下各组小鼠胸腺组织代谢轮廓出现明显差异,见图1。PCA得分图结果显示,在正、负离子模式下,正常组和模型组样本分布区域基本分开,没有重叠的情况,表明小鼠辐射后胸腺代谢产物发生了明显变化,说明造模成功。灵芝多糖组、模型组与正常组小鼠胸腺代谢轮廓完全分开,说明各组样本的代谢物存在显著性差异,且灵芝多糖组处于正常组与模型组之间,说明其有一定的回调趋势,见图2,图3。
2.6 OPLS-DA轮廓分析
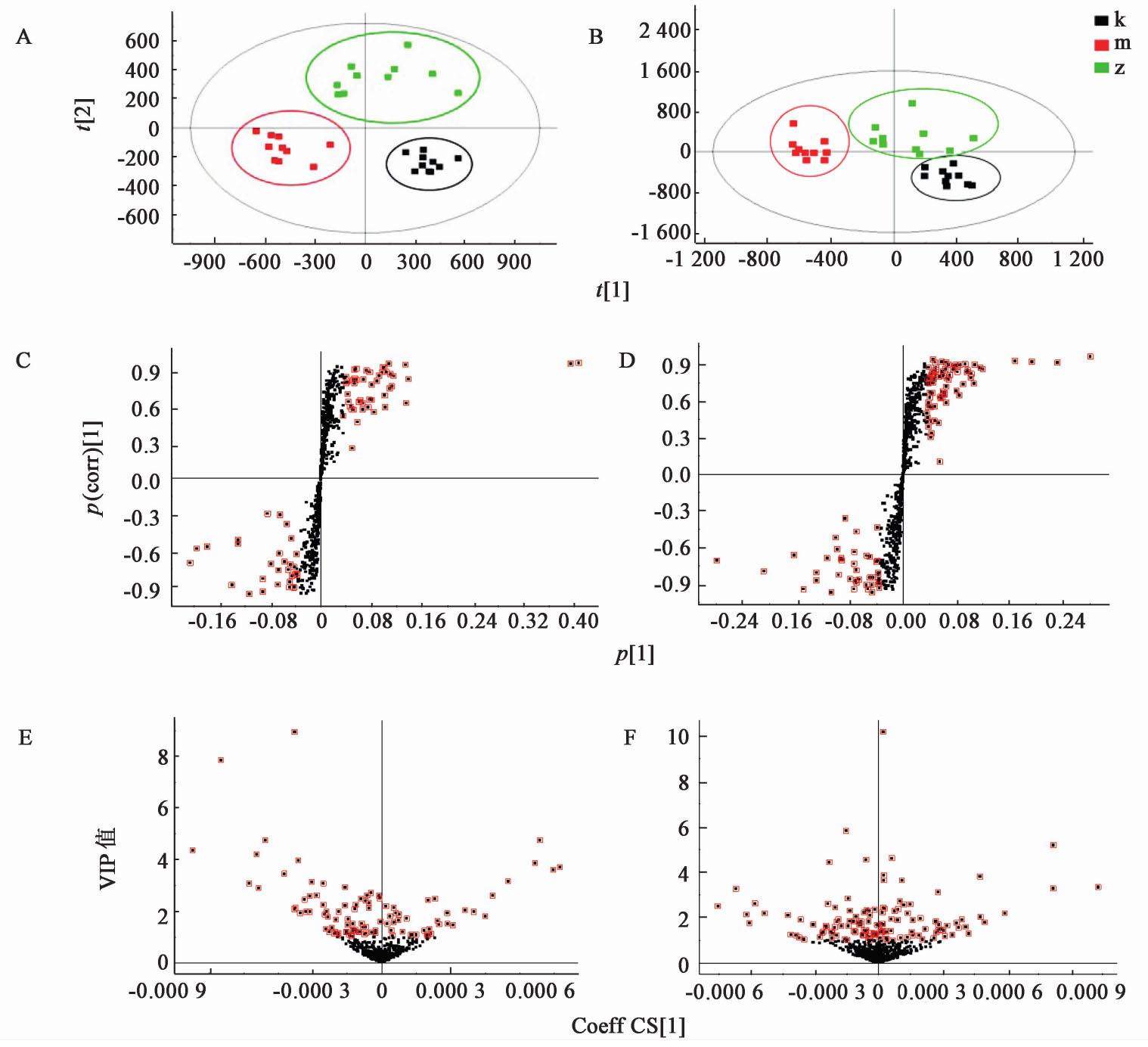
对正、负离子的质谱代谢轮廓进行OPLS-DA,获得得分图,见图4。结果发现灵芝多糖组与正常组、模型组大致可区分,基本无交叉或重叠现象,说明模型拟合效果好;灵芝多糖组与模型组分开,且有向正常组靠近的趋势,说明与模型组的偏离情况相比,灵芝多糖组已有所改善,说明灵芝多糖对辐射损伤有明显的恢复效果。在正、负离子模式下的S-plot和VIP-plot中,选定VIP值>1且P≤0.05的离子为潜在的生物标志物,红色为选中的标志物,即变量高于聚类的平均水平,见图4,结果发现选取的标志物点差异较大。
2.7 生物标志物的鉴定
通过Progenesis QI和HMDB共鉴定出34个潜在生物标志物,经灵芝多糖干预后与模型组相比存在显著差异性,提示灵芝多糖的辐射防护作用可能与这些代谢标志物有关,见表2。结果发现灵芝多糖可显著上调模型组小鼠胸腺组织中20个代谢标志物表达水平,说明灵芝多糖对小鼠胸腺辐射损伤具有调节作用。
| No. | m/z | HMDB ID | ESI模式 | 分子式 | VIP值 | 代谢物 | P | 趋势 |
|---|---|---|---|---|---|---|---|---|
| 1 | 124.002 | HMDB0000251 | + | C2H7NO3S | 1.775 | 牛磺酸taurine | 0.000 553 | ↑ |
| 2 | 259.010 | HMDB0000963 | + | C6H13O7PS | 3.267 | 5-甲基硫代二糖1-磷酸5-methylthioribose 1-phosphate | 0.000 241 | ↑ |
| 3 | 135.024 | HMDB0000157 | + | C5H4N4O | 1.129 | 次黄嘌呤hypoxanthine | 0.013 067 | ↑ |
| 4 | 345.236 | HMDB0033897 | + | C22H34O3 | 1.399 | 银杏酸ginkgolic acid | 0.000 634 | ↓ |
| 5 | 142.966 | HMDB0029571 | + | C2H4Cl2 | 1.401 | 1,2-二氯乙烷1,2-dichloroethane | 0.022 994 | ↑ |
| 6 | 289.022 | HMDB0002127 | + | C3H6O3S | 1.313 | 3-巯基乳酸3-mercaptolactic acid | 0.000 013 | ↑ |
| 7 | 319.219 | HMDB0002190 | + | C20H32O3 | 4.433 | 5,6-环氧-8,11,14-二十碳三烯酸5,6-epoxy-8,11,14-eicosatrienoic acid | 0.000 016 | ↓ |
| 8 | 592.360 | HMDB0010392 | + | C28H54NO7P | 1.081 | 溶血磷脂酰胆碱(LysoPC)[20∶2(11Z,14Z)] | 0.010 384 | ↑ |
| 9 | 639.461 | HMDB0011136 | + | C20H32O3 | 1.058 | 19-羟化二十碳四烯酸19(S)-HETE | 0.001 170 | ↑ |
| 10 | 568.361 | HMDB0010384 | + | C26H54NO7P | 2.318 | LysoPC (18∶0) | 0.015 544 | ↓ |
| 11 | 552.366 | HMDB0013122 | + | C26H54NO6P | 1.964 | LysoPC (P-18∶0) | 0.000 029 | ↓ |
| 12 | 585.351 | HMDB0000145 | + | C18H22O2 | 1.839 | 雌酮estrone | 0.000 742 | ↑ |
| 13 | 640.289 | HMDB0013058 | + | C30H47N3O10S | 1.071 | S-(9-脱氧delta9,12-PGD 2)-谷胱甘肽S-(9-deoxy-delta9,12-PGD2)-glutathione | 0.000 444 | ↓ |
| 14 | 804.559 | HMDB0004866 | + | C42H79NO13 | 3.791 | 乳糖神经酰胺(lactosylceramide)(d18∶1/12∶0) | 0.027 730 | ↓ |
| 15 | 830.572 | HMDB0008071 | + | C44H84NO8P | 2.583 | 磷脂酰胆碱(PC)[18∶1(11Z)/18∶1(9Z)] | 0.005 376 | ↑ |
| 16 | 857.640 | HMDB0000712 | + | C23H43NO6 | 1.064 | 十六烷二酸单L-肉碱酯hexadecanedioic acid mono-L-carnitine ester | 0.036 869 | ↓ |
| 17 | 568.587 | HMDB0031489 | + | C3Cl6O | 3.635 | 1,1,1,3,3,3-六氯-2-丙酮1,1,1,3,3,3-hexachloro-2-propanone | 0.000 399 | ↓ |
| 18 | 146.037 | HMDB0000148 | + | C5H9NO4 | 1.431 | L-谷氨酸L-glutamic acid | 0.000 976 | ↑ |
| 19 | 175.013 | HMDB0014684 | + | C4H3FN2O2 | 1.231 | 氟尿嘧啶fluorouracil | 0.022 132 | ↑ |
| 20 | 356.991 | HMDB0004812 | + | C6H4O5 | 1.382 | 2,5-呋喃二甲酸2,5-furandicarboxylic acid | 0.004 064 | ↓ |
| 21 | 306.066 | HMDB0028752 | + | C9H13N2O7 | 1.039 | 天冬氨酰谷氨酸aspartyl-glutamate | 0.001 968 | ↑ |
| 22 | 353.226 | HMDB0014968 | + | C11H15NO | 1.565 | 苯甲吗啉phenmetrazine | 0.005 743 | ↑ |
| 23 | 538.314 | HMDB0010383 | + | C24H48NO7P | 1.326 | LysoPC [16∶1(9Z)] | 0.012 099 | ↓ |
| 24 | 566.345 | HMDB0002815 | + | C26H52NO7P | 1.646 | LysoPC [18∶1(9Z)] | 0.007 453 | ↓ |
| 25 | 528.308 | HMDB0000722 | + | C26H45NO5S | 1.827 | 石胆酰牛磺酸lithocholyltaurine | 0.020 157 | ↑ |
| 26 | 204.125 | HMDB0012215 | - | C10H15N5O | 1.357 | 二氢玉米素dihydrozeatin | 0.000 303 | ↑ |
| 27 | 813.668 | HMDB0012107 | - | C47H93N2O6P | 5.459 | 鞘磷脂(SM)[d18∶1/24∶1(15Z)] | 0.006 698 | ↑ |
| 28 | 190.051 | HMDB0000978 | - | C10H9NO4 | 1.016 | 4-(2-氨基苯基)-2,4-二氧代丁酸4-(2-aminophenyl)-2,4-dioxobutanoic acid | 0.000 173 | ↓ |
| 29 | 279.162 | HMDB0013248 | - | C16H22O4 | 1.868 | 单乙基己基邻苯二甲酸monoethylhexyl phthalic acid | 0.000 003 | ↑ |
| 30 | 438.300 | HMDB0032797 | - | C12H18O3 | 1.259 | 茉莉酸jasmonic acid | 0.023 863 | ↑ |
| 31 | 482.359 | HMDB0036688 | - | C15H20O2 | 1.521 | 木香烯内酯costunolide | 0.000 017 | ↑ |
| 32 | 546.356 | HMDB0010393 | - | C28H52NO7P | 1.710 | LysoPC [20∶3(5Z,8Z,11Z)] | 0.000 211 | ↓ |
| 33 | 497.241 | HMDB0035626 | - | C25H36O10 | 1.880 | 格劳卡苷glaucarubin | 0.009 469 | ↓ |
| 34 | 760.584 | HMDB0007879 | - | C42H82NO8P | 3.094 | PC[14∶0/20∶1(11Z)] | 0.034 566 | ↑ |
2.8 代谢标志物的生物信息分析
将表2中鉴定的34个生物标志物输入HMDB,得到化学结构、生物功能、细胞位置的信息,见图5。结果发现化学结构包括脂质、有机酸及其衍生物、有机杂环化合物等;在生物功能中参与了细胞信号、脂肪酸代谢、磷脂/甘油磷酸脂代谢、精氨酸和脯氨酸代谢等;在细胞中主要存在于细胞外、细胞膜、细胞质。这些信息提示了标志物可能参与的机体主要生命活动,可推测药物可能的作用机制。
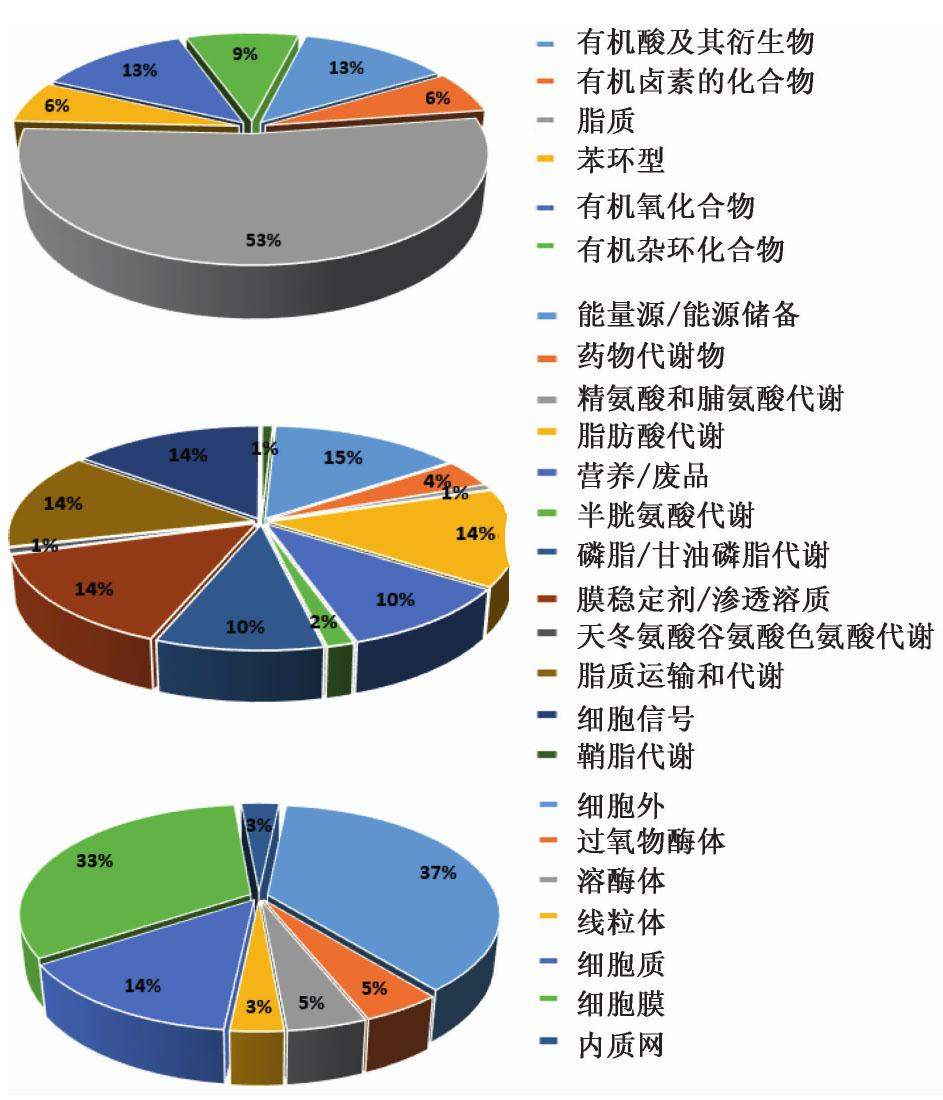
2.9 代谢通路分析
将34个潜在生物标志物进行通路显著富集分析,见图6和表3。结果找到潜在关键代谢通路为牛磺酸和亚牛磺酸代谢,D-谷氨酰胺和D-谷氨酸代谢,甘油磷脂代谢,丙氨酸、天冬氨酸和谷氨酸代谢。
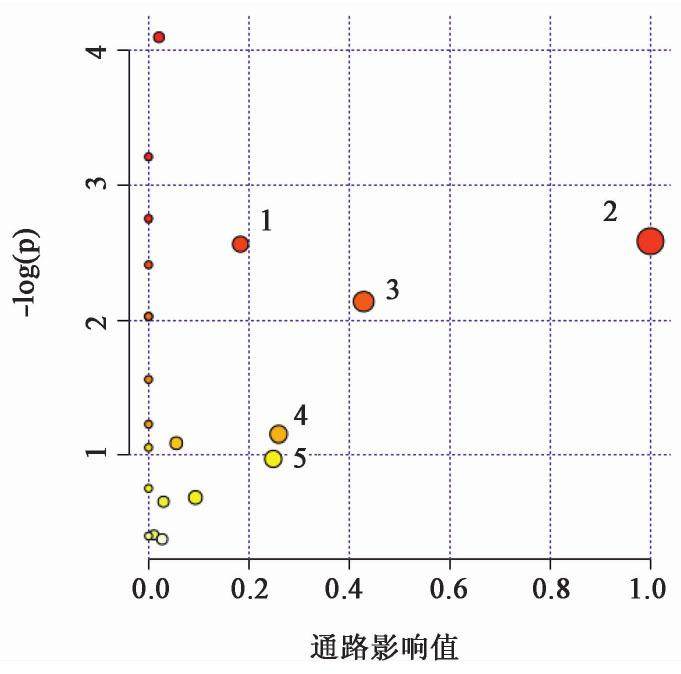
| 通路 | 化合物总数/个 | 通路期望值 | 匹配数/个 | 原始P | 通路影响值 |
|---|---|---|---|---|---|
| 花生四烯酸代谢arachidonic acid metabolism | 36 | 0.56 | 3 | 0.016 6 | 0.02 |
| 鞘脂代谢sphingolipid metabolism | 21 | 0.33 | 2 | 0.040 4 | 0 |
| 半胱氨酸和蛋氨酸代谢cysteine and methionine metabolism | 27 | 0.42 | 2 | 0.063 9 | 0 |
| D-谷氨酰胺和D-谷氨酸代谢D-Glutamine and D-glutamate metabolism | 5 | 0.08 | 1 | 0.075 3 | 1.00 |
| 甘油磷脂代谢glycerophospholipid metabolism | 30 | 0.47 | 2 | 0.077 0 | 0.18 |
| 亚油酸代谢linoleic acid metabolism | 6 | 0.09 | 1 | 0.089 8 | 0 |
| 牛磺酸和亚牛磺酸代谢taurine and hypotaurine metabolism | 8 | 0.12 | 1 | 0.117 9 | 0.43 |
| α-亚麻酸代谢α-linolenic acid metabolism | 9 | 0.14 | 1 | 0.131 7 | 0 |
| 氮代谢nitrogen metabolism | 9 | 0.14 | 1 | 0.131 7 | 0 |
| 组氨酸代谢histidine metabolism | 15 | 0.23 | 1 | 0.210 1 | 0 |
| 丁酸代谢butanoate metabolism | 22 | 0.34 | 1 | 0.293 1 | 0 |
| 丙氨酸、天冬氨酸和谷氨酸代谢alanine,aspartate and glutamate metabolism | 24 | 0.37 | 1 | 0.315 2 | 0.26 |
| 谷胱甘肽代谢glutathione metabolism | 26 | 0.40 | 1 | 0.336 7 | 0.06 |
| 卟啉和叶绿素代谢porphyrin and chlorophyll metabolism | 27 | 0.42 | 1 | 0.347 1 | 0 |
| 药物代谢-其他酶drug metabolism-other enzymes | 30 | 0.47 | 1 | 0.377 7 | 0.25 |
| 色氨酸代谢trptophan metabolism | 40 | 0.62 | 1 | 0.469 9 | 0 |
| 精氨酸和脯氨酸代谢arginine and proline metabolism | 44 | 0.68 | 1 | 0.503 0 | 0.09 |
| 原发性胆汁酸生物合成primary bile acid biosynthesis | 46 | 0.71 | 1 | 0.518 8 | 0.03 |
| 嘌呤代谢purine metabolism | 68 | 1.06 | 1 | 0.663 9 | 0.01 |
| 氨酰基-tRNA生物合成aminoacyl-tRNA biosynthesis | 69 | 1.07 | 1 | 0.669 3 | 0 |
| 类固醇激素生物合成steroid hormone biosynthesis | 72 | 1.12 | 1 | 0.685 3 | 0.03 |
3 讨论与总结
3.1 牛磺酸和亚牛磺酸代谢
牛磺酸和牛磺胆酸都参与了牛磺酸和亚牛磺酸代谢,牛磺胆酸经水解生成牛磺酸,再经半胱氨酸氧化脱羧成亚牛磺酸,进一步氧化,参与牛磺酸和亚牛磺酸代谢。牛磺酸是淋巴细胞中含量最高的游离氨基酸,占淋巴细胞中自由氨基酸的50%。研究表明牛磺酸对细胞的保护作用机制主要是作为过氧化物清除剂,清除细胞内的自由基,从而减轻辐照对机体的损伤作用[14]。此外,牛磺酸具有提高机体特异性和非特异性免疫功能的作用,缺乏牛磺酸会导致一系列免疫功能障碍。而胸腺作为机体的免疫器官,牛磺酸能不同程度的保护辐照后的淋巴细胞,进而改善辐照对免疫功能的损伤作用[15]。与正常组比较,牛磺酸在模型组中的表达水平有所下降,推测电离辐射通过抑制牛磺胆酸水解为牛磺酸的水平进而降低牛磺酸的含量,使机体造成免疫损伤;与模型组比较,牛磺酸在灵芝多糖组显著上调,说明灵芝多糖可能通过干预牛磺酸和亚牛磺酸代谢中牛磺酸的合成从而改善机体免疫系统异常。
3.2 D-谷氨酰胺和D-谷氨酸代谢
L-谷氨酸参与了丙氨酸、天冬氨酸和谷氨酸代谢及通路相关性较强的D-谷氨酰胺和D-谷氨酸代谢。在胞质中,谷氨酰胺贡献其γ(酰胺)氮来合成核苷酸和己糖胺,从而在这个过程中产生谷氨酸。胞质谷氨酸对维持氧化还原反应平衡并通过产生谷胱甘肽来避免细胞出现氧化应激非常关键[16]。本文研究表明,与空白组相比,模型组L-谷氨酸的含量显著降低,原因是受辐射损伤后机体处于应激或病理状态下,内源合成的谷氨酰胺大量消耗,对谷氨酰胺的需求量增大,导致谷氨酸合成受到抑制,进而抑制谷胱甘肽含量,使机体中自由基含量增多,免疫功能发生损伤。谷氨酰胺是免疫细胞快速生长和分化细胞的主要能源物质,其水平的变化会使免疫功能发生改变。谷氨酰胺可促进还原性谷胱甘肽的合成来对抗体内的自由基,同时对免疫细胞也有一定的防护作用[17]。而在本研究中发现,灵芝多糖组与模型组相比,L-谷氨酸含量明显回升,提示灵芝多糖可以减缓辐射对机体造成的损伤,进一步证实灵芝多糖可通过调节D-谷氨酰胺和D-谷氨酸代谢中L-谷氨酸的含量来实现改善辐射损伤。
3.3 甘油磷脂代谢
PC[18∶1(11Z)/18∶1(9Z)]和PC[14∶0/20∶1(11Z)]是磷脂酰胆碱,主要参与甘油磷脂代谢,还参与花生四烯酸代谢、亚油酸代谢和α-亚麻酸代谢,由胆碱途径、乙醇胺途径和磷脂酰丝氨酸(PS)途径3种途径合成[18]。磷脂酰胆碱具有极性和非极性部分,从而插入自身细胞膜,防止脂质过氧化,抑制脂质二硫键的断裂,防止细胞被破坏凋亡[19-20],保持其细胞的完整性。与模型组相比,灵芝多糖组的PC[18∶1(11Z)/18∶1(9Z)]和PC[14∶0/20∶1(11Z)]显著上调,推测通过上调磷脂酰胆碱来抑制电离射线造成的细胞损伤,保存细胞的完整性,有利于对电离辐射损伤的防护。
LysoPC(P-18∶0),LysoPC(18∶0),LysoPC[20∶2(11Z,14Z)],LysoPC[18∶1(9Z)],LysoPC[20∶3(5Z,8Z,11Z)],LysoPC[16∶1(9Z)]都参与甘油磷脂代谢,是单甘油磷脂,一般称为溶血磷脂酰胆碱,溶血磷脂酰胆碱是通过磷脂酶A2水解磷脂酰胆碱形成的,具有较强的表面活性剂,溶血磷脂酰胆碱含量过高,可以使组织细胞发生溶血或坏死,使机体造成损伤,免疫系统功能发生紊乱。与正常组比较,模型组中LysoPC(P-18∶0),LysoPC(18∶0),LysoPC[18∶1(9Z)],LysoPC[20∶3(5Z,8Z,11Z)],LysoPC[16∶1(9Z)]均上调,给予灵芝多糖后其表达水平显著下调,与正常组接近。推测通过抑制磷脂酶A2水解磷脂酰胆碱达到小鼠抗电离辐射的作用,说明灵芝多糖对细胞溶血及坏死有一定的保护作用。
3.4 总结
辐射损伤的发生以脂类代谢、氨基酸代谢及能量代谢的紊乱为主,其中牛磺酸和亚牛磺酸代谢,D-谷氨酰胺和D-谷氨酸代谢,甘油磷脂代谢相关性最强,使整个机体机能处于一种失衡状态。本研究结果表明内源性代谢物的变化不仅能反映出辐射损伤小鼠体内发生的生理变化,而且能在一定程度上反映灵芝多糖干预后出现的明显回调情况,这一结果与灵芝多糖能够改善胸腺免疫组织状态、减轻辐射损伤效果一致。这些结果提示灵芝多糖抗电离辐射的作用可通过胸腺中多个代谢物靶点的干预来实现,也再次证实代谢组学技术能从整体上解释机体应激状态或揭示机体接受治疗后表现出的生物学特征,更加全面了解机体辐射后的代谢过程和代谢产物,可为辐射损伤的诊断以及辐射防护药物的研制提供实验依据。但是辐射代谢组学的研究还主要集中在动物和细胞水平,随着研究的深入及新技术的出现,可以预测代谢组学技术将在辐射损伤的机制及其防治药物研究中发挥更大作用。

