抑郁症具有高发病率、高复发率、高致残率和高自杀率的特点,症状通常包括兴趣缺失,焦虑,睡眠障碍,食欲不振,缺乏精力和自杀念头等,严重影响了人们的生活质量。世界卫生组织(WHO)调查数据显示,抑郁症导致的伤残调整生命年占精神及物质使用障碍所致的伤残调整生命年的40.5%,居首位[1]。当前临床使用的抗抑郁药物存在多种问题,如治愈率低,起效延迟,性功能障碍,心脏毒性等,总体治疗效果不尽如人意,然而大量的神经影像学及分子生物学研究对抑郁症发病机制的探索尚无突破性进展,新型快速起效的抗抑郁药物的研发也止步不前[2],人们将目光转向天然植物药的开发[3-5]。
临床研究表明较低的雌激素水平增加了神经元疾病的风险,这种现象符合抑郁症的特点[6],如抑郁症患病率的性别差异、女性在生理期、孕期及绝经期发生的巨大情绪波动。雌激素与抑郁症存在某种未知关联,近年来越来越多的证据表明雌激素可改善抑郁及焦虑样行为,这可能是通过介导雌激素受体通路发挥对中枢神经系统的神经保护作用而实现[7-8]。现代医学阐述抑郁症的发病机制多从单胺类递质假说、脑源性神经营养因子,HPA轴失常,炎症反应及脑肠轴出发,对雌激素受体的探究较少。因此阐明雌激素与抑郁症之间的联系与机制具有重要意义,可为临床研究及新药开发提供新的思路及研究方向。
青娥丸由杜仲、补骨脂、核桃仁和大蒜组成,为我国传统中医药补肾益精助阳良方之一,首载于宋代的《太平惠民和剂局方》,已收录于《中国药典》[9]。药典中杜仲、补骨脂盐炙入肾,加强收藏之力以增固精之效。据临床报道用本方加减治疗中医肾阳虚证患者均有一定疗效。原发性抑郁、内源性抑郁、恶劣心境中的抑郁情绪在本质上“属虚”,五脏阳气不足是其病理基础。根据中医郁证病机中“阳虚致郁”的理论,青娥丸可改善肾阳虚所致的抑郁状态[10-12]。青娥丸全方及其药味均被报道具有改善抑郁样行为及焦虑的作用[13-18],可能通过介导雌激素受体发挥雌激素样作用起效。杨荣平等[19]、孙冠芸等[20]对青娥丸不同萃取部位的雌激素样作用及治疗阳虚作用研究后发现,青娥丸全方水煎部位具有显著的雌激素样作用,治疗阳虚效果更为明显。故本实验通过建立大鼠慢性温和不可预知应激(CUMS)模型,观察青娥丸水提物对CUMS大鼠抑郁状态的调节作用并对其机制进行探究。
1 材料
1.1 动物
SPF级雄性SD大鼠54只,体质量(180~220) g,由南通大学动物实验中心提供,合格证号201829279,动物使用合格证号SCXK(苏)2014-0001,南京中医药大学实验动物伦理委员会编号201803A016。
1.2 药物与试剂
盐杜仲(批号170723001),盐补骨脂(批号180404006),均购于北京同仁堂(南京药店),由江苏省中医院药学部副主任中药师张倩鉴定为正品,大蒜及核桃仁购于侯家桥菜市场;草酸依他普伦对照品(美仑生物公司,批号S0610A);雌激素受体α(ERα)抗体,ERβ抗体,脑源性神经营养因子(BDNF)抗体(英国Abcam公司,批号分别为ab32063,ab3576,ab108319);酪氨酸激酶受体B(TrkB)抗体(美国CST公司,批号4603);甘油醛-3-磷酸脱氢酶(GAPDH)抗体,山羊抗兔二抗(美国Proteintech公司,批号分别为10494-1-AP,SA00001-2);ECL型超敏发光液(上海天能科技有限公司,批号180-501)。
1.3 仪器
dw-10k型数显调温电热套(江苏省通州市申通电热器厂);R210型旋转蒸发仪(瑞士Buchi公司); CPA225D型电子天平(德国Sartorius公司);MM4000型混合研磨仪(德国Retsch公司);HB-202型Themo Cell恒温金属浴(杭州博日科技有限公司);LP Vortex Mixer型涡旋混合仪,Legend Micro 17R型冷冻离心机,NanoDrop 2000型超微量分光光度计(美国Thermo公司);EPED-E2-10TF型实验室超纯水仪(南京易普易达科技发展有限公司);Power Pac系列电泳装置(美国Bio-Rad公司);4600型全自动化学发光图像分析系统(上海天能科技有限公司)。
2 方法
2.1 动物分组及造模
实验前适应性饲养1周,保持12 h昼夜节律,室温(22±2) ℃,自由摄食饮水。适应性喂养1周后将54只大鼠按体质量均衡和随机的原则分为6组,9只每组,4~5只每笼。分别为正常组、模型组、阳性药草酸依他普伦组(Esc)及青娥丸低、中、高剂量组。
除正常组外,实验大鼠均接受慢性温和不可预知应激造模(CUMS)[21-22],在6周内接受以下10种刺激因子。①潮湿垫料(潮湿但不见水迹),②禁食24 h,③禁水24 h,④闪光,⑤束缚应激6 h,⑥夹尾5 min,⑦游泳5 min,⑧触摸陌生异常物品,⑨昼夜颠倒24 h,⑩水平震荡10 min。每天随机选择2~3种刺激,期间正常组自由摄食。4周后采用行为学(包括糖水偏好实验、旷场实验、强迫游泳实验)进行抑郁模型评价,确认造模成功后开始给药,给药的同时持续造模。
2.2 药物制备及给药
根据《中国药典》中青娥丸处方,盐杜仲、盐补骨脂、核桃仁(炒)、大蒜的比例为16∶8∶5∶4,加水回流提取2次,每次10倍量提取2 h,将2次合并的提取液滤过后进行浓缩。将浓缩药液倒入棕色广口玻璃瓶中于-20 ℃冰箱中密封保存。1 980 g水提物浓缩至568 mL,即每1 mL药液含3.5 g原药材。
青娥丸成人用量为27 g·d-1,其中8 g为炼蜜量,故实际服用中药材量为19 g·d-1。根据《药理学实验方法》,按照体表面积折算,大鼠的等效剂量为人等效剂量的6.3倍。故青娥丸低、中、高剂量组给药剂量分别为1.71,5.13,15.39 g·kg-1,按照每100 g·mL-1的给药原则进行灌胃;本实验组得出Esc的小鼠较佳用量为10 mg·kg-1·d-1,换算为大鼠的等效剂量则为6.3 mg·kg-1·d-1,按照每200 g·mL-1的给药原则进行腹腔注射;正常组以及模型组灌胃等体积的生理盐水。于造模成功后给予各组相应药物,连续给药2周。
2.3 糖水消耗实验
糖水消耗是反应动物快感缺失的重要有效指标,而快感缺失正是抑郁症的核心症状[23]。实验动物在适应性期间给予2瓶2%蔗糖溶液适应3 d后方可进行实验。测糖水消耗率前禁水24 h,所有大鼠均单笼测试,每笼给予体积相同的1瓶2%的蔗糖溶液和1瓶纯水,测试4 h,其中2 h后2瓶水交换位置(防止大鼠有位置偏好)。测试结束后计算各组糖水消耗率。糖水消耗率=[(蔗糖消耗量)/(纯水消耗量+蔗糖消耗量)]×100%。糖水偏好率是用于评定CUMS造模是否成功的经典指标。
2.4 强迫游泳实验
强迫游泳实验通过观察动物在不可逃避的应激条件下,因绝望导致其不动时间的改变来反映药物的抗抑郁效果[24],大鼠的绝望行为是评价大鼠抑郁样行为的重要指标。
正式实验前24 h进行预游泳,将测试大鼠放入25 ℃水中,室温25 ℃,大鼠悬浮,四肢不能触及桶底,15 min后将大鼠取出、擦干后放回笼中。次日在同样的条件下进行强迫游泳5 min,记录5 min内大鼠静止不动时间(大鼠仅有头部露出水面,呈漂浮状态,四肢可有微动但不挣扎)。测试过程采用摄影机记录。
2.5 旷场实验
旷场实验通过观察动物的自发性活动来评定其行为状态,暴露于CUMS的大鼠会显著减少旷场的水平探索、垂直探索和梳理,表现为无精打采,冷漠和自身忽视[25]。
实验前需提前将大鼠搬入测试室,使大鼠适应环境至少1 h。将大鼠放入高40 cm,长宽均为50 cm,内壁涂黑,底面平均分为25个10 cm×10 cm小方格的箱底中心,同时进行摄像和计时,以5 min内大鼠穿越箱底面的方格数为水平得分(三爪以上跨入),穿越一格得1分;以大鼠双前肢抬起次数为垂直得分(两前肢离地1 cm以上),双前肢离地一次得1分;以大鼠理毛或洗脸次数为自我修饰得分,理毛或洗脸一次得1分,单次实验结束后用乙醇擦拭箱底,待气味散尽后进行下一次实验。其中水平得分反映了动物的活动度,竖直得分反映动物对新异环境探究度,自我修饰得分反映动物对自身的关注度。
2.6 蛋白免疫印迹法(Western blot)检测大鼠海马组织ERα,ERβ,BDNF,TrkB蛋白表达
从-80 ℃冰箱中拿出大鼠的大脑海马组织,对海马组织进行称质量。根据质量向每份组织中加入相应体积的总蛋白裂解液(以RIPA裂解液-PMSF-蛋白酶抑制剂为100∶1∶4的比例进行配制),并加入小钢珠用混合研磨仪以30 Hz研磨1 min。离心后,取上清液得到样本总蛋白。利用超微量分光光度计得出各样本蛋白的浓度后,加入磷酸盐缓冲液(PBS)调整为统一浓度后加入相应体积的蛋白上样缓冲液(5倍),金属浴5 min,使蛋白充分变性。以上所有过程均冰上操作。
制备12%SDS聚丙烯酰胺凝胶,上样,电泳,转膜,封闭,一抗按以下比例4 ℃孵育过夜,ERα (1∶1 000),ERβ (1∶1 000),BDNF (1∶1 000),TrkB (1∶1 000),GAPDH (1∶5 000)。次日TBST洗膜3次,室温孵育二抗(1∶5 000)1 h,TBST洗膜3次,加入ECL显影液显色。化学发光成像显影仪中扫描成像,用Image J软件分析目的条带的灰度值,目的蛋白表达水平以其与内参GAPDH灰度比值来表示。
2.7 统计学分析
采用Graph Pad Prism 6软件对实验结果进行统计分析,数据采用
3 结果
3.1 对CUMS大鼠糖水消耗实验的影响
与正常组大鼠比较,模型组大鼠的糖水消耗比例显著下降(P<0.01),说明CUMS造模成功,该模型很好的模拟了人类患抑郁症时快感缺失的症状。经过药物干预后,与模型组大鼠比较,Esc组(P<0.01),青娥丸低、中、高剂量组的糖水消耗比例均有不同程度的回升,其中仅Esc组与青娥丸中剂量组具有统计学意义(P<0.05,P<0.01)。见表1。
| 组别 | 剂量/g·kg-1 | 糖水消耗率/% | 游泳不动时间/s | 旷场实验/分 | ||
|---|---|---|---|---|---|---|
| 水平得分 | 垂直得分 | 修饰得分 | ||||
| 正常 | - | 81.5±11.5 | 65.1±18.7 | 132.6±18.1 | 35.3±6.8 | 4.6±2.2 |
| 模型 | - | 42.1±19.22) | 108.8±40.32) | 86.9±20.12) | 19.6±5.42) | 1.6±0.81) |
| Esc | 0.006.3 | 70.6±13.84) | 65.5±27.63) | 129.4±25.84) | 33.0±6.24) | 3.7±2.6 |
| 青娥丸 | 1.71 | 57.7±15.1 | 71.9±31.03) | 111.7±24.9 | 24.0±4.4 | 2.7±1.1 |
| 5.13 | 67.0±15.84) | 66.8±16.53) | 117.7±17.33) | 31.0±7.13) | 3.3±1.4 | |
| 15.39 | 58.0±9.5 | 82.1±14.5 | 107.1±12.0 | 27.4±8.2 | 2.7±1.4 | |
3.2 对CUMS大鼠强迫游泳实验的影响
与正常组大鼠比较,模型组大鼠游泳不动时间显著增加(P<0.01),很好地模拟了抑郁大鼠的绝望状态;经过药物干预后,与模型组大鼠比较,Esc组,青娥丸低、中剂量组大鼠的不动时间明显下降(P<0.05),青娥丸高剂量组无显著差异。见表1。
3.3 对CUMS大鼠旷场实验的影响
与正常组大鼠比较,模型组大鼠的水平得分、垂直得分和修饰得分明显减少(P<0.05,P<0.01),反映了抑郁大鼠对周围环境及自身的忽视与冷漠;经过药物干预后,与模型组大鼠比较,Esc组和青娥丸中剂量组大鼠的水平得分和垂直得分均有明显上升(P<0.05),而修饰得分仅显现出回升趋势而无显著性差异。见表1。
3.4 对CUMS抑郁大鼠海马中ERα,ERβ,BDNF,TrkB蛋白表达的影响
与正常组比较,模型组大鼠海马雌激素受体ERα的蛋白表达明显减少(P<0.05,P<0.01),ERβ,BDNF,TrkB蛋白表达水平也明显下降(P<0.05,P<0.01);与模型组比较,给予2周药物治疗后,Esc能够明显上调CUMS抑郁大鼠海马中雌激素受体ERα与BDNF蛋白的表达,而青娥丸中剂量组能够同时上调了ERα,ERβ,BDNF,TrkB蛋白表达(P<0.05,P<0.01)。见表2,图1。
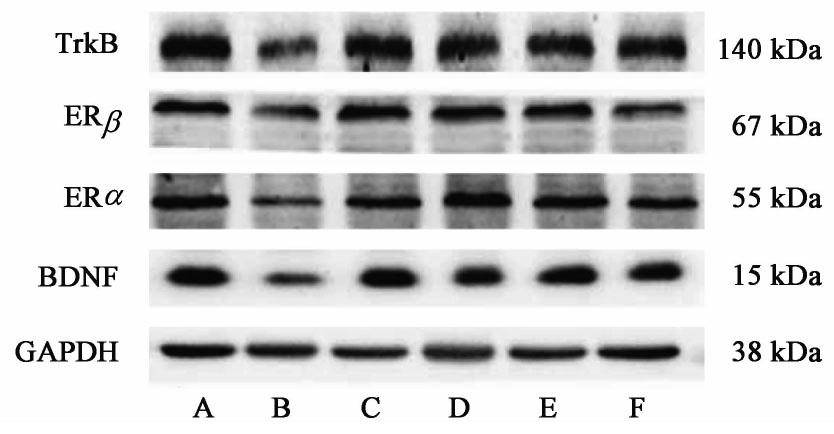
| 组别 | 剂量/g·kg-1 | ERα/GAPDH | ERβ/GAPDH | BDNF/GAPDH | TrkB/GAPDH |
|---|---|---|---|---|---|
| 正常 | - | 1.00±0.06 | 1.00±0.11 | 1.00±0.12 | 1.00±0.04 |
| 模型 | - | 0.63±0.112) | 0.65±0.171) | 0.51±0.042) | 0.64±0.201) |
| Esc | 0.006.3 | 0.96±0.144) | 0.92±0.14 | 0.99±0.134) | 0.93±0.06 |
| 青娥丸 | 1.71 | 0.84±0.09 | 0.88±0.01 | 0.66±0.21 | 0.90±0.09 |
| 5.13 | 0.93±0.043) | 0.99±0.143) | 1.01±0.124) | 0.97±0.103) | |
| 15.39 | 0.76±0.11 | 0.82±0.15 | 0.89±0.083) | 0.80±0.20 |
4 讨论
临床和实验研究表明,雌激素参与了涉及认知、行为和记忆的神经可塑性,可作用于神经系统迅速改变不同的信号通路,并通过影响神经元生长,突触可塑性提供来自压力和创伤的神经保护,这些作用取决于激素水平及神经回路中不同雌激素受体的相互作用[26-27]。传统上认为雌激素通过2种主要雌激素核受体的相互作用发挥其大部分生物学作用:ERα和ERβ。从社会精神病学的统计数据看来,ERα和ERβ mRNA多态性与重度抑郁症(MDD)有相关性,涉及抑郁症的易感性[28-30]。雌激素的抗抑郁机制可能以雌激素受体为媒介。
近来越来越多的研究发现雌激素受体在调节焦虑和抑郁样行为中起重要作用。但关于ERα和ERβ对抑郁症影响的研究结果有较大出入,其中对ERα的争议较大,有人认为ERα与致焦虑有关,也有人认为ERα有助于抵抗应激,减小抑郁易感性。这些不同的研究结果可能与研究设计内容差异有关,如研究模型、造模时间、造模的缓急轻重及研究对象等。关于ERα和ERβ在应激敏感的大脑区域中的表达知之甚少,因此在抑郁背景下对海马中ERα和ERβ的变化规律进行研究有益于进一步了解雌激素受体调节抑郁的机制。本研究中与正常组比较,模型组大鼠海马中的ERα与ERβ的蛋白表达发生显著性下降,经过药物治疗后二者均向正常水平回调,证实了抑郁与雌激素受体有关,且呈负相关关系。其中青娥丸中剂量组显著上调了ERα与ERβ,可能起效于其植物雌激素样作用。阳性药依他普伦显著上调了ERα,对ERβ仅有回调趋势。具体ERα与ERβ在抑郁症中分别扮演了什么角色仍有待探究。
BDNF在神经系统中广泛表达,主要起着对神经元的存活、生长和诱导分化以及诱导神经元迁移的作用,对神经系统发育和功能的维持具有重要作用。有研究报道抑郁症患者脑内的BDNF蛋白表达低于正常人,经治疗后BDNF蛋白回调,是抑郁症的经典指标[31]。TrkB是BDNF的受体,共同参与突触可塑性的调节。BDNF/TrkB信号通路与抑郁症密切相关。而雌激素可通过介导雌激素受体ERα和ERβ调节BDNF的活性,对BDNF的表达和信号传导均具有正调节作用[32]。因此雌激素可通过激活BDNF间接调控其下游多种信号传导,如TrkB,5-羟色胺能系统等。Chhibber等[33]通过海马神经元细胞、基因突变动物模型及其他设计研究了ERβ对BDNF及血清素[5-羟色胺(5-HT)]的影响,证明了他们的初步假设:减弱的ERβ信号传导减少了BDNF基因的转录,从而降低脑海马区域中的BDNF蛋白水平。而BDNF水平和BDNF/TrkB信号的降低会削弱神经突触强度,从而损害大脑适应和增加抑郁风险的能力。同时减弱的BDNF/TrkB信号传导也增加了5-HT 2A的活性,这可能有助于增加抑郁症的易感性。但该实验仅证明了ERβ为BDNF/TrkB信号通路的上游调节因子,尚未探究是否抑郁会造成ERβ/BDNF/TrkB信号通路出现一致下降的趋势。本实验中,与正常组比较,模型组大鼠海马组织中ERβ,BDNF,TrkB的蛋白表达均有显著性减少,经药物治疗后显著回调,说明了ERβ/BDNF/TrkB信号通路与抑郁的相关性,ERβ可能在抑郁症中作为上游因子调节BDNF/TrkB通路起到抗抑郁作用。其中青娥丸水提物中剂量组的效果最为明显。
综上所述,本研究证实了青娥丸具有抗抑郁作用,其机制通过植物雌激素样作用于雌激素受体及上调大脑海马中ERβ/BDNF/TrkB信号通路从而发挥神经保护作用有关。但青娥丸水提物由雌激素受体介导的抗抑郁机制仍有待深入研究。
