中药配方颗粒是以饮片投料,经水提、浓缩、干燥、制粒而成,经中医临床配方后,供患者冲服使用,是对传统中药饮片的补充,其保持了传统中药汤剂水煎提取的物质基础,免除了临床服用前的煎煮环节,方便患者携带、服用,是中药汤剂现代化、标准化发展的重要实践方式。《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》中将标准汤剂作为衡量中药配方颗粒是否与临床汤剂基本一致的标准参照物,并应进行原料、中间体、成品与“标准汤剂”的比对研究,以说明生产全过程量值传递。近年来,中药配方颗粒的研究内容主要在化学分析方面,内容涉及中药配方颗粒原料(中药饮片)和成品的鉴别与鉴定、含量测定、质量标准的制定和质量监控等内容[1],但对配方颗粒相关性的研究较少。
生地黄为玄参科植物地黄Rehmannia glutinosa的干燥块根,秋季采挖,除去芦头、须根及泥沙,缓缓烘焙约八成干[2]。熟地黄是生地黄经酒炖或蒸制炮制加工而得。熟地黄味甘,微温,归肝、肾经,长于补血滋阴、益精填髓,常被用于治疗精血不足和肝肾阴虚等。熟地黄中主要含有环烯醚萜苷类、苯乙醇苷类、糖类、氨基酸类、金属离子等多种化学成分。目前关于熟地黄的HPLC指纹图谱的研究,大多都是研究原料、配方颗粒的指纹图谱,但由熟地黄饮片经标准汤剂最终制成熟地黄配方颗粒,整个过程其化学成分如何进行传递,尚无相关研究报道。因此本研究选用山西(产量约占全国50%左右),河南(产量约占全国40%左右)两大产区的饮片,利用HPLC法建立了熟地黄饮片、标准汤剂、中间体、配方颗粒的指纹图谱,运用UPLC-Q-TOF-MS分析技术指认特征峰,并对其相关性进行评价,为熟地黄配方颗粒制备全过程的质量控制提供实验依据。
1 材料
LC-20AT型高效液相色谱仪(日本岛津),1290型超高效液相色谱,连接6530型四级杆-飞行时间串联质谱仪(美国安捷伦公司),BT25S型1/10万,BS124S型1/1万电子分析天平(赛多利斯科学仪器有限公司),DR-98-ⅡA型电热恒温水浴锅(天津市泰斯特仪器有限公司),KQ-500B型超声波提取清洗器(昆山市超声仪器有限公司),RE5205型旋转蒸发仪(上海亚荣生化仪器厂),BGZ-140型电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂),98-1-B型电子调温电热套(天津市泰斯特仪器有限公司)。
甲醇、乙腈为色谱级(赛孚瑞公司),磷酸为分析纯(天津福晨化学试剂厂);水为娃哈哈纯净水。
17批生地黄药材来源河南、山西。经暨南大学药学院传统中药研究中心主任曹晖老师鉴定均为玄参科植物地黄Rehmannia glutinosa的干燥块根。由本实验室参照2015年版《中国药典》(以下简称药典)熟地黄炮制方法(酒蒸法)将17批地黄药材炮制为熟地黄饮片,经检验均符合药典规定。由本实验室根据《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》制备熟地黄的标准汤剂,并制定熟地黄标准汤剂的质量标准。根据标准汤剂的要求,研究熟地黄的配方颗粒制备工艺,使配方颗粒与标准汤剂的质量保持一致性。选取具有代表性的10批饮片,按确定的配方颗粒制备工艺,制成10批中试批量的熟地黄配方颗粒。
毛蕊花糖苷(批号111530-201512,纯度96.7%),地黄对照药材(批号121180-201506),5-羟甲基糠醛(批号111626-201512),均购自中国食品药品检定研究院。
2 方法与结果
2.1 熟地黄饮片、标准汤剂、中间体、配方颗粒中毛蕊花糖苷含量测定
2.1.1 色谱条件
InertSustion AQ C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈-0.1%乙酸溶液(16∶84);流速1.0 mL·min-1;检测波长334 nm;进样体积20 μL。
2.1.2 对照品溶液的制备
取毛蕊花糖苷对照品适量,精密称定,加流动相制成每1 mL含10 μg的溶液,即得。
2.1.3 供试品溶液的制备
熟地黄饮片供试品溶液的制备同药典熟地黄饮片项下方法。
熟地黄标准汤剂、中间体、配方颗粒供试品制备方法:分别取标准汤剂粉末约0.5 g,中间体约2 g,配方颗粒约2 g,精密称定,置具塞锥形瓶中,精密加入流动相50 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)30 min,取出,放冷,再称定质量,用流动相补足减失的质量,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.4 线性关系考察
取毛蕊花糖苷对照品适量,加流动相,配制成质量浓度为100.04 mg·L-1的毛蕊花糖苷对照品贮备溶液;精密量取对照品贮备溶液0.1,0.5,1,3,7 mL,分置10 mL量瓶中,用流动相稀释至刻度,摇匀,配制成质量浓度分别为1.000 4,5.002,10.004,30.012,70.028,100.04 mg·L-1的对照品溶液,连同对照品贮备溶液,分别精密吸取20 μL,注入液相色谱仪,以进样量为横坐标,峰面积为纵坐标,得回归方程Y=1 825 414.938 3X-16 503.308 4(r=1.000 0),结果表明,毛蕊花糖苷在0.020 008~2.000 8 μg内线性良好。
2.1.5 精密度试验
取同一批次熟地黄标准汤剂样品,按2.1.3项下方法制备供试品溶液,连续进样6次,测定毛蕊花糖苷峰面积,计算得其RSD为0.3%。
2.1.6 稳定性试验
取同一批次熟地黄标准汤剂样品,按2.1.3项下方法制备供试品溶液,分别在制备后0,2,4,8,13,18,24 h进样测定,测定毛蕊花糖苷峰面积,计算得其RSD为0.3%。
2.1.7 重复性试验
取同一批次熟地黄标准汤剂样品,按2.1.3项下方法制备供试品溶液,平行制备6份供试品溶液,测定毛蕊花糖苷含量,计算得其RSD为1.0%。
2.1.8 加样回收试验
取同一批次熟地黄标准汤剂样品9份,分别精密加入与其相当量的50%,100%,150%的毛蕊花糖苷对照品,各平行3份,制备供试品溶液,测定含量,计算得毛蕊花糖苷的平均回收率为104.85%,RSD为0.8%。
2.1.9 样品含量测定
熟地黄饮片中毛蕊花糖苷质量分数均>0.020%,符合药典要求。见表1。
| 编号 | 饮片来源 | 质量分数 | 转移率 | 出膏率 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 饮片 | 标准汤剂 | 中间体 | 配方颗粒 | 标准汤剂 | 中间体 | 配方颗粒 | 标准汤剂 | 中间体 | ||
| 1 | 河南温县 | 0.038 | 0.036 | 0.035 | 0.031 | 68.73 | 73.90 | 76.13 | 64.8 | 61.1 |
| 2 | 0.033 | 0.030 | 0.027 | 0.024 | 64.48 | 68.91 | 68.19 | 62.8 | 64.2 | |
| 3 | 0.028 | 0.029 | 0.027 | 0.023 | 74.18 | 77.77 | 77.30 | 62.7 | 61.2 | |
| 4 | 0.042 | 0.037 | 0.042 | 0.035 | 60.75 | 76.20 | 74.82 | 65.0 | 60.5 | |
| 5 | 河南焦作孟州 | 0.026 | 0.028 | 0.024 | 0.021 | 72.31 | 72.73 | 72.60 | 61.2 | 62.2 |
| 6 | 0.030 | 0.033 | 0.026 | 0.023 | 69.06 | 69.38 | 69.92 | 57.3 | 62.3 | |
| 7 | 0.029 | 0.037 | 0.026 | 0.023 | 78.70 | 72.25 | 71.04 | 56.7 | 64.5 | |
| 8 | 山西临汾襄汾 | 0.038 | 0.032 | 0.036 | 0.031 | 55.26 | 71.45 | 72.38 | 61.1 | 60.9 |
| 9 | 0.026 | 0.032 | 0.026 | 0.022 | 78.87 | 79.39 | 76.56 | 58.6 | 62.3 | |
| 10 | 0.059 | 0.044 | 0.057 | 0.052 | 54.59 | 78.78 | 78.98 | 67.9 | 64.7 | |
根据技术要求,对熟地黄标准汤剂的质量标准进行了研究,暂定熟地黄标准汤剂中出膏率在40.0%~83.0%,毛蕊花糖苷转移率在45.0%~90.0%。对同批次饮片、标准汤剂、中间体、配方颗粒进行测定,以出膏率、毛蕊花糖苷含量和转移率为评价指标,进行量值传递研究。
从表1数据可见熟地黄饮片、标准汤剂、中间体中毛蕊花糖苷含量基本一致,熟地黄中间体的出膏率、毛蕊花糖苷转移率均在标准汤剂标准范围之内且与标准汤剂基本一致,熟地黄配方颗粒中间体的毛蕊花糖苷含量稍偏低,原因为加入了辅料,但转移率基本一致。
2.2 熟地黄饮片、标准汤剂、中间体、配方颗粒HPLC指纹图谱的建立
2.2.1 色谱条件
Phenomenex Luna 100A C18(2)色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)和0.1%磷酸水(B),梯度洗脱(0~30 min,5%~10%A;30~80 min,10%~15%A;80~110 min,15%~20%A;110~130 min,20%~30%A;130~140 min,30%A);流速1.0 mL·min-1;检测波长300 nm;进样体积10 μL。
2.2.2 对照品溶液的制备
取毛蕊花糖苷对照品适量,加甲醇制成每1 mL含40 μg的溶液,即得。
2.2.3 供试品溶液的制备
取熟地黄饮片粗粉(过四号筛)约1.5 g,精密称定,置圆底烧瓶中,精密加水25 mL,称定质量,煎煮30 min,放冷,用水补足减失的质量,滤过,精密量取续滤液10 mL,通过D101型大孔吸附树脂柱(内径为1 cm,柱长15 cm),以水20 mL洗脱,弃去水液,再用30%甲醇40 mL洗脱,弃去30%甲醇洗脱液,继用甲醇40 mL洗脱,收集洗脱液,减压回收溶剂近干,残渣加乙腈-0.1%磷酸(10∶90)使溶解,转移至10 mL量瓶中,用乙腈-0.1%磷酸(10∶90)稀释至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
分别取标准汤剂1 g,中间体1.5 g,配方颗粒1.5 g,精密称定,置具塞锥形瓶中,精密加水25 mL,超声使溶解,滤过,精密量取续滤液10 mL,通过D101型大孔吸附树脂柱(内径为1 cm,柱长15 cm),以水20 mL洗脱,弃去水液,再用30%甲醇40 mL洗脱,弃去30%甲醇洗脱液,继用甲醇60 mL洗脱,收集洗脱液,减压回收溶剂至近干,残渣加10%甲醇使溶解,转移至10 mL量瓶中,用10%甲醇稀释至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
经与对照品比对,峰4为毛蕊花糖苷的色谱峰,因其吸收较强,响应稳定,达到基线分离且为药典熟地黄项下含量测定指标成分,故选择毛蕊花糖苷作为参照峰,并将毛蕊花糖苷标记为峰S,计算熟地黄饮片、标准汤剂、中间体、配方颗粒中共有峰的相对保留时间和相对峰面积的RSD。以熟地黄标准汤剂进行方法学考察。
2.2.4 精密度试验
取同一批次熟地黄标准汤剂样品,按2.2.3项下方法制备供试品溶液,按照2.1.1项下条件连续进样6次,结果各共有峰相对保留时间和相对峰面积RSD均<3.0%,表明仪器精密度良好。
2.2.5 稳定性试验
取同一批次熟地黄标准汤剂样品,按2.2.3项下方法制备供试品溶液,分别在0,2,4,8,12,24,48 h进样,结果各共有峰相对保留时间和相对峰面积RSD均<3.0%,表明供试品溶液在48 h内稳定性良好。
2.2.6 重复性试验
取同一批次熟地黄标准汤剂样品6份,按2.2.3项下方法制备供试品溶液,按照2.2.1项下色谱条件测定,结果各共有峰相对保留时间和相对峰面积RSD均<3.0%,表明该方法重复性良好。
2.2.7 样品的测定
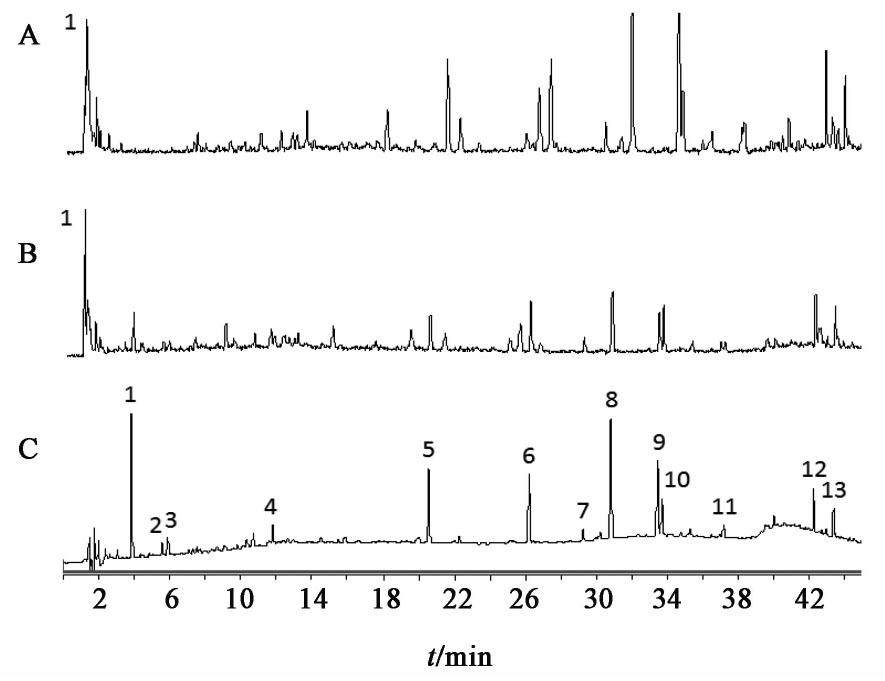
取17批熟地黄饮片,17批熟地黄标准汤剂,10批熟地黄中间体,10批熟地黄配方颗粒供试品溶液10 μL,熟地黄饮片、熟地黄标准汤剂、中间体、配方颗粒色谱图见图1,图2,图3,图4。
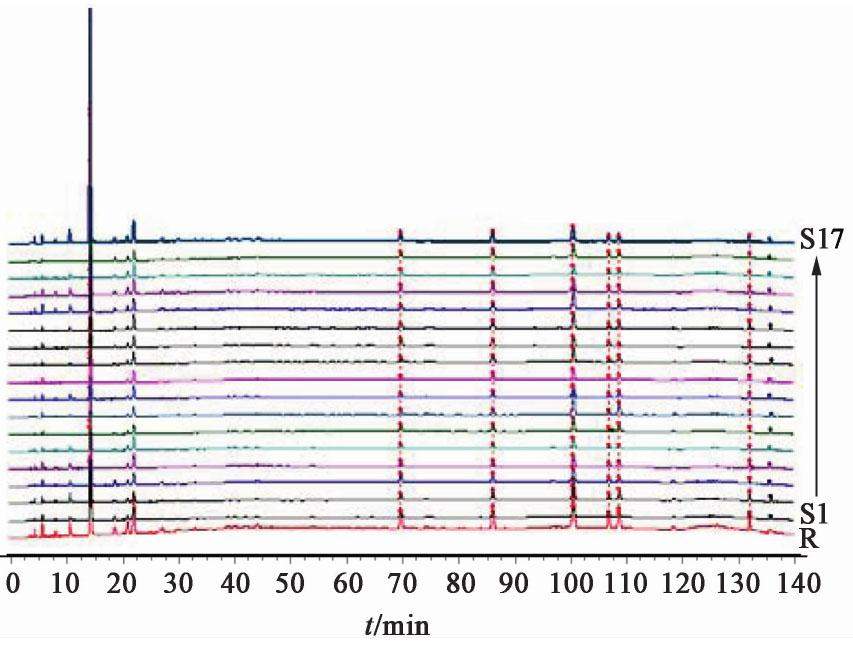
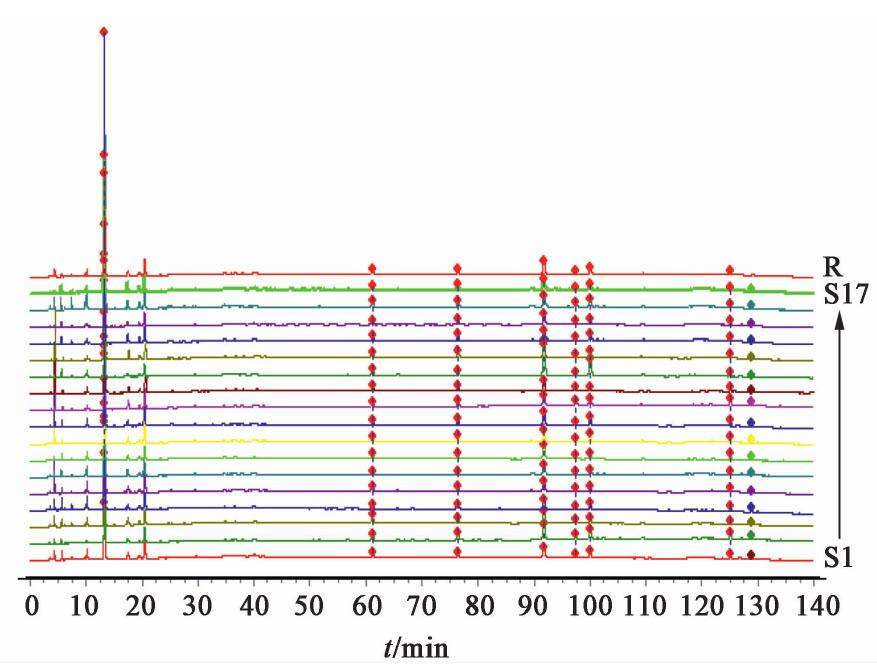
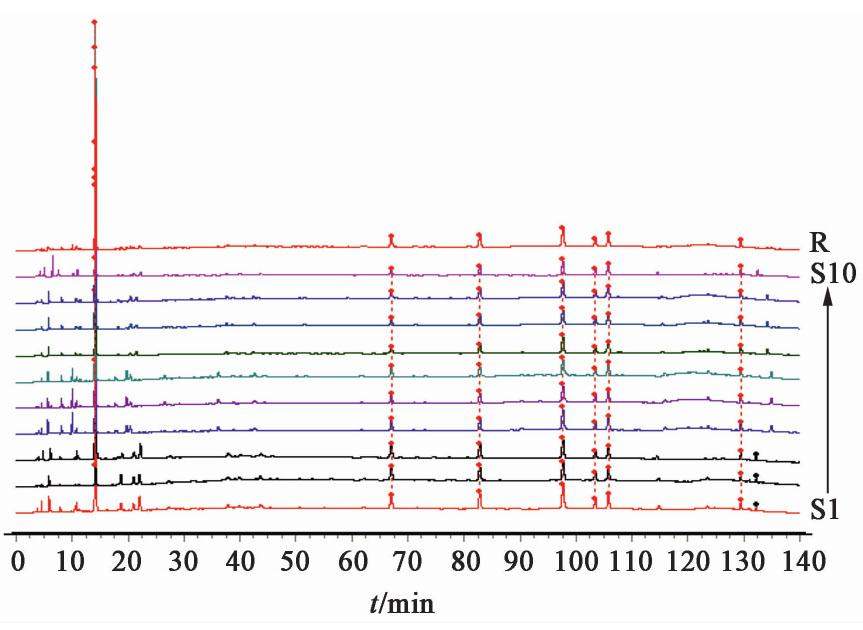
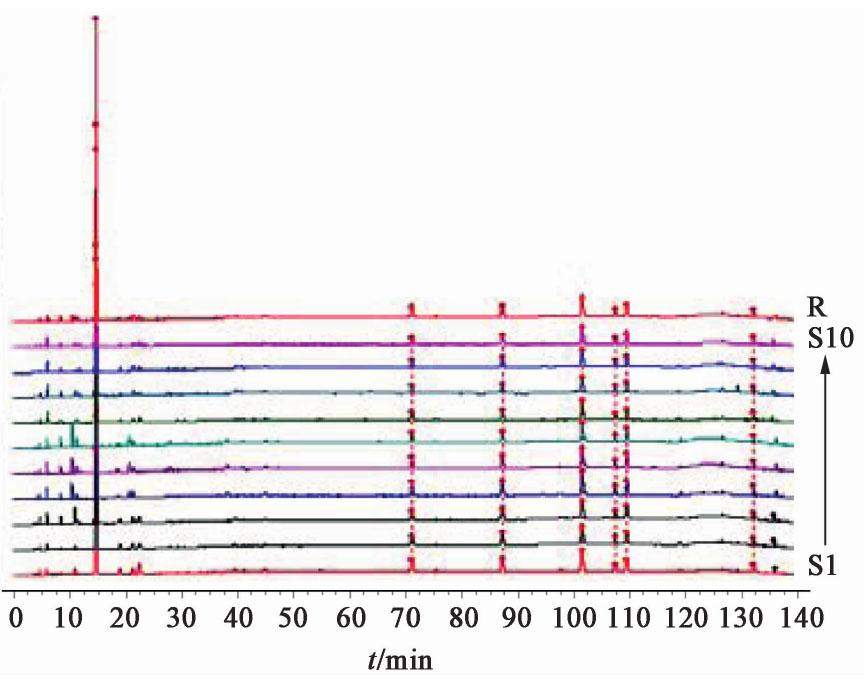
2.2.8 共有峰的标定
采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价软件系统2012年A版》,分别将17批熟地黄饮片,17批熟地黄标准汤剂,10批熟地黄中间体,10批熟地黄配方颗粒的HPLC图谱色谱峰进行自动匹配,形成共有模式图,并建立对照图谱。经比较分析后确定熟地黄饮片、熟地黄标准汤剂、中间体、配方颗粒的HPLC指纹图谱基本一致,均有7个共有峰,其中因1号5-羟甲基糠醛峰面积占比超过60%,故计算相似度时屏蔽此峰。除1号5-羟甲基糠醛峰外,以共有峰计算相似度,相似度均在0.90~1,结果显示,17批熟地黄饮片、标准汤剂,10批熟地黄中间体,配方颗粒的HPLC相似度均在0.90以上,说明熟地黄配方颗粒生产工艺稳定。见表2,表3,表4,表5。
| 批号 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | S13 | S14 | S15 | S16 | S17 | R |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | 1.000 | 0.988 | 0.996 | 0.994 | 0.998 | 0.992 | 0.922 | 0.993 | 0.994 | 0.995 | 0.985 | 0.991 | 0.967 | 0.992 | 0.993 | 0.987 | 0.976 | 0.997 |
| S2 | 0.988 | 1.000 | 0.980 | 0.986 | 0.987 | 0.992 | 0.956 | 0.996 | 0.990 | 0.998 | 0.955 | 0.996 | 0.987 | 0.981 | 0.970 | 0.966 | 0.958 | 0.995 |
| S3 | 0.996 | 0.980 | 1.000 | 0.989 | 0.999 | 0.989 | 0.914 | 0.987 | 0.988 | 0.990 | 0.993 | 0.986 | 0.962 | 0.992 | 0.998 | 0.990 | 0.979 | 0.994 |
| S4 | 0.994 | 0.986 | 0.989 | 1.000 | 0.990 | 0.991 | 0.901 | 0.990 | 0.992 | 0.991 | 0.981 | 0.987 | 0.951 | 0.988 | 0.988 | 0.989 | 0.980 | 0.991 |
| S5 | 0.998 | 0.987 | 0.999 | 0.990 | 1.000 | 0.992 | 0.930 | 0.990 | 0.989 | 0.994 | 0.987 | 0.990 | 0.971 | 0.990 | 0.994 | 0.985 | 0.973 | 0.997 |
| S6 | 0.992 | 0.992 | 0.989 | 0.991 | 0.992 | 1.000 | 0.933 | 0.995 | 0.991 | 0.995 | 0.968 | 0.985 | 0.971 | 0.993 | 0.986 | 0.985 | 0.981 | 0.996 |
| S7 | 0.922 | 0.956 | 0.914 | 0.901 | 0.930 | 0.933 | 1.000 | 0.935 | 0.914 | 0.947 | 0.864 | 0.945 | 0.985 | 0.902 | 0.887 | 0.866 | 0.854 | 0.942 |
| S8 | 0.993 | 0.996 | 0.987 | 0.990 | 0.990 | 0.995 | 0.935 | 1.000 | 0.998 | 0.998 | 0.968 | 0.993 | 0.978 | 0.993 | 0.983 | 0.981 | 0.978 | 0.998 |
| S9 | 0.994 | 0.990 | 0.988 | 0.992 | 0.989 | 0.991 | 0.914 | 0.998 | 1.000 | 0.994 | 0.975 | 0.990 | 0.966 | 0.995 | 0.987 | 0.987 | 0.983 | 0.994 |
| S10 | 0.995 | 0.998 | 0.990 | 0.991 | 0.994 | 0.995 | 0.947 | 0.998 | 0.994 | 1.000 | 0.971 | 0.997 | 0.984 | 0.989 | 0.983 | 0.977 | 0.969 | 0.999 |
| S11 | 0.985 | 0.955 | 0.993 | 0.981 | 0.987 | 0.968 | 0.864 | 0.968 | 0.975 | 0.971 | 1.000 | 0.970 | 0.928 | 0.981 | 0.995 | 0.988 | 0.974 | 0.977 |
| S12 | 0.991 | 0.996 | 0.986 | 0.987 | 0.990 | 0.985 | 0.945 | 0.993 | 0.990 | 0.997 | 0.970 | 1.000 | 0.984 | 0.980 | 0.976 | 0.968 | 0.956 | 0.995 |
| S13 | 0.967 | 0.987 | 0.962 | 0.951 | 0.971 | 0.971 | 0.985 | 0.978 | 0.966 | 0.984 | 0.928 | 0.984 | 1.000 | 0.957 | 0.944 | 0.930 | 0.920 | 0.981 |
| S14 | 0.992 | 0.981 | 0.992 | 0.988 | 0.990 | 0.993 | 0.902 | 0.993 | 0.995 | 0.989 | 0.981 | 0.980 | 0.957 | 1.000 | 0.994 | 0.995 | 0.994 | 0.993 |
| S15 | 0.993 | 0.970 | 0.998 | 0.988 | 0.994 | 0.986 | 0.887 | 0.983 | 0.987 | 0.983 | 0.995 | 0.976 | 0.944 | 0.994 | 1.000 | 0.996 | 0.988 | 0.988 |
| S16 | 0.987 | 0.966 | 0.990 | 0.989 | 0.985 | 0.985 | 0.866 | 0.981 | 0.987 | 0.977 | 0.988 | 0.968 | 0.930 | 0.995 | 0.996 | 1.000 | 0.997 | 0.983 |
| S17 | 0.976 | 0.958 | 0.979 | 0.980 | 0.973 | 0.981 | 0.854 | 0.978 | 0.983 | 0.969 | 0.974 | 0.956 | 0.920 | 0.994 | 0.988 | 0.997 | 1.000 | 0.975 |
| R | 0.997 | 0.995 | 0.994 | 0.991 | 0.997 | 0.996 | 0.942 | 0.998 | 0.994 | 0.999 | 0.977 | 0.995 | 0.981 | 0.993 | 0.988 | 0.983 | 0.975 | 1.000 |
| 批号 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | S13 | S14 | S15 | S16 | S17 | R |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | 1.000 | 0.996 | 0.985 | 0.994 | 0.996 | 0.986 | 0.984 | 0.995 | 0.996 | 0.986 | 0.984 | 0.933 | 0.975 | 0.995 | 0.993 | 0.996 | 0.999 | 0.995 |
| S2 | 0.996 | 1.000 | 0.971 | 0.997 | 0.995 | 0.986 | 0.985 | 1.000 | 0.999 | 0.982 | 0.983 | 0.935 | 0.980 | 0.996 | 0.994 | 0.991 | 0.995 | 0.995 |
| S3 | 0.985 | 0.971 | 1.000 | 0.976 | 0.986 | 0.978 | 0.979 | 0.971 | 0.976 | 0.983 | 0.989 | 0.917 | 0.959 | 0.984 | 0.984 | 0.983 | 0.988 | 0.983 |
| S4 | 0.994 | 0.997 | 0.976 | 1.000 | 0.997 | 0.990 | 0.989 | 0.998 | 0.997 | 0.993 | 0.990 | 0.924 | 0.976 | 0.995 | 0.996 | 0.993 | 0.995 | 0.995 |
| S5 | 0.996 | 0.995 | 0.986 | 0.997 | 1.000 | 0.994 | 0.993 | 0.996 | 0.998 | 0.991 | 0.995 | 0.940 | 0.984 | 0.998 | 0.998 | 0.994 | 0.999 | 0.999 |
| S6 | 0.986 | 0.986 | 0.978 | 0.990 | 0.994 | 1.000 | 0.999 | 0.987 | 0.992 | 0.985 | 0.993 | 0.962 | 0.993 | 0.987 | 0.988 | 0.977 | 0.990 | 0.997 |
| S7 | 0.984 | 0.985 | 0.979 | 0.989 | 0.993 | 0.999 | 1.000 | 0.985 | 0.990 | 0.986 | 0.994 | 0.958 | 0.991 | 0.985 | 0.987 | 0.974 | 0.988 | 0.995 |
| S8 | 0.995 | 1.000 | 0.971 | 0.998 | 0.996 | 0.987 | 0.985 | 1.000 | 0.999 | 0.984 | 0.985 | 0.931 | 0.980 | 0.997 | 0.996 | 0.992 | 0.996 | 0.995 |
| S9 | 0.996 | 0.999 | 0.976 | 0.997 | 0.998 | 0.992 | 0.990 | 0.999 | 1.000 | 0.985 | 0.988 | 0.943 | 0.986 | 0.997 | 0.996 | 0.992 | 0.997 | 0.998 |
| S10 | 0.986 | 0.982 | 0.983 | 0.993 | 0.991 | 0.985 | 0.986 | 0.984 | 0.985 | 1.000 | 0.991 | 0.903 | 0.960 | 0.985 | 0.988 | 0.988 | 0.989 | 0.986 |
| S11 | 0.984 | 0.983 | 0.989 | 0.990 | 0.995 | 0.993 | 0.994 | 0.985 | 0.988 | 0.991 | 1.000 | 0.933 | 0.980 | 0.991 | 0.994 | 0.983 | 0.991 | 0.993 |
| S12 | 0.933 | 0.935 | 0.917 | 0.924 | 0.940 | 0.962 | 0.958 | 0.931 | 0.943 | 0.903 | 0.933 | 1.000 | 0.982 | 0.929 | 0.927 | 0.906 | 0.936 | 0.954 |
| S13 | 0.975 | 0.980 | 0.959 | 0.976 | 0.984 | 0.993 | 0.991 | 0.980 | 0.986 | 0.960 | 0.980 | 0.982 | 1.000 | 0.979 | 0.979 | 0.961 | 0.979 | 0.991 |
| S14 | 0.995 | 0.996 | 0.984 | 0.995 | 0.998 | 0.987 | 0.985 | 0.997 | 0.997 | 0.985 | 0.991 | 0.929 | 0.979 | 1.000 | 0.999 | 0.995 | 0.998 | 0.996 |
| S15 | 0.993 | 0.994 | 0.984 | 0.996 | 0.998 | 0.988 | 0.987 | 0.996 | 0.996 | 0.988 | 0.994 | 0.927 | 0.979 | 0.999 | 1.000 | 0.994 | 0.997 | 0.996 |
| S16 | 0.996 | 0.991 | 0.983 | 0.993 | 0.994 | 0.977 | 0.974 | 0.992 | 0.992 | 0.988 | 0.983 | 0.906 | 0.961 | 0.995 | 0.994 | 1.000 | 0.997 | 0.989 |
| S17 | 0.999 | 0.995 | 0.988 | 0.995 | 0.999 | 0.990 | 0.988 | 0.996 | 0.997 | 0.989 | 0.991 | 0.936 | 0.979 | 0.998 | 0.997 | 0.997 | 1.000 | 0.997 |
| R | 0.995 | 0.995 | 0.983 | 0.995 | 0.999 | 0.997 | 0.995 | 0.995 | 0.998 | 0.986 | 0.993 | 0.954 | 0.991 | 0.996 | 0.996 | 0.989 | 0.997 | 1.000 |
| 批号 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | R |
|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | 1.000 | 0.997 | 0.999 | 0.995 | 0.997 | 0.996 | 0.990 | 0.997 | 0.995 | 0.968 | 0.998 |
| S2 | 0.997 | 1.000 | 0.999 | 0.988 | 0.993 | 0.991 | 0.978 | 0.991 | 0.987 | 0.949 | 0.993 |
| S3 | 0.999 | 0.999 | 1.000 | 0.992 | 0.995 | 0.994 | 0.985 | 0.995 | 0.992 | 0.959 | 0.996 |
| S4 | 0.995 | 0.988 | 0.992 | 1.000 | 0.998 | 0.999 | 0.995 | 0.996 | 0.996 | 0.982 | 0.998 |
| S5 | 0.997 | 0.993 | 0.995 | 0.998 | 1.000 | 1.000 | 0.994 | 0.999 | 0.998 | 0.979 | 1.000 |
| S6 | 0.996 | 0.991 | 0.994 | 0.999 | 1.000 | 1.000 | 0.994 | 0.998 | 0.998 | 0.980 | 0.999 |
| S7 | 0.990 | 0.978 | 0.985 | 0.995 | 0.994 | 0.994 | 1.000 | 0.997 | 0.998 | 0.993 | 0.996 |
| S8 | 0.997 | 0.991 | 0.995 | 0.996 | 0.999 | 0.998 | 0.997 | 1.000 | 1.000 | 0.982 | 0.999 |
| S9 | 0.995 | 0.987 | 0.992 | 0.996 | 0.998 | 0.998 | 0.998 | 1.000 | 1.000 | 0.987 | 0.999 |
| S10 | 0.968 | 0.949 | 0.959 | 0.982 | 0.979 | 0.980 | 0.993 | 0.982 | 0.987 | 1.000 | 0.980 |
| R | 0.998 | 0.993 | 0.996 | 0.998 | 1.000 | 0.999 | 0.996 | 0.999 | 0.999 | 0.980 | 1.000 |
| 批号 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | R |
|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | 1.000 | 0.996 | 0.988 | 0.999 | 0.999 | 0.997 | 0.992 | 0.997 | 0.995 | 0.918 | 0.995 |
| S2 | 0.996 | 1.000 | 0.996 | 0.997 | 0.999 | 0.999 | 0.996 | 0.999 | 0.999 | 0.939 | 0.999 |
| S3 | 0.988 | 0.996 | 1.000 | 0.992 | 0.993 | 0.995 | 0.997 | 0.995 | 0.998 | 0.965 | 0.998 |
| S4 | 0.999 | 0.997 | 0.992 | 1.000 | 0.999 | 0.999 | 0.997 | 0.998 | 0.997 | 0.935 | 0.998 |
| S5 | 0.999 | 0.999 | 0.993 | 0.999 | 1.000 | 1.000 | 0.995 | 0.998 | 0.998 | 0.932 | 0.998 |
| S6 | 0.997 | 0.999 | 0.995 | 0.999 | 1.000 | 1.000 | 0.997 | 0.998 | 0.999 | 0.940 | 0.999 |
| S7 | 0.992 | 0.996 | 0.997 | 0.997 | 0.995 | 0.997 | 1.000 | 0.997 | 0.999 | 0.958 | 0.999 |
| S8 | 0.997 | 0.999 | 0.995 | 0.998 | 0.998 | 0.998 | 0.997 | 1.000 | 1.000 | 0.939 | 0.999 |
| S9 | 0.995 | 0.999 | 0.998 | 0.997 | 0.998 | 0.999 | 0.999 | 1.000 | 1.000 | 0.948 | 1.000 |
| S10 | 0.918 | 0.939 | 0.965 | 0.935 | 0.932 | 0.940 | 0.958 | 0.939 | 0.948 | 1.000 | 0.951 |
| R | 0.995 | 0.999 | 0.998 | 0.998 | 0.998 | 0.999 | 0.999 | 0.999 | 1.000 | 0.951 | 1.000 |
2.3 共有峰的指认
通过质谱检测对熟地黄配方颗粒指纹图谱中的共有峰进行指认。
2.3.1 仪器
Agilent 1290型超高效液相色谱(UPLC),连接6530型四级杆-飞行时间串联质谱仪(Q-TOF-MS)。配有2个独立二元泵、可控温自动进样器、可控温柱温箱、二极管阵列检测器(DAD)和电喷雾离子源(ESI)。
2.3.2 供试品溶液的制备
同2.1.3项下方法制备供试品溶液。
2.3.3 色谱条件
采用Agilent Eclipse Plus C18色谱柱(2.1 mm×150 mm,1.8 μm),配有在线过滤器;柱温40 ℃;流速0.3 mL·min-1;流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱程序(0~10 min,5%~10%B;10~27 min,10%~15%B;27~37 min,15%~20%B;37~43 min,20%~30%B;43~47 min,30%B;47~48 min,30%~100%B;48~52 min,100% B);检测波长300 nm;每次进样1 μL。
2.3.4 质谱条件
分别在正、负离子模式下进行,干燥气温度350 ℃,干燥气流速10 L·min-1,雾化气压力206 kPa,毛细管电压3 500 V(正模式)和3 000 V(负模式),碰撞电压150 V。一级质谱选用MS1模式,质量扫描范围m/z 50~1 500。二级质谱选用Target-MS/MS模式,碰撞电压20,40 V。所得数据由Agilent MassHunter软件采集。
2.3.5 质谱分析
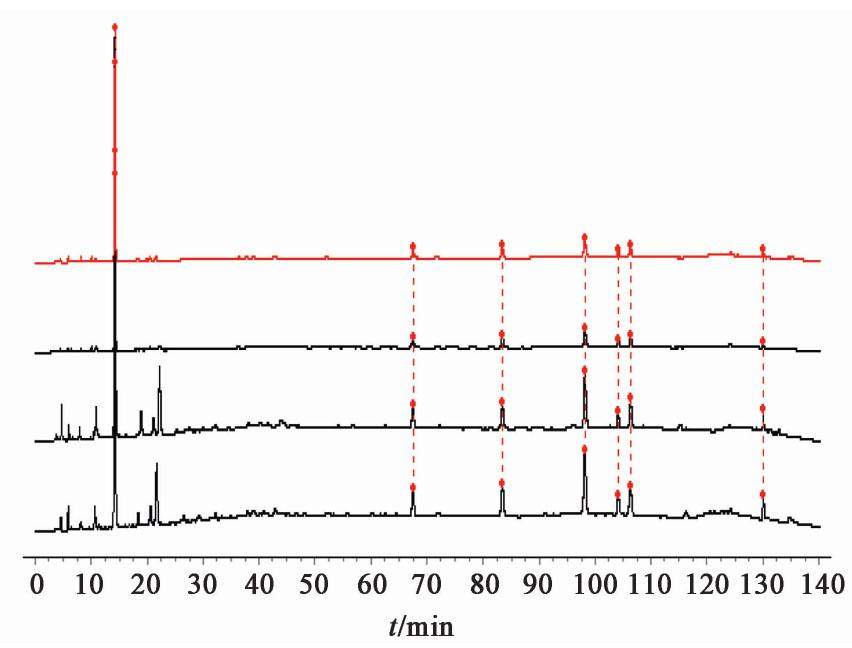
精密吸取熟地黄配方颗粒供试品溶液注入UPLC-Q-TOF-MS仪,按上述条件进行检测,得到熟地黄配方颗粒UPLC-UV色谱图和正负模式的UPLC-MS总离子流图,见图5。利用软件Agilent Mass Hunter Qualitative Analysis B.08.00对供试品进行一级质谱分析,选择误差在5×10-6以内的分子式进行数据库自动匹配,对化合物进行初步鉴定。再通过选择目标化合物进行二级质谱扫描,得到化合物的碎片离子信息,结合对照品(5-羟甲基糠醛、毛蕊花糖苷)以及相关文献对目标化合物进行鉴定,分析结果见表6。
| No. | 化合物名称 | 分子式 | 一级正模式下加合离子m/z(δ) | 一级负模式下加合离子m/z(δ) | 二级正、负模式下特征碎片离子m/z |
|---|---|---|---|---|---|
| 1 | 5-羟甲基糠醛[3-4](5-hydroxymethyl furfural) | C6H6O3 | 127.039 2[M+H]+(1.82)149.021 1[M+Na]+(1.25) | 125.024 4[M-H]-(0.14) | 125.024 6[M-H]-,107.014 1[M-HCOO]- |
| 2 | 5-羟甲基糠酸[5] (5-hydroxymethyl furoic acid) | C6H6O4 | 143.033 9[M+H]+(0.10) | 无响应 | 143.033 6[M+H]+,125.022 9[M+H-H2O]+,99.031 8[M+H-HCOOH]+ |
| 3 | 2,5-二羟甲基呋喃[6-7](2,5-bis-hydroxymethyl furan) | C6H6O3 | 129.054 6[M+H]+(0.16),151.036 6[M+Na]+(0.23) | 127.040 1[M-H]-(0.25) | 127.040 3[M-H]-109.030 0[M-H-H2O]-91.020 1[M-H-H2O]- |
| 4 | 3-甲氧基酪氨酸[8] (3-methoxytyrosine) | C10H13NO4 | 234.074 0[M+Na]+(1.38),212.091 4[M+H]+(1.58) | 210.075 8[M-H]-(2.75) | 212.091 5[M+H]+,166.097 3[M+H-HCOOH]+,151.092 6[M+H-HCOOH-CH3]+ |
| 5 | 洋地黄叶苷C/松果菊苷[8-9] (purpureaside C/echinacoside) | C35H46O20 | 804.290 9[M+NH4]+(1.46),809.246 9[M+Na]+(0.70),825.221 7[M+H]+(0.36) | 785.249 5[M-H]-(1.87),821.225 3[M+Cl]-(2.85) | 785.252 7[M-H]-,623.220 9[M-H-caffeoyl]-,461.167 4[M-H-caffeoyl-Glc]-,161.023 6[caffeic acid-H-H2O]- |
| 6 | 焦地黄苯乙醇苷A1/焦地黄苯乙醇苷A2[8,10] (jionoside A1/jionoside A2) | C36H48O20 | 818.306 9[M+NH4]+(1.00),823.262 1[M+Na]+(1.23),839.236 7[M+H]+(0.42) | 799.264 1[M-H]-(2.90),835.243 7[M+Cl]-(0.48) | 799.265 2[M-H]-,623.218 9[M-H-feruloyl]-,461.166 2[M-H-feruloyl-Glc]-,175.040 3[ferulic acid-H-H2O]- |
| 7 | 焦地黄苯乙醇苷A1/焦地黄苯乙醇苷A2[8,10](jionoside A1/jionoside A2) | C36H48O20 | 818.307 2[M+NH4]+(0.64),823.262 3[M+Na]+(0.99),839.236 1[M+H]+(1.14) | 799.265 0 [M-H]-(2.02),835.243 2[M+Cl]-(0.11) | 799.267 9[M-H]-,623.225 2[M-H-feruloyl]-,461.173 5[M-H-feruloyl-Glc]-,175.039 5[ferulic acid-H-H2O]- |
| 8 | 毛蕊花糖苷[8,11](acteoside) | C29H36O15 | 642.238 6[M+NH4]+(1.01),647.193 5[M+Na]+(1.77),625.213 0[M+H]+(0.49) | 623.195 9 [M-H]-(2.47),659.176 0[M+Cl]-(1.78) | 623.198 3[M-H]-,461.168 8[M-H-caffeoyl]-,315.109 6[M-H-caffeoyl-Rha]-,161.024 1[caffeic acid-H-H2O]- |
| 9 | 异毛蕊花糖苷[8,11](isoacteoside) | C29H36O15 | 647.195 5[M+Na]+(1.33),625.212 3[M+H]+(0.64),642.238 9[M+NH4]+(0.54) | 623.196 1[M-H]-(2.15),659.170 1[M+Cl]-(2.91) | 623.201 2[M-H]-,461.170 0[M-H-caffeoyl]-,315.110 0[M-H-caffeoyl-Rha]-,161.024 4[caffeic acid-H-H2O]- |
| 10 | 焦地黄苯乙醇苷B1/焦地黄苯乙醇苷B2[8,10](jionoside B1/jionoside B2) | C37H50O20 | 837.278 3[M+Na]+(0.56),832.322 3[M+NH4]+(1.29),853.252 9[M+K]+(0.23) | 813.280 9[M-H]-(1.68),849.260 1[M+Cl]-(1.36) | 813.285 4[M-H]-,637.233 8[M-H-feruloyl]-,473.170 1[M-H-feruloyl-Rha-H2O]-,175.039 6[ferulic acid-H-H2O]- |
| 11 | 焦地黄苯乙醇苷D/米团花苷A[10,12] (jionoside D/leucoseptoside A) | C30H38O15 | 661.209 6[M+Na]+(1.05),656.254 1[M+NH4]+(1.21),639.226 5[M+H]+(2.74) | 637.212 1 [M-H]-(2.65),673.189 4 [M+Cl]-(1.59) | 637.219 0[M-H]-,461.168 7[M-H-feruloyl]-,315.110 2[M-H-feruloyl-Rha]-,175.039 7[ferulic acid-H-H2O]- |
| 12 | 地黄苷[8,13](martynoside) | C31H40O15 | 675.225 5[M+Na]+(0.66),670.270 7[M+NH4]+(0.23),691.199 6[M+K]+(0.40) | 651.228 2[M-H]-(1.91),687.204 7[M+Cl]-,(2.07) | 651.232 6 [M-H]-475.187 0 [M-H-feruloyl]-,329.123 6[M-H-feruloyl-Rha]-,175.040 2[ferulic acid-H-H2O]- |
| 13 | 异地黄苷[8,13](isomartynoside) | C31H40O15 | 675.224 3 [M+Na]+(2.43),670.270 6[M+NH4]+(0.08),691.198 7[M+K]+,(1.71) | 1 651.227 9[M-H]-(2.37),687.203 5[M+Cl]-(2.94) | 651.233 8[M-H]-,475.187 0[M-H-feruloyl]-,329.127 4[M-H-feruloyl-Rha]-,175.039 6[ferulic acid-H-H2O]- |
通过UPLC色谱图与熟地黄配方颗粒HPLC指纹图谱中各色谱峰的紫外吸收特点及相对保留时间的比较,确定两组图色谱峰之间的对应关系,并对HPLC指纹图谱共有峰进行指认,分别得到峰1为5-羟甲基糠醛,峰4为毛蕊花糖苷,峰5为异毛蕊花糖苷,峰7为地黄苷。
2.4 熟地黄饮片、标准汤剂、中间体、配方颗粒相关性分析
熟地黄饮片、标准汤剂、中间体、配方颗粒HPLC指纹图谱比采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价软件系统(2012A)》,分别将熟地黄饮片、标准汤剂、中间体、配方颗粒生成的对照指纹图谱导入,计算熟地黄饮片、标准汤剂、中间体、配方颗粒的相似度,结果见图6,表7。由图谱可知熟地黄饮片、标准汤剂、中间体、配方颗粒相应位置上均呈现7共有峰。由表7可以看出相似度在0.95以上,说明熟地黄配方颗粒和饮片、中间体、标准汤剂主要化学成分基本一致,指纹图谱相关性良好,为采用HPLC指纹图谱对熟地黄配方颗粒生产全过程进行控制提供试实验依据。
| No. | S1 | S2 | S3 | S4 | R |
|---|---|---|---|---|---|
| S1 | 1.000 | 0.999 | 0.996 | 0.989 | 0.998 |
| S2 | 0.999 | 1.000 | 0.998 | 0.994 | 1.000 |
| S3 | 0.996 | 0.998 | 1.000 | 0.998 | 0.999 |
| S4 | 0.989 | 0.994 | 0.998 | 1.000 | 0.995 |
| R | 0.998 | 1.000 | 0.999 | 0.995 | 1.000 |
3 讨论
本文17批地黄药材有河南、山西两个产地,涵盖了地黄的道地产区和主产区,经检测均符合2015年版《中国药典》要求,具有代表性。由本实验室建立的炮制工艺将17批地黄药材炮制为熟地黄饮片,经检验均符合药典规定。
本文采用HPLC建立了熟地黄饮片、标准汤剂、中间体及配方颗粒的毛蕊花糖苷的含量测定方法,并计算其转移率。结果表明熟地黄饮片、标准汤剂、中间体中毛蕊花糖苷含量基本一致,熟地黄中间体、配方颗粒的出膏率、毛蕊花糖苷转移率均在标准汤剂标准范围之内且与标准汤剂基本一致,说明熟地黄配方颗粒制备工艺合理,符合要求。
本文采用HPLC建立了熟地黄饮片、标准汤剂、中间体及配方颗粒的指纹图谱,并对其相似度进行了评估,可为熟地黄配方颗粒的大生产质量标准建立及全过程质量控制提供参考。
通过采用DAD检测器对熟地黄配方颗粒供试品溶液进行了紫外190~400 nm扫描,通过3D视图和等吸收图谱进行分析,结果显示300 nm下色谱峰信息较全,响应值适中,故选择300 nm作为检测波长。
熟地黄标准汤剂和配方颗粒均为水提取工艺,考察不同溶媒直接超声,结果色谱峰杂峰较多,故考察上大孔吸附树脂除去杂质,分别用20%甲醇,40%甲醇,60%甲醇,80%甲醇洗脱,结果40%甲醇,60%甲醇,80%甲醇均有色谱峰体现,故考察30%甲醇洗脱,调整洗脱程序,结果得到基线平稳、色谱峰信息较多的图谱。为将熟地黄饮片与标准汤剂工艺保持基本一致,将熟地黄饮片进行水煎煮后同标准汤剂处理方法进行制备,结果饮片与标准汤剂指纹图谱基本一致。
通过采用UPLC-Q-TOF-MS分析技术指认了熟地黄配方颗粒中13个化学成分,7个共有峰中指认出5-羟甲基糠醛、毛蕊花糖苷、异毛蕊花糖苷、地黄苷4个成分。通过对熟地黄饮片、标准汤剂、中间体及配方颗粒的指纹图谱进行比较,发现熟地黄饮片指纹图谱中主要色谱峰在标准汤剂、中间体及配方颗粒的指纹图谱中均有体现,且标准汤剂、中间体及配方颗粒的主要色谱峰也均能在饮片指纹图谱中寻到追溯,表明熟地黄饮片、标准汤剂、中间体及配方颗粒具有良好的一致性。

