动脉粥样硬化是多种心脑血管疾病的病理基础[1],近来研究发现,其不仅能造成血管损伤,还能诱发心肌纤维化等心脏本身的改变[2],导致心功能障碍。心肌纤维化以心肌组织I/III型胶原比例升高,胶原纤维数量过量增加等为主要的表现,能够引发心力衰竭、心肌梗死、心源性猝死等多种严重心血管疾病,危及患者生命[3]。随着人口老龄化进程加速以及生活水平提高,心血管疾病患者也迅速增加,成为公共卫生问题,而抑制动脉粥样硬化、延缓和逆转心肌纤维化在心血管疾病的治疗中有重要意义[4]。临床上主要采用调脂、降压、抗炎、血管舒张剂等来进行治疗,治疗效果有限,中医药以其在抗动脉粥样硬化及心肌纤维化方面的独特优势受到广泛关注。有研究认为,中药复方、单味中药、中药提取物等能够通过多靶点、多机制、多途径来影响心肌纤维化过程,控制心血管疾病进展[5-6]。化瘀祛痰方是杨关林教授治疗动脉粥样硬化的自拟经验方,本组前期已经对化痰祛瘀方进行了大量的临床及实验研究[7-10],经多种途径证实了其具有明显的抗动脉粥样硬化的作用,但其机制仍尚未完全清楚。本次研究主要以线粒体融合-裂解功能为切入点,探讨化瘀祛痰方对动脉粥样硬化家兔心肌纤维化的抑制作用及相关机制。
1 材料
1.1 动物
36只SPF级健康雄性家兔,体质量2.0~2.5 kg,购自济南金丰实验动物有限公司,合格证号SCXK(鲁)2014-0006,饲养于辽宁中医药大学实验动物中心。家兔单笼进行适应性饲养,时间为1周,饲养室内温度17~25 ℃,相对湿度60%~75%,定时通风换气,噪音<60 db,昼夜节律为12 h,家兔自由摄食和饮水,定期更换垫料、消毒。实验通过辽宁中医药大学实验动物伦理委员会审查合格,编号为20160704。
1.2 药物
化瘀祛痰方组成:黄芪、党参、绞股蓝、茯苓、石菖蒲、法半夏、川芎、丹参、郁金,药物购自辽宁中医药大学第一附属医院药房,使用时加水浸泡30 min,煎煮2次,之后浓缩为生药质量浓度为0.8,1.6,3.2 g·mL-1的化瘀祛痰方药液,置于-20 ℃冰箱保存备用;辛伐他汀片(杭州默沙东制药有限公司,国药准字H19990366,批号20180321),使用时研碎成粉,采用生理盐水配制成质量浓度为0.28 g·L-1辛伐他汀混悬液,现用现配。
1.3 试剂
兔高脂饲料(1.5%胆固醇,1%胆盐,3%猪油,3%花生油,5%蛋黄粉,加86.5%普通饲料,江苏美迪森生物医药有限公司,批号12017)。家兔总胆固醇(TC),甘油三酯(TG),低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)试剂盒(焦作路非凡生物科技有限公司,批号分别为LFF11072058,LFF-LC-1072,LFF-LC-1076,LFF-LC-274);马松(Masson)染色试剂盒(北京百奥莱博科技有限公司,批号HR8326-HQP);兔抗线粒体融合蛋白1(Mitofusin1)抗体,线粒体融合蛋白2(Mitofusin2)抗体(深圳子科生物科技有限公司,批号分别为zkp0365,BIV-3882-100);兔抗视神经萎缩蛋白1(Opa1)抗体,发动蛋白相关蛋白1(Drp1)抗体,分裂蛋白1(Fis1)抗体(武汉菲恩生物科技有限公司,批号分别为FNab05995,FNab02541,FNab03132);磷酸盐缓冲液(PBS,南京赛泓瑞生物科技有限公司,批号P6503);过氧化物酶(SABC)免疫组化染色试剂盒(上海彩佑实业有限公司,批号I002-2)。
1.4 仪器
HP Sonos-5500型超声诊断仪(美国Hcwlctt Packard公司);TBA-120FR型全自动生化分析仪(日本东芝公司);UNIVERSAL 320R型通用型离心机(德国Hettich公司);DM500型光学显微镜(德国Leica公司)。
2 方法
2.1 造模与给药
适应性饲养结束后,将所有家兔编号,采用随机数字表法分为空白组6只及造模组30只。造模组家兔给予高脂饲料120 g·d-1,空白组家兔给予普通颗粒兔饲料120 g·d-1;8周后,将所有家兔采用3%戊巴比妥钠溶液1 mL·kg-1耳缘静脉注射以进行麻醉,采用HP Sonos-5500型超声诊断仪观察主动脉,若有动脉粥样硬化斑块形成即为动脉粥样硬化模型建立成功[11]。
将造模成功家兔随机分为模型组、辛伐他汀组及化瘀祛痰方低、中、高剂量组,各6只,模型组及空白组分别灌胃给予生理盐水5 mL·kg-1,辛伐他汀组灌胃给予0.28 g·L-1辛伐他汀混悬液5 mL·kg-1,即1.4 mg·kg-1化瘀祛痰方低、中、高剂量组参照文献[9]分别灌胃给予化瘀祛痰方4.0,8.0,16.0 g·kg-1,各组家兔均连续治疗8周。
2.2 标本采集与处理
末次给药后,所有家兔禁食12 h,采集耳中央静脉血液3 mL,室温静置60 min使之凝固,以3 000 r·min-1速度离心10 min,分离得到的血清保存于-20 ℃冰箱内;采用20%乌拉坦5 mL·kg-1腹腔注射以处死家兔,完整摘取心脏,采用预冷的PBS冲洗干净,取左心室心肌组织,4 ℃条件下采用4%甲醛固定24 h,在自动脱水机内用梯度浓度乙醇脱水,之后采用二甲苯透明,常规石蜡包埋,3 μm厚度连续切片,60 ℃烤片1 h后4 ℃保存备用。
2.3 指标检测
2.3.1 酶法检测血脂水平
取出2.2项中制备的血清,4 ℃缓慢融化,按照试剂盒说明书中的步骤,采用TBA-120FR型全自动生化分析仪,通过酶法测定血清TC,TG,LDL-C,HDL-C水平。
2.3.2 Masson染色检测家兔心肌纤维化程度
将取2.2项中制备的心肌组织切片取出,恢复至室温,常规经二甲苯溶液脱蜡、梯度浓度乙醇脱水后,采用蒸馏水冲洗;之后严格根据Masson染色试剂盒说明书中的步骤进行操作,依次采用苏木素溶液、丽春红酸性品红液、苯胺蓝溶液进行染色,之后常规经梯度浓度乙醇脱水、二甲苯透明、中性树胶封片后进行观察。在光学显微镜下观察Masson染色结果,400倍镜下,每张切片随机选取5个不重复的视野,采用Image-Pro Plus Version 6.0图像分析软件测量胶原面积和总视野面积,并根据公式:胶原容积分数(CVF)=胶原面积/总视野面积×100%,计算CVF,取平均值。
2.3.3 免疫组化检测家兔心肌组织Mitofusin1,Mitofusin2,Opa1,Drp1及Fis1蛋白表达水平
将取2.2项中制备的心肌组织切片取出,常规脱蜡、至水;依次采用枸橼酸盐缓冲工作液,98 ℃恒温水浴修复抗原,3%过氧化氢溶液灭活内源性过氧化物酶,Mitofusin1(1∶300),Mitofusin2(1∶300),Opa1(1∶500),Drp1(1∶500)及Fis1(1∶500)一抗工作液孵育切片;然后,按照SABC免疫组化染色试剂盒说明书操作,室温条件下依次采用生物素化二抗(1∶1 000),生物素化二抗、亲和素与生物素化辣根过氧化物酶混合液孵育切片,经显色液显色后,苏木素溶液染核,常规脱水、透明、中性树胶封片。在光学显微镜下观察染色结果,阳性细胞的细胞内存在不同程度的棕黄色颗粒。400倍镜下,每张切片随机选取5个不重复的视野,采用Image-Pro Plus Version 6.0图像分析软件分别测量Mitofusin1,Mitofusin2,Opa1,Drp1及Fis1积分吸光度IA。
2.4 统计学分析
采用SPSS 22.0软件分析数据,符合正态性的计量资料采用
3 结果
3.1 对动脉粥样硬化家兔血清中血脂水平的影响
与空白组比较,模型组家兔血清TC,TG,LDL-C水平显著升高,HDL-C水平显著降低(P<0.01);与模型组比较,化瘀祛痰方低、中、高剂量组及辛伐他汀组家兔血清TC,TG,LDL-C水平显著降低,HDL-C水平显著升高(P<0.01);与化瘀祛痰方高剂量组比较,化瘀祛痰方低、中剂量组家兔血清TC,TG,LDL-C水平较高,HDL-C水平较低,辛伐他汀组家兔血清TC,LDL-C水平较高,TG,HDL-C水平较低(P<0.05,P<0.01)。见表1。
| 组别 | 剂量/g·kg-1 | TC | TG | LDL-C | HDL-C |
|---|---|---|---|---|---|
| 空白 | - | 6.34±0.91 | 1.48±0.43 | 6.11±0.66 | 9.87±1.85 |
| 模型 | - | 67.87±3.502) | 10.18±1.072) | 42.19±3.392) | 1.41±0.622) |
| 化瘀祛痰方 | 16 | 22.22±2.614) | 2.60±0.674) | 20.13±1.074) | 8.69±2.204) |
| 8 | 30.54±2.964,6) | 4.36±0.984,5) | 32.56±5.644,6) | 6.06±0.874,5) | |
| 4 | 32.32±2.674,6) | 5.48±1.074,6) | 26.84±2.544,6) | 4.70±0.764,6) | |
| 辛伐他汀 | 0.001 4 | 34.13±6.264,6) | 1.51±0.104,6) | 37.24±2.454,6) | 4.86±1.234,6) |
3.2 对动脉粥样硬化家兔心肌纤维化程度的影响
Masson染色结果显示,心肌细胞被染成红色,胶原纤维被染成蓝色。空白组胶原沉积极少;模型组心肌间质存在明显的胶原纤维沉积,且呈现条状或网状,排列紊乱;化瘀祛痰方低、中、高剂量组及辛伐他汀组心肌细胞间胶原沉积情况较模型组有不同程度改善,其中化瘀祛痰方高剂量组改善最为明显,见图1。与空白组比较,模型组家兔心肌组织CVF显著升高(P<0.01)。与模型组比较,化瘀祛痰方低、中、高剂量组及辛伐他汀组家兔心肌组织CVF显著降低(P<0.01)。与化瘀祛痰方高剂量组比较,化瘀祛痰方低、中剂量组及辛伐他汀组家兔心肌组织CVF显著升高(P<0.01)。见表2。
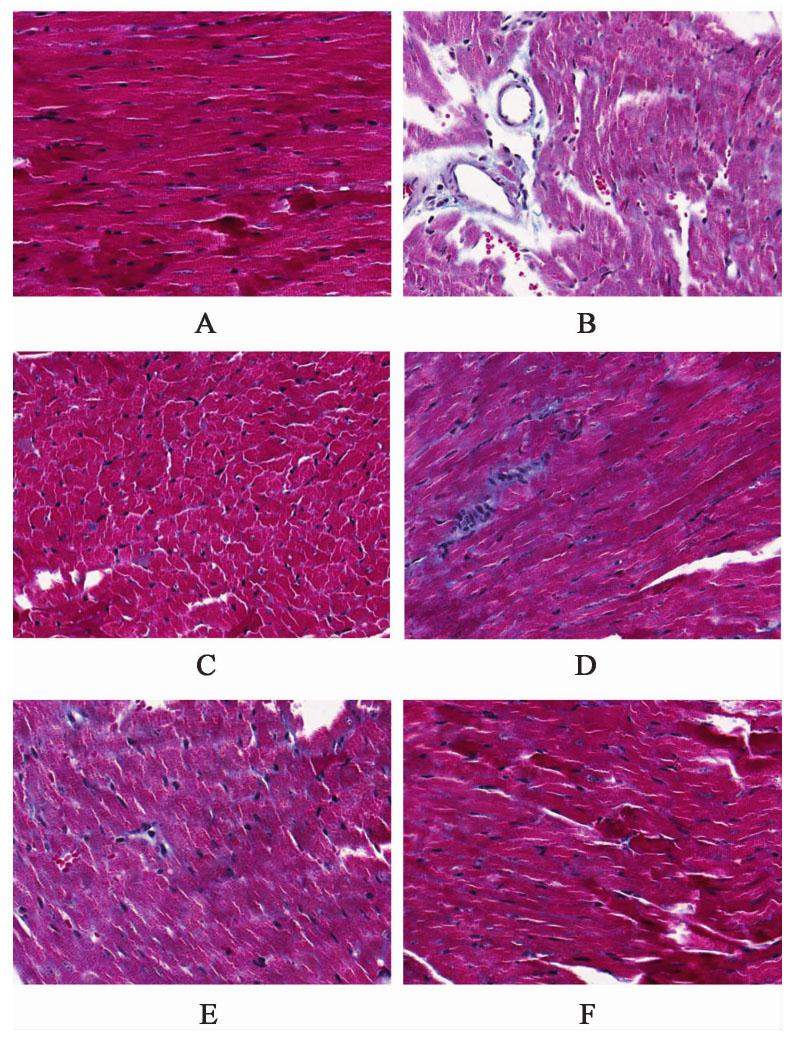
| 组别 | 剂量/g·kg-1 | CVF/% |
|---|---|---|
| 空白 | - | 3.92±0.33 |
| 模型 | - | 8.74±1.052) |
| 化瘀祛痰方 | 16 | 4.71±0.46 |
| 8 | 5.53±0.524,6) | |
| 4 | 6.42±0.614,6) | |
| 辛伐他汀 | 0. 001 4 | 7.17±0.844,6) |
3.3 对动脉粥样硬化家兔心肌组织Mitofusin1,Mitofusin2及Opa1蛋白表达水平的影响
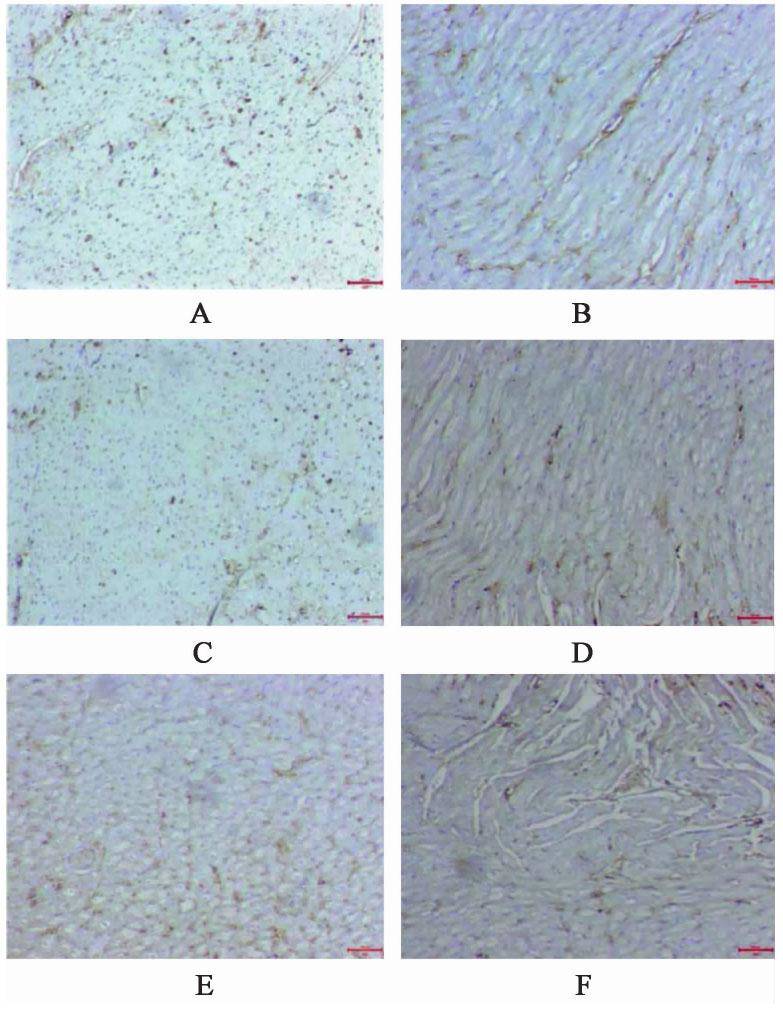
与空白组比较,模型组家兔心肌组织Mitofusin1,Mitofusin2及Opa1蛋白表达水平显著降低(P<0.01);与模型组比较,化瘀祛痰方低、中、高剂量组及辛伐他汀组家兔心肌组织Mitofusin1,Mitofusin2及Opa1蛋白表达水平较高(P<0.01);与化瘀祛痰方高剂量组比较,化瘀祛痰方低、中剂量组及辛伐他汀组家兔心肌组织心肌组织Mitofusin1,Mitofusin2及Opa1蛋白表达水平较低(P<0.01)。见图2,图3,图4,表3。
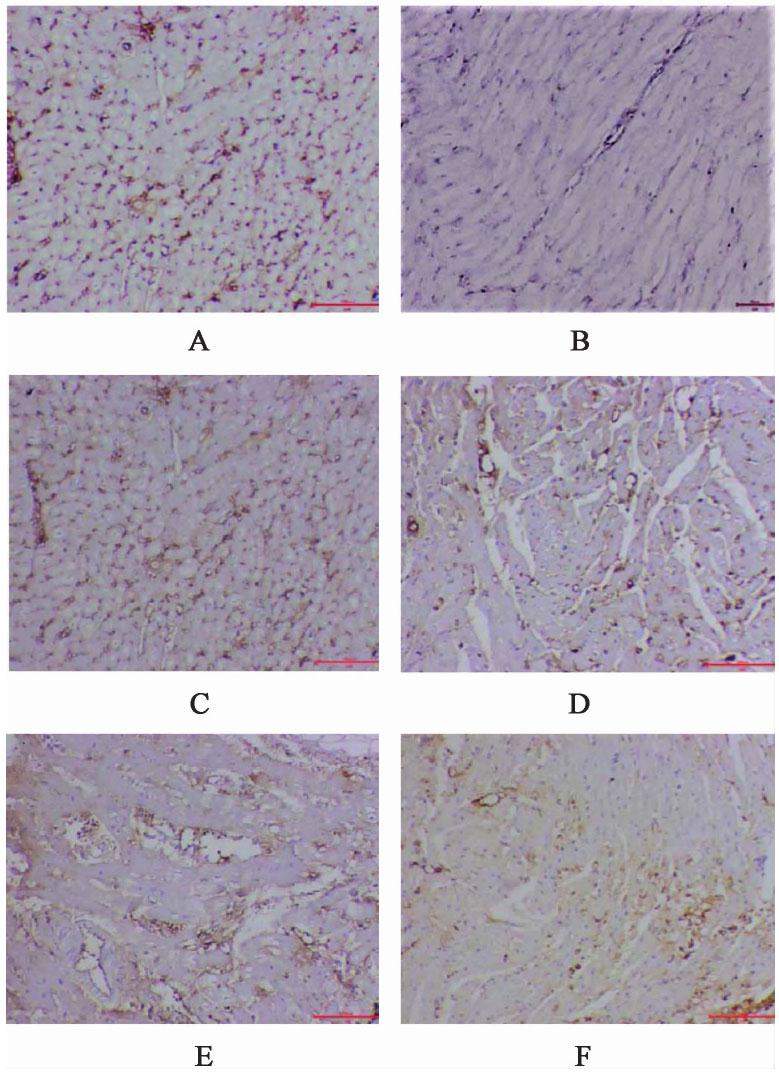
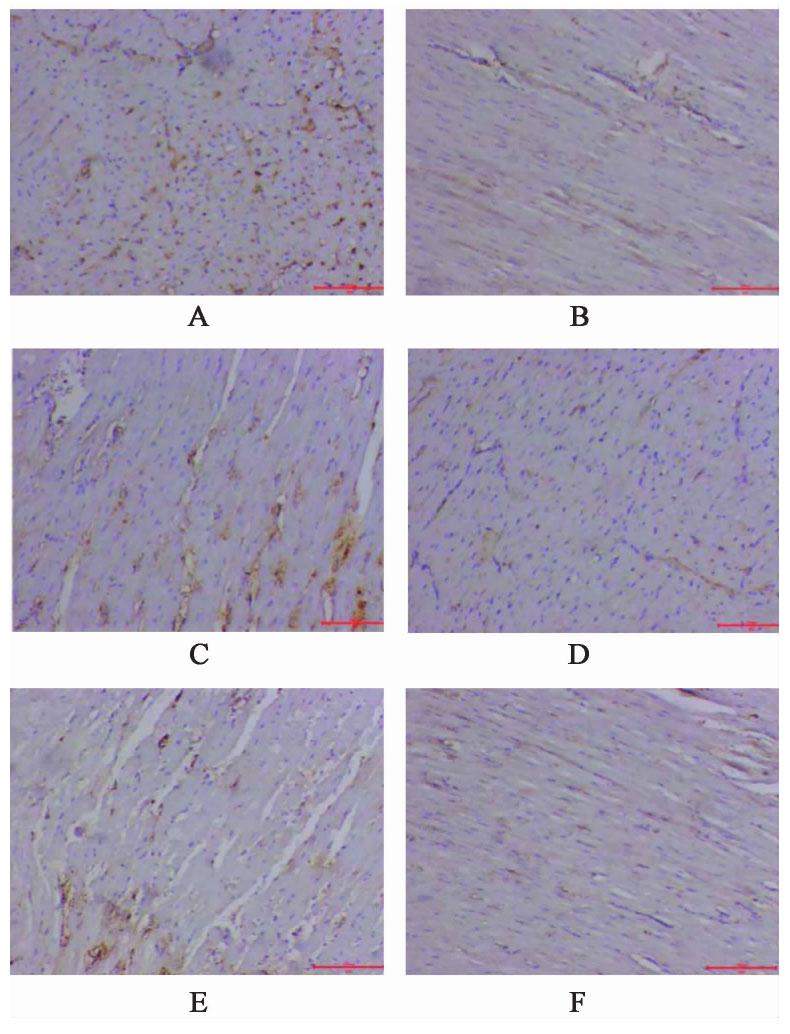
| 组别 | 剂量/g·kg-1 | Mitofusin1 | Mitofusin2 | Opa1 |
|---|---|---|---|---|
| 空白 | - | 0.64±0.08 | 0.59±0.07 | 0.73±0.09 |
| 模型 | - | 0.12±0.012) | 0.14±0.022) | 0.11±0.022) |
| 化瘀祛痰方 | 16 | 0.57±0.074) | 0.51±0.064) | 0.64±0.084) |
| 8 | 0.52±0.054,6) | 0.45±0.064,6) | 0.61±0.074,6) | |
| 4 | 0.44±0.064,6) | 0.38±0.054,6) | 0.53±0.054,6) | |
| 辛伐他汀 | 0.001 4 | 0.22±0.034,6) | 0.20±0.024,6) | 0.27±0.044,6) |
3.4 对动脉粥样硬化家兔心肌组织Drp1,Fis1表达水平的影响
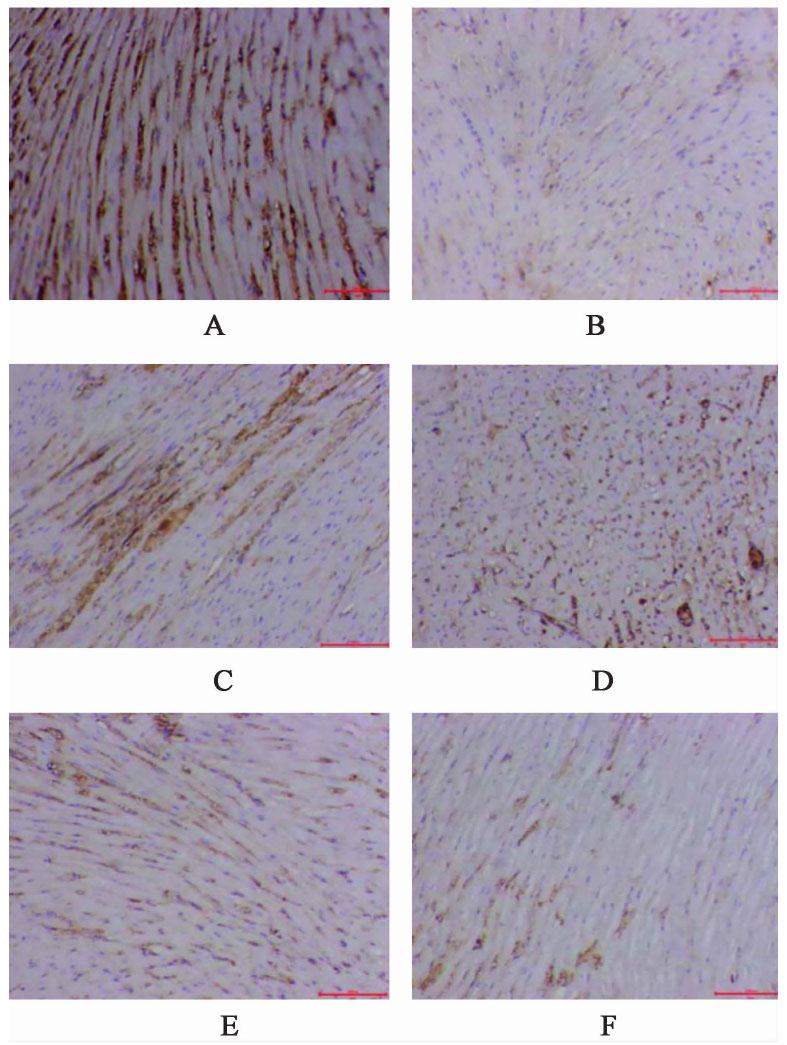
与空白组比较,模型组家兔心肌组织Drp1,Fis1表达水平显著升高(P<0.01);与模型组比较,化瘀祛痰方低、中、高剂量组及辛伐他汀组家兔心肌组织Drp1,Fis1表达水平显著降低(P<0.01);与化瘀祛痰方高剂量组比较,化瘀祛痰方低、中剂量组及辛伐他汀组家兔心肌组织Drp1,Fis1表达水平较高(P<0.01)。见图5,图6,表4。
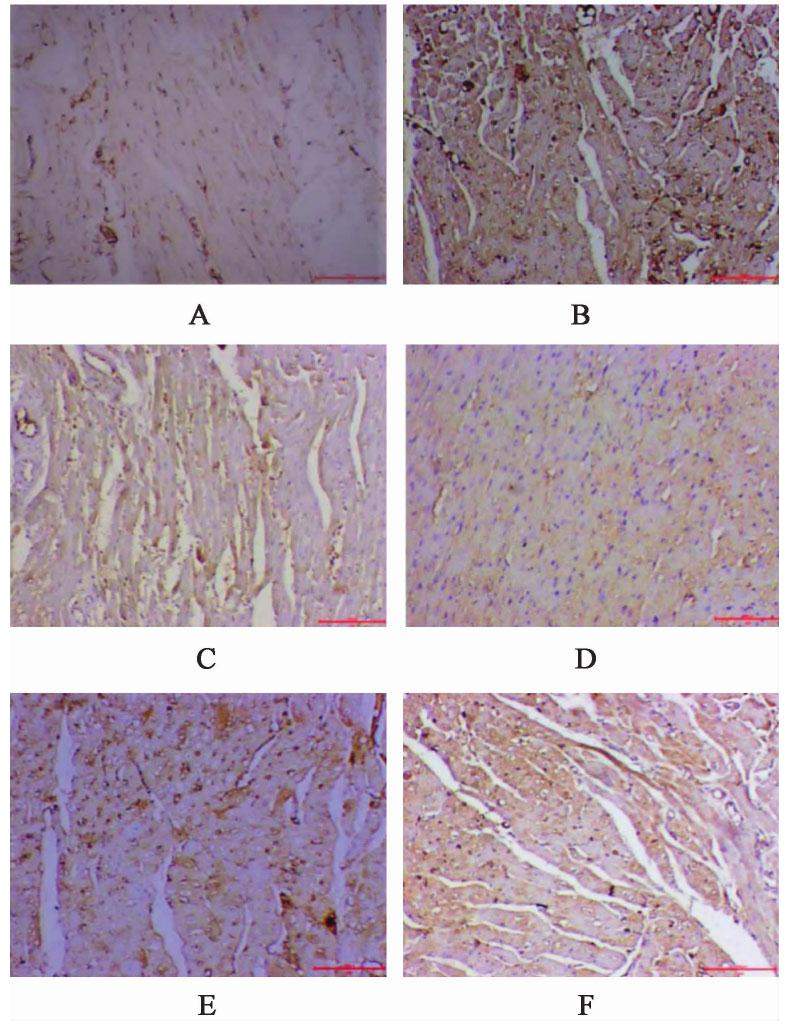
| 组别 | 剂量/g·kg-1 | Drp1 | Fis1 |
|---|---|---|---|
| 空白 | - | 0.15±0.02 | 0.17±0.03 |
| 模型 | - | 0.79±0.082) | 0.73±0.072) |
| 化瘀祛痰方 | 16 | 0.34±0.044) | 0.25±0.034) |
| 8 | 0.57±0.064,6) | 0.54±0.074,6) | |
| 4 | 0.71±0.074,6) | 0.64±0.084,6) | |
| 辛伐他汀 | 0.001 4 | 0.62±0.084,6) | 0.33±0.044,6) |
4 讨论
动脉粥样硬化及其相关的心肌纤维化是心血管疾病防治的主要方向和潜在途径[12]。动脉粥样硬化的发病机制涉及到脂质浸润、血流动力学改变、炎症和免疫反应、氧化应激反应等多种方面,但尚无定论[13]。新近研究发现,线粒体损伤在动脉粥样硬化发生发展中起到重要作用,而同时线粒体融合、分裂相关的功能障碍与心肌损伤、纤维化等关系密切[14-16]。因此改善受损线粒体功能将成为动脉粥样硬化及心血管疾病治疗的新靶点。中医认为,动脉粥样硬化属于“胸痹”“痰证”等范畴,多由脾气亏虚,脏腑功能失调,气、血、津液运行障碍,痰瘀内生,痹阻血脉所致,治疗上应以活血化瘀、益气祛痰为主[17]。
化瘀祛痰方在临床上主要用于痰浊血瘀型动脉粥样硬化患者的治疗,方中黄芪补气固表,党参补中益气、健脾益肺,绞股蓝益气健脾、化痰,三者共为君药,功在益气健脾;臣以茯苓健脾利水渗湿,石菖蒲化湿豁痰,法半夏燥湿化痰,以助君药健旺脾气,并祛除痰邪;川芎、丹参、郁金活血祛瘀,可助血行,全方配伍精当,标本兼治,切中了该病脾气亏虚、痰瘀阻脉的病机[18-19]。
关于化瘀祛痰方抑制动脉粥样硬化心肌纤维化的作用机制,笔者从对线粒体融合-裂解的影响方面进行了探讨。线粒体属于细胞的“能量工厂”,生理情况下通过融合与裂解的动态平衡来维持线粒体正常的形态和功能,线粒体融合能够增强线粒体与内质网的关联性,有助于维持线粒体结果稳定,而线粒体裂解能加速细胞增殖、活性氧簇产生和自噬[20]。有研究发现,线粒体融合-裂解失衡一般以线粒体融合减少而裂解增多为主要表现,与血管内皮细胞损伤有关,并可进一步参与动脉粥样硬化发展[21]。Mitofusin1,Mitofusin2为线粒体外膜蛋白,Opa1为线粒体内膜蛋白,他们分别促进线粒体外膜、内膜的融合;Drp1,Fis1则具有调控线粒体分裂的作用[22]。血管内皮细胞损伤是动脉粥样硬化发生的关键,抑制Drp1,Fis1等表达有助于抑制线粒体分裂至结构破碎、减少ROS产生,保护血管内皮细胞,这提示调节线粒体融合-裂解失衡是治疗血管内皮功能障碍相关动脉粥样硬化的新思路。而上调Mitofusin1,Mitofusin2及Opa1有助于促进线粒体融合,改善线粒体功能,起到保护作用[23-25]。
本次研究中,笔者采用高脂饲料喂养家兔造模,使得家兔血脂水平升高,心肌间质存在明显的胶原纤维沉积,且呈现条状或网状,排列紊乱,心肌组织CVF明显升高,成功建立了动脉粥样硬化伴心肌纤维化模型;采用相应药物治疗后,与模型组比较,各给药组血脂水平均得到明显改善,Masson染色结果也显示心肌纤维化得到不同程度的缓解,其中化瘀祛痰方高剂量组效果最为明显,表明高剂量的化瘀祛痰方能有效调节血脂,消除LDL-C等独立危险因素对于动脉粥样硬化的影响,并且可以明显延缓心肌纤维化,防治心血管疾病进展。研究结果还显示,与模型组比较,各给药组家兔心肌组织Mitofusin1,Mitofusin2,Opa1表达水平较高,Drp1,Fis1表达水平较低,且化瘀祛痰方高剂量组变化最为明显,表明化瘀祛痰方能明显上调心肌组织Mitofusin1,Mitofusin2,Opa1表达,促进线粒体融合,下调Drp1,Fis1表达,抑制线粒体裂解,改善线粒体融合-裂解失衡,这可能是化瘀祛痰方抑制减轻动脉粥样硬化、延缓心肌纤维化的作用机制之一。
综上所述,化瘀祛痰方能有效调节血脂,抑制粥样硬化家兔心肌纤维化,且化瘀祛痰方剂量越高效果越明显,其作用可能与调节心肌细胞线粒体融合-裂解相关蛋白Mitofusin1,Mitofusin2及Opa1,Drp1,Fis1表达有关,但具体的作用机制还需进一步研究明确。

