《中国心血管健康与疾病报告2021》显示,中国居民心血管病患病率居高不下,其中冠心病患者多达1139万[1]。动脉粥样硬化是导致冠心病的重要因素,易损斑块是冠心病发生发展的主要病理基础,而病理性血管新生是易损斑块破裂出血的重要原因之一[2]。病理性新生血管由单层内皮细胞构成,无法分化为成熟的毛细血管,缺乏周细胞和胞外基质的支撑,在缺氧、炎症等诱因下,易于破裂导致斑块内出血,引起急性心肌梗死[3]。研究[4]表明,由于缺氧,动脉硬化斑块中可导致缺氧诱导因子1α(HIF-1α)上调,可激活血管内皮生长因子/血管内皮生长因子受体2(VEGF/VEGFR2)通路,抑制HIF-1α/VEGF/VEGFR2通路可减轻斑块内病理性血管新生。本课题组认为,脾虚可导致气血生化失源,气机推动乏力,气血运行失常,血脉气机壅滞,痰浊瘀血阻于脉道,痰瘀互结则形成“易损斑块”;同时,脾虚则水谷精微难以濡养脉道,血脉失于荣养,新生血管无法分化为成熟的毛细血管网,导致病理性的新生血管[5]。因此认为易损斑块内病理性血管新生的中医根本病因是“脾气虚弱”,基本病机是“痰瘀互结”。心痛泰组方思路源自《黄帝内经》“心受气于脾”,具有健脾理气、行气活血、化痰祛瘀之功。前期研究显示,心痛泰对痰瘀互结型冠心病心绞痛患者具有较好临床疗效[6]。此外,心痛泰可改善血管重构、减轻斑块破裂出血[7-9],亦可改善动脉硬化易损斑块的痰瘀互结证[10]。在前期研究基础上,本研究从HIF-1α/VEGF/VEGFR2通路探讨心痛泰对痰瘀互结证易损斑块内病理血管新生的影响及可能机制,为心痛泰防治易损斑块破裂出血提供分子生物学依据。实验已通过湖南中医药大学动物实验伦理委员会标准审查(伦理批号:ZYFY20160515)。
1 材料与方法
1.1 动物
清洁级雄性日本大耳白兔60只,10~12周龄,体质量(2.13±0.15)kg。购于湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2009-0012,合格证号:湘医动字D20-006号。实验兔单笼饲养,实验动物房温度24~25℃,相对湿度55%~60%。
1.2 药物
心痛泰组方:丹参15 g、川芎10 g、三七10 g、郁金10 g、山楂10 g、枳壳10 g、葛根10 g、木香5 g,生药质量共80 g,此为70 kg成人每日的给药剂量。中药饮片由湖南中医药大学第一附属医院药剂科提供,将两次煎剂(200 ml)混合均匀、浓缩至浓度为0.4 g·ml-1的浓缩药液。氟伐他汀钠缓释片(北京诺华制药有限公司,国药准字号:H20090179)。
1.3 主要试剂及仪器
戊巴比妥钠(上海化学试剂厂,批号:57-33-0);青霉素(成都倍特药业股份有限公司,批号:H13021731);放射免疫沉淀(RIPA)细胞裂解液(北京普利莱基因技术有限公司,批号:C1053);ECL超敏发光液(赛默飞世尔科技公司,批号:RJ239676);HIF-1α、VEGF、VEGFR2、血管生成素2(Ang-2)、成纤维细胞生长因子(FGF)试剂盒(均购于武汉博士德生物工程有限公司,批号依次为:MK1201、EK0541、EK0590、EK0938、EK1172);HIF-1α、VEGF、VEGFR2、Ang-2、FGF抗体(均购于北京博奥森生物技术有限公司,批号依次为:bs-0737R、bs-34032R、bs-2089R、bs-0677R、bsm-34016R);GAPDH(武汉博士德生物工程有限公司,批号:BM1623);辣根过氧化物酶标记山羊抗兔二抗(批号:ZB2306)、苏木素染液(批号:ZLI-9610),北京中杉金桥生物技术有限公司;伊红染色液(批号:G1100)、Scott蓝化液(批号:G1865),北京索莱宝科技有限公司。高脂饲料由15%蛋黄粉、2%胆固醇、5%猪油、78%基础饲料组成,由湖南中医药大学第一附属医院医学创新实验中心制备。
光学显微镜(日本Nikon公司,型号:E100);旋涡振荡器(江苏天翎仪器有限公司,型号:DMT-2500);组织匀浆机(上海沪析实业有限公司,型号:HM-24);低温全自动脱帽冷冻离心机(长沙湘锐离心机有限公司,型号:TDL4-T);全自动酶标仪(北京六一生物科技有限公司,型号:WD-2102B);蛋白垂直电泳仪(北京市六一仪器厂,型号:DYY-6C);切片机(Reichert公司,型号:820 Histo Stat);医学图像分析系统(南京奥康仪器分析有限公司,版本号:MIAS-300);便携式小动物B超机(徐州市凯尔生物科技有限公司,型号:KR-1088Z);动脉扩张球囊(内径3.0 mm)、球囊扩张压力泵、动脉置管导管(长度20 mm)、动脉置管导丝(0.018/300 cm),美国Cordis公司。
1.4 动物造模、分组及干预方法
所有实验兔适应性喂养1周,按随机数字表法抽取10只兔子作为假手术组,其余兔子用来造模设为造模组。采用高脂饲料喂养+腹主动脉球囊损伤法造成痰瘀互结证易损斑块模型[11-12]:先高脂喂养2周,再在超声引导下行腹主动脉球囊拉伤。球囊损伤内膜的方法如下:兔取仰卧位固定于手术台,戊巴比妥钠(30mg·kg-1)耳缘静脉注射麻醉,备皮、消毒,行右股动脉穿刺术,穿刺见鲜红色搏动的动脉血后,立即送入导丝,助手持便携式超声机进行引导和定位,将球囊导管沿右侧股动脉上行入置腹主动脉,将球囊打气(7.5 kPa)后固定于腹主动脉中段。随后在超声机引导下,将充盈的球囊牵拉至右髂总动脉分叉处,反复回拉3次后退出导管。常规缝合并消毒,术后青霉素40万U肌肉注射,连续3天,以预防伤口感染。继续高脂喂养4周。造模组兔按照随机数字表法抽取2只进行模型评价,肉眼可见腹主动脉斑块、HE染色提示易损斑块,以及痰瘀互结证候积分较假手术组明显升高,差异有统计学意义,则提示痰瘀互结证易损斑块模型成功[10]。假手术组给予普通饲料,只进行右侧股动脉穿刺、送入导丝,但不置入球囊拉伤。
将造模成功的兔按随机数字表法分为模型组、氟伐他汀组和心痛泰低、中、高剂量组,每组10只。根据《药理实验方法学》[13]的方法,取70 kg成人每日剂量作为心痛泰中剂量组的每日灌胃剂量,计算得出心痛泰低、中、高剂量组的给药量分别是1.87、3.73、7.46 g/(kg·d),氟伐他汀组的给药量为1.87 mg/(kg·d),假手术组和模型组给予10 ml/d超纯水灌胃。各组均每日灌胃1次,连续8周。
1.5 观察指标及方法
1.5.1 腹主动脉组织病理学形态观察
给药结束24 h后,各组兔予以100 mg/kg戊巴比妥静脉注射处死,取球囊损伤段(包含斑块)的腹主动脉约2.5~4.0 cm,生理盐水冲洗掉表面血渍,放入含有10%甲醛的玻璃瓶中固定,酒精脱水,10%甲醛甲酸脱钙液脱钙,切片(厚度4~5 μm),石蜡切片60 ℃烘烤30 min,常规二甲苯、乙醇脱蜡至水,苏木素染色10 min,流动清水冲洗,0.7%盐酸乙醇化5~6 s,冲洗,酒精性伊红染色30 s,乙醇梯度脱水,石炭酸二甲苯30 s,中性树胶封片。光学显微镜下采用横切图和纵切图全面观察主动脉组织及斑块的结构。
1.5.2 斑块成分及易损指数
取主动脉斑块明显处血管段2 cm,浸泡于10%中性甲醛中固定,一部分组织留取冰冻切片,进行油红O染色测定细胞外脂质含量;一部分组织制成石蜡切片,行Masson法对胶原成分进行染色;另一部分组织用免疫组化法测定CD68阳性的泡沫细胞以及α平滑肌肌动蛋白(SMA-α)阳性的平滑肌细胞。400倍光镜下,每张切片至少选取5个视野拍照以覆盖斑块,取其均值。采用MIAS-300医学图像分析系统,测定斑块内阳性染色的细胞外脂质、泡沫细胞、胶原成分、平滑肌细胞各占所在斑块面积的百分比。斑块易损指数=(细胞外脂质百分比+泡沫细胞百分比)/(平滑肌细胞百分比+胶原纤维百分比)。
1.5.3 痰瘀互结证中医证候评分
采用课题组前期拟定及证实的痰瘀互结证中医证候评分量表[10]进行中医证候的评价。包括精神、食水、毛发、粪便、舌象、眼部、皮肤7项,各项分值均为0~3分,每一项总分相加为痰瘀互结证总分,分值越高提示痰瘀互结证越严重。
1.5.4 免疫组化法测定腹主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF表达
取球囊损伤段有易损斑块的主动脉组织,石蜡切片、脱蜡至水,缓冲液及3%H2O2室温孵育10 min,PBS冲洗每次5 min,共3次,滴加一抗(1∶100稀释)、PBS冲洗每次2 min,共3次,滴加二抗(1∶200稀释),37 ℃孵育30 min,PBS冲洗,加ABC复合物、室温2 h,0.03% DAB显色,蒸馏水冲洗,苏木素复染细胞核,分化、返蓝,酒精梯度浓度脱水,常规二甲苯透明,中性树胶制片,400倍光学显微镜观察。每只兔取包含有易损斑块的主动脉内膜组织的切片3张,在MIAS-300医学图像分析系统下,分析染色阳性产物的IOD值。
1.5.5 Westernblot法测定腹主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF蛋白表达
将球囊损伤段含有斑块的腹主动脉组织,PBS冲洗,剪小,磨碎成匀浆,加入RIPA裂解液,置于离心机(4 ℃ 、12 000 g)离心、取上清液,酶标板计算样品蛋白浓度,上样、电泳分离、25 V转膜30 min,室温状态下封闭,加入一抗(均为1∶1000),孵育过夜,TBST洗涤,按照1∶1000比例加入HRP标记的二抗,与膜37 ℃孵育1 h,TBST洗涤,ECL超敏发光液检测显影、曝光,扫描蛋白条带,用Gel Image ststem ver 4.0软件分析。
1.6 统计学方法
使用SPSS 23.0进行数据处理。计量数据均符合正态分布以(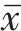
2 结果
实验过程中,假手术组死亡1只,模型组和心痛泰高剂量组各死亡3只,心痛泰低、中剂量组及氟伐他汀组各死亡2只。
2.1 各组兔主动脉组织HE染色情况
图1、图2示,假手术组内皮细胞和平滑肌细胞排列整齐,管壁完整,无斑块形成;模型组可见动脉弹力层破坏,内膜下有明显的泡沫细胞,管壁结构破坏,斑块纤维帽破裂。与模型组比较,心痛泰各剂量组和氟伐他汀组斑块组织处的空泡化明显减轻,动脉内膜和斑块的结构更加稳定。与心痛泰低剂量组比较,心痛泰中、高剂量组和氟伐他汀组斑块面积明显缩小,结构更加稳定,内膜下泡沫细胞明显减少。
grid ="1;2;" source = "paralayout"图1各组兔腹主动脉斑块病理形态纵切图(HE染色,×400)
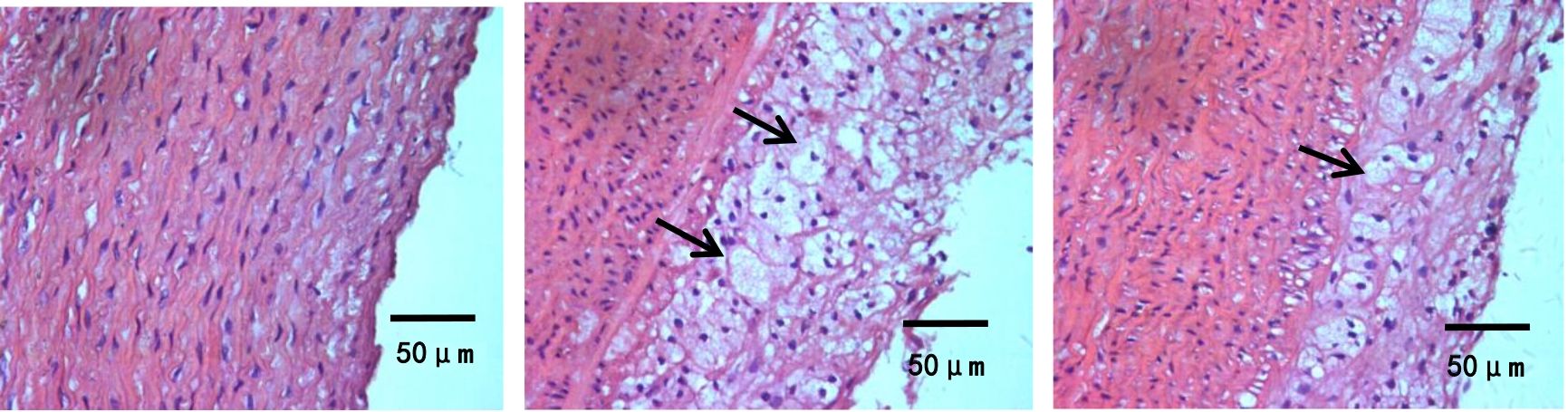
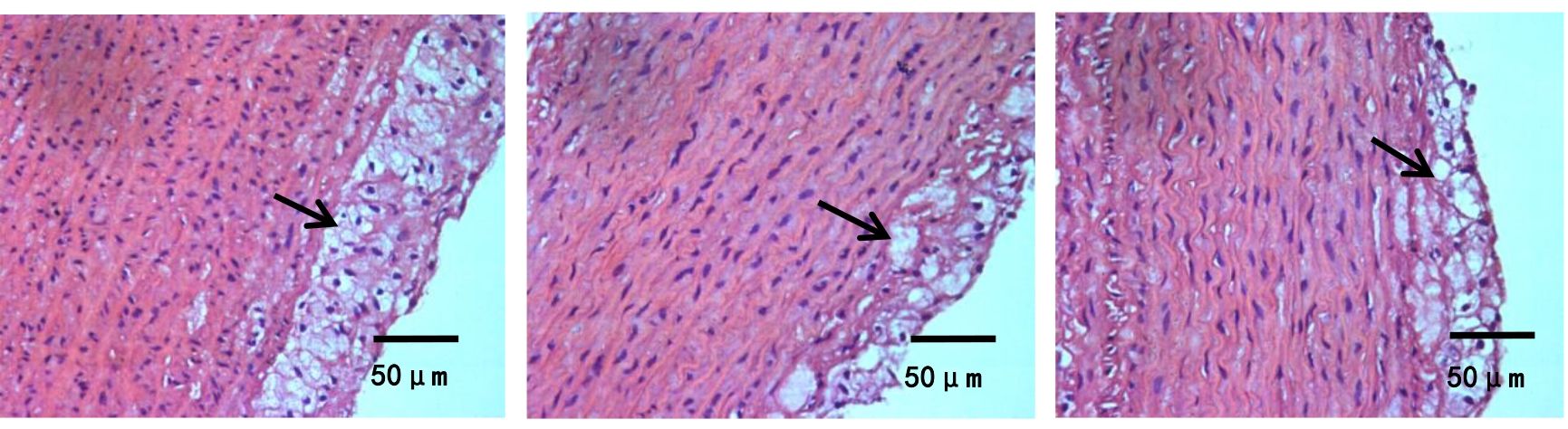
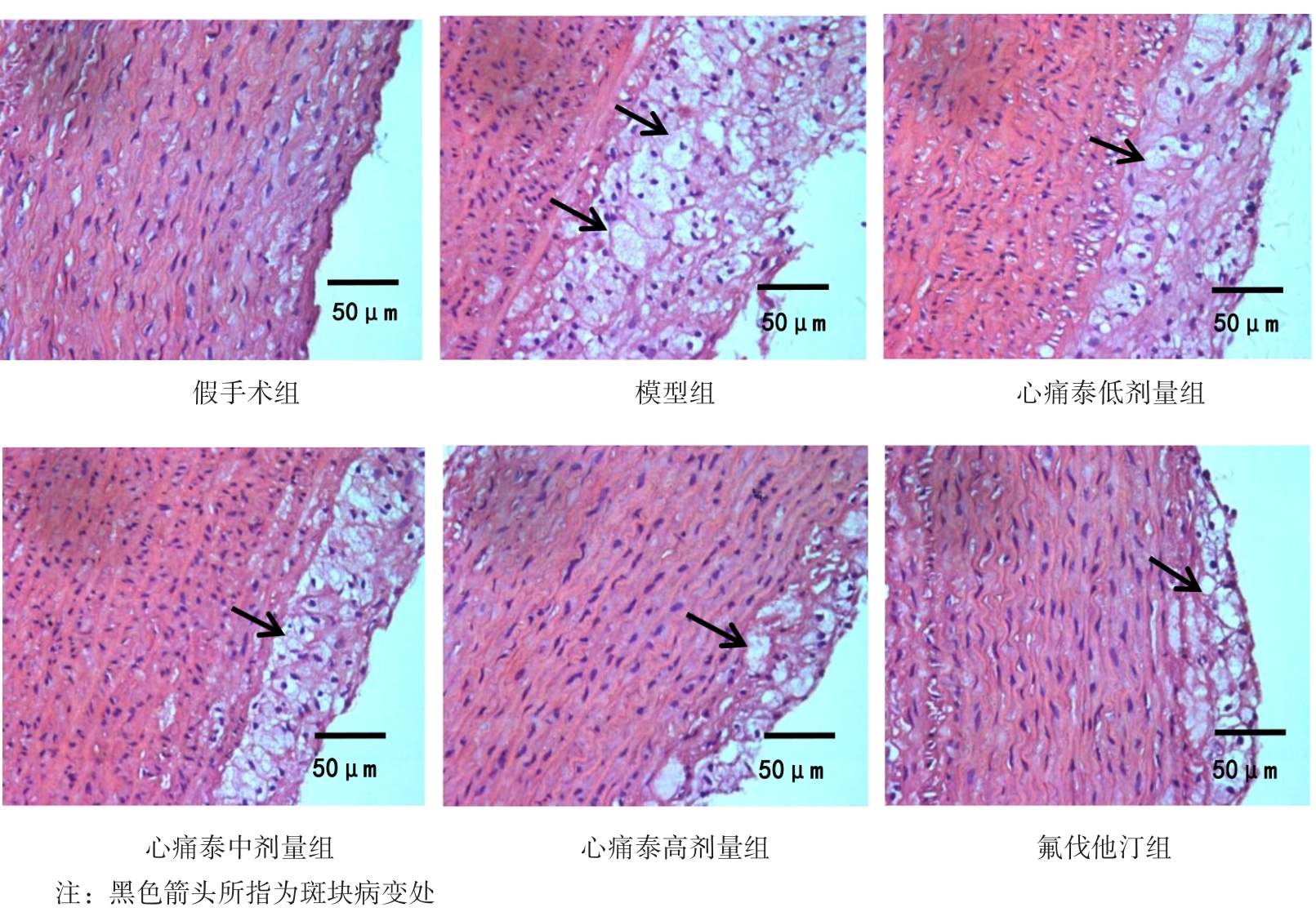
各组兔腹主动脉斑块病理形态横切图(HE染色,×400)
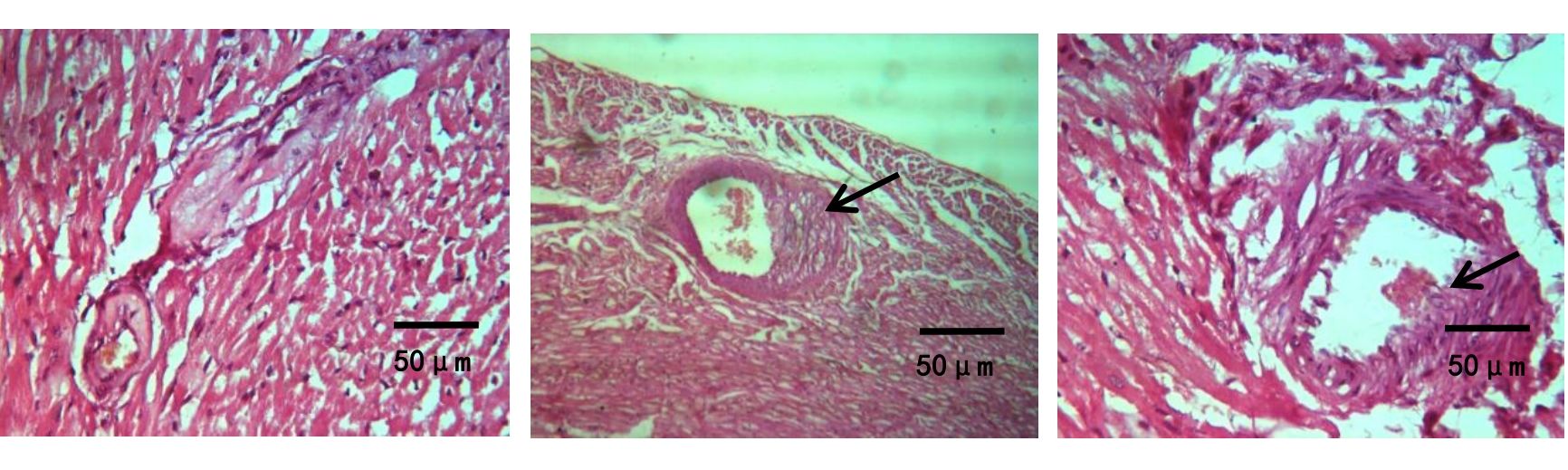
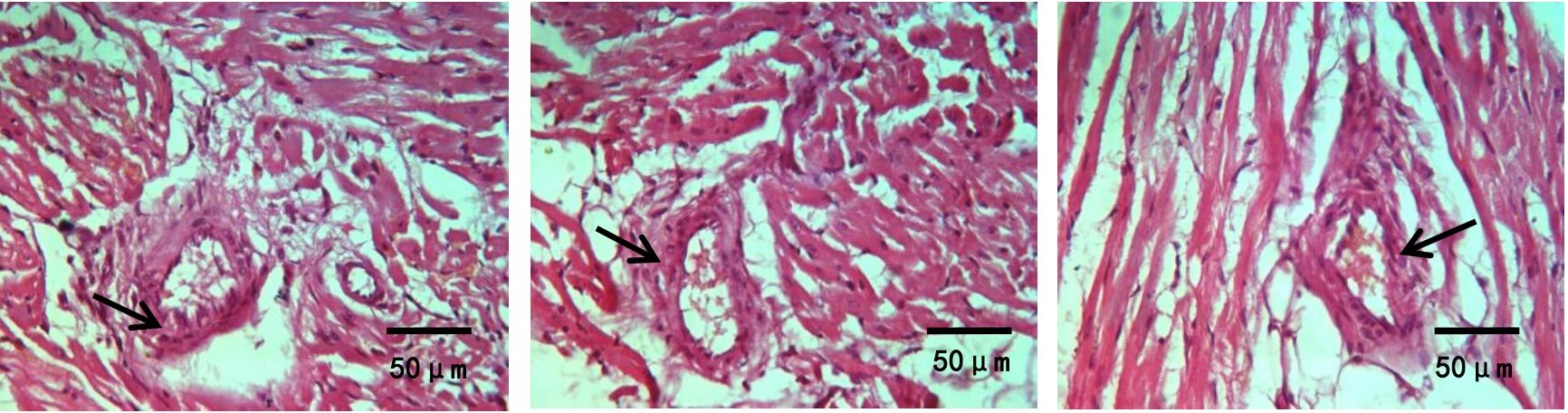

2.2 各组兔易损斑块成分及斑块易损指数比较
假手术组兔未见到斑块。表1示,与模型组比较,心痛泰各组剂量和氟伐他汀组细胞外脂质、泡沫细胞百分比降低,胶原成分、平滑肌细胞百分比增加,斑块易损指数降低(P<0.05或P<0.01);与心痛泰低剂量组比较,心痛泰中、高剂量组和氟伐他汀组细胞外脂质、泡沫细胞百分比明显降低,胶原成分、平滑肌细胞百分比明显增加,斑块易损指数明显降低(P<0.01)。心痛泰中、高剂量组和氟伐他汀组组间两两比较各指标差异无统计学意义(P>0.05)。
| 组别 | 兔数 | 细胞外脂质/% | 泡沫细胞/% | 胶原成分/% | 平滑肌细胞/% | 斑块易损指数 |
|---|---|---|---|---|---|---|
| 假手术组 | 9 | — | — | — | — | — |
| 模型组 | 7 | 23.642±7.285 | 38.451±9.623 | 7.916±2.324 | 18.523±5.417 | 2.349±0.685 |
| 心痛泰低剂量组 | 8 | 19.273±6.241a) | 32.634±8.125a) | 12.384±4.563a) | 21.492±7.123a) | 1.532±0.463a) |
| 心痛泰中剂量组 | 8 | 13.429±4.832b)c) | 22.593±6.547b)c) | 18.926±6.152b)c) | 25.248±8.725b)c) | 0.815±0.378b)c) |
| 心痛泰高剂量组 | 7 | 12.351±4.574b)c) | 21.485±5.426b)c) | 19.375±6.818b)c) | 26.321±8.941b)c) | 0.740±0.363b)c) |
| 氟伐他汀组 | 8 | 11.028±4.269b)c) | 20.562±4.935b)c) | 19.834±7.016b)c) | 26.455±8.972b)c) | 0.682±0.314b)c) |
2.3 各组兔痰瘀互结证中医证候评分比较
表2示,与假手术组比较,模型组兔子各证候评分及总积分明显升高(P<0.01);与模型组比较,心痛泰各剂量组和氟伐他汀组各证候评分及总积分下降(P<0.05或P<0.01);与心痛泰低剂量组比较,心痛泰中、高剂量组和氟伐他汀组各证候评分及总积分明显降低(P<0.01)。
| 组别 | 兔数 | 精神 | 食水 | 毛发 | 粪便 |
|---|---|---|---|---|---|
| 假手术组 | 9 | 0 | 0 | 0 | 0 |
| 模型组 | 7 | 2.53±0.95a) | 2.28±0.72a) | 1.74±0.68a) | 1.56±0.62a) |
| 心痛泰低剂量组 | 8 | 2.17±0.86b) | 1.93±0.75b) | 1.31±0.62b) | 1.18±0.43b) |
| 心痛泰中剂量组 | 8 | 1.63±0.54c)d) | 1.58±0.48c)d) | 0.94±0.35c)d) | 0.66±0.29c)d) |
| 心痛泰高剂量组 | 7 | 1.72±0.56c)d) | 1.46±0.60c)d) | 0.83±0.45c)d) | 0.57±0.24c)d) |
| 氟伐他汀组 | 8 | 1.75±0.88c)d) | 1.34±0.63c)d) | 0.86±0.49c)d) | 0.55±0.21c)d) |
| 组别 | 兔数 | 舌象 | 眼部 | 皮肤 | 总积分 |
| 假手术组 | 9 | 0 | 0 | 0 | 0 |
| 模型组 | 7 | 2.33±0.87a) | 2.05±0.76a) | 2.45±0.91a) | 14.94±1.81a) |
| 心痛泰低剂量组 | 8 | 1.82±0.55b) | 1.63±0.39b) | 1.85±0.64b) | 11.89±1.67b) |
| 心痛泰中剂量组 | 8 | 1.35±0.47c)d) | 1.14±0.52c)d) | 1.23±0.71c)d) | 8.53±1.32c)d) |
| 心痛泰高剂量组 | 7 | 1.19±0.68c)d) | 0.98±0.41c)d) | 1.10±0.65c)d) | 7.85±1.46c)d) |
| 氟伐他汀组 | 8 | 1.13±0.62c)d) | 0.96±0.37c)d) | 1.15±0.70c)d) | 7.74±1.52c)d) |
2.4 各组兔主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF表达免疫组化检测结果比较
各组兔主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF表达免疫组化染色结果见附图(请扫描本文二维码获取)。表3示,与假手术组比较,模型组兔主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF免疫组化阳性表达均明显增多(P<0.01);与模型组比较,心痛泰各剂量组和氟伐他汀组HIF-1α、VEGF、VEGFR2、Ang-2、FGF阳性表达均减少(P<0.05或P<0.01);与心痛泰低剂量组比较,心痛泰中、高剂量组和氟伐他汀组HIF-1α、VEGF、VEGFR2、Ang-2、FGF的阳性表达均明显减少(P<0.01)。
| 组别 | 鼠数 | HIF-1α | VEGF | VEGFR2 | Ang-2 | FGF |
|---|---|---|---|---|---|---|
| 假手术组 | 9 | 0.527±0.214 | 0.165±0.082 | 0.143±0.064 | 0.159±0.072 | 0.245±0.103 |
| 模型组 | 7 | 0.842±0.351a) | 0.749±0.294a) | 0.652±0.247a) | 0.853±0.395a) | 0.632±0.245a) |
| 心痛泰低剂量组 | 8 | 0.714±0.326b) | 0.628±0.232b) | 0.549±0.225b) | 0.726±0.329b) | 0.478±0.217b) |
| 心痛泰中剂量组 | 8 | 0.581±0.245c)d) | 0.543±0.215c)d) | 0.476±0.193c)d) | 0.534±0.213c)d) | 0.384±0.153c)d) |
| 心痛泰高剂量组 | 7 | 0.563±0.232c)d) | 0.514±0.212c)d) | 0.453 ±0.186c)d) | 0.472±0.194c)d) | 0.353±0.142c)d) |
| 氟伐他汀组 | 8 | 0.528±0.217c)d) | 0.465±0.183c)d) | 0.437 ±0.165c)d) | 0.438±0.186c)d) | 0.361±0.139c)d) |
2.5 各组兔主动脉斑块组织HIF-1α、VEGF、VEGFR2蛋白定量比较
表4示,与假手术组比较,模型组兔主动脉斑块组织HIF-1α、VEGF、VEGFR2、Ang-2、FGF蛋白表达明显升高(P<0.01);与模型组比较,心痛泰各剂量组和氟伐他汀组HIF-1α、VEGF、VEGFR2、Ang-2、FGF蛋白表达降低(P<0.05或P<0.01);与心痛泰低剂量组比较,心痛泰中、高剂量组和氟伐他汀组HIF-1α、VEGF、VEGFR2、Ang-2、FGF蛋白表达显著降低(P<0.01)。各组兔腹主动脉斑块组织中HIF-1α、VEGF、VEGFR2、Ang-2、FGF蛋白电泳图见图3。
| 组别 | 兔数 | HIF-1α | VEGF | VEGFR2 | Ang-2 | FGF |
|---|---|---|---|---|---|---|
| 假手术组 | 9 | 0.325±0.042 | 0.264±0.035 | 0.138±0.029 | 0.125±0.012 | 0.063±0.018 |
| 模型组 | 7 | 0.973±0.128a) | 0.852±0.094a) | 0.614±0.105a) | 0.532±0.094a) | 0.275±0.039a) |
| 心痛泰低剂量组 | 8 | 0.746±0.095b) | 0.633±0.065b) | 0.527±0.074b) | 0.465±0.172b) | 0.143±0.047b) |
| 心痛泰中剂量组 | 8 | 0.532±0.086c)d) | 0.429±0.057c)d) | 0.432±0.063c)d) | 0.341±0.118c)d) | 0.085±0.026c)d) |
| 心痛泰高剂量组 | 7 | 0.483±0.082c)d) | 0.431±0.072c)d) | 0.416±0.095c)d) | 0.316±0.087c)d) | 0.082±0.025c)d) |
| 氟伐他汀组 | 8 | 0.469±0.054c)d) | 0.395±0.043c)d) | 0.324±0.082c)d) | 0.258±0.055c)d) | 0.076±0.023c)d) |
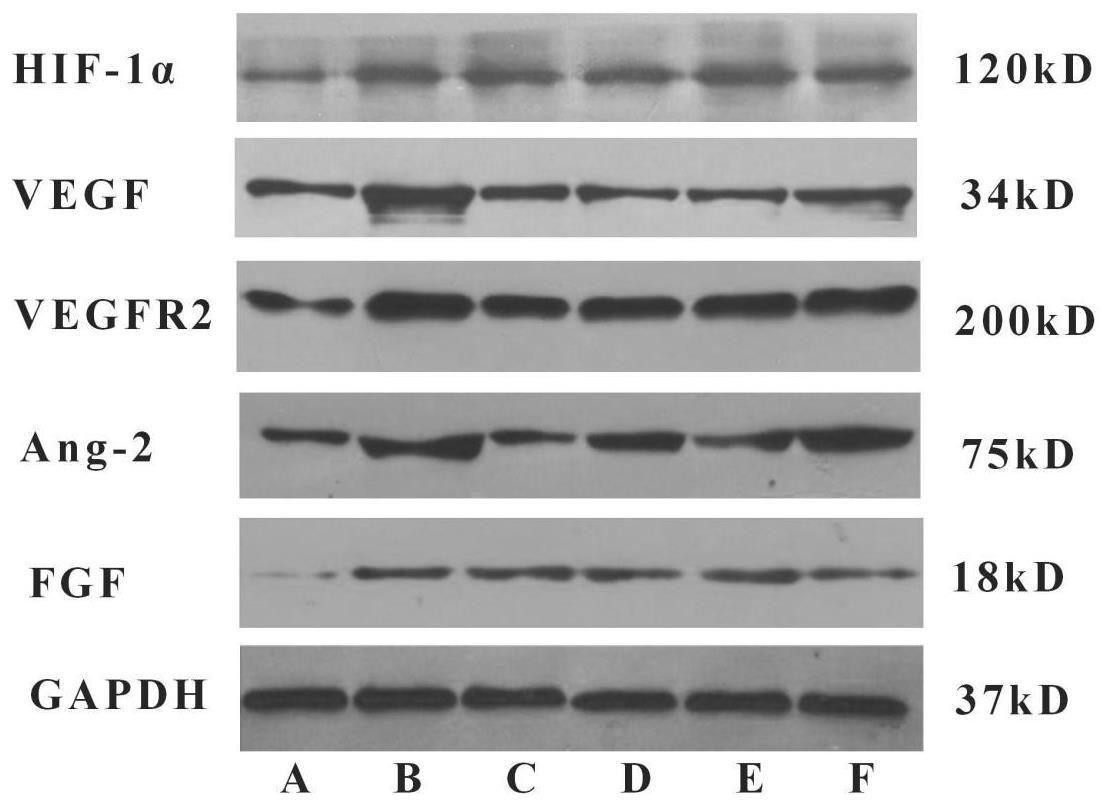
3 讨论
易损斑块破裂出血是导致急性心肌梗死的主要病理基础。斑块内由于存在缺氧、炎症、氧化应激等刺激,其所形成的新生血管内皮细胞不稳定、通透性高,并且缺乏周细胞、平滑肌细胞、胞外基质等支撑,容易破裂出血,属于病理性新生血管[14]。易损斑块中的病理性新生血管位于斑块纤维帽内侧,病理性新生血管极其不稳定,破裂后造成斑块内出血,加速了纤维帽的易损性,一旦纤维帽不稳定、出现破口,斑块内出血性物质(红细胞、血红蛋白、血浆等)释放至血管内,可导致动脉的急性闭塞[15]。《素问·玉机真藏论篇》记载:“心受气于脾,传之于肺,气舍于肝,至肾而死。”脾虚生痰,心为脾之母,子盗母气,脾病及心,脾之病可逆传累及心,导致痰浊瘀阻于心。研究[16]认为,脾虚生痰是痰瘀互结病机的根源,脾虚则气血生化无源,水谷精微难以化生为有形之血,新生血管不能朝成熟的血管网转化;脾气虚弱失于固摄,气不摄血、血溢脉外,导致血瘀。心痛泰可助脾运气,助心行血,具有运脾理气、化痰消瘀之功。方中丹参、川芎共为君药,具有活血化瘀之功效;枳壳、木香、葛根为佐,理气宽中,升清降浊,推动气机运行,有助痰浊消退;郁金、三七为使,行气解郁、祛瘀生新,山楂健脾开胃、行气散瘀。全方从健脾、理气、行气、化痰、活血、化瘀六个方面,兼顾心脾二脏,从脾治心,共奏健脾理气、行气活血、化痰祛瘀之功,体现了“心受气于脾”理论指导下组方的意义。本研究结果显示,模型组兔痰瘀互结证各证候评分及总积分均较假手术组升高,而心痛泰各剂量组和氟伐他汀组均较模型组降低,且心痛泰中、高剂量组和氟伐他汀组效果优于心痛泰低剂量组,证明心痛泰治疗痰瘀证易损斑块的肯定性。
HIF-1α/VEGF/VEGFR2信号通路与斑块内病理性血管新生密切相关。HIF-1α是缺氧诱导因子,缺氧状态下,HIF-1α的激活可上调VEGF的表达,导致斑块内病理性血管新生,从而促进易损斑块破裂[17]。VEGF是血管内皮生长因子,可促进血浆酶原活化因子(PA)和血浆酶原活化因子抑制因子l(PAI-1)过表达,导致血管通透性增加[18]。血管内皮生长因子受体(VEGFRs)分为VEGFR1、VEGFR2、VEGFR3,VEGFR2主要表达于血管内皮细胞表面和相应的胚胎前体细胞,VEGF通过VEGFR2的磷酸化作用激活下游信号分子,导致血管内皮细胞增殖和迁移,激活一氧化氮合酶(eNOS),导致血管通透性增加,所以VEGFR2过表达可促进机体“病理性血管新生”的过程[19]。研究表明,在小鼠动脉硬化斑块模型中,斑块局部应用血管内皮生长因子可增加斑块内病理性血管新生,阻断VEGFR2可显著减少44%的斑块内出血,减少斑块内80%的红细胞外渗,体内阻断VEGFR2可使胶原纤维增加54%,平滑肌细胞含量增加123%,使得斑块更加稳定[20]。Ang-1增加内皮细胞与周细胞以及血管平滑肌细胞之间的稳定性,刺激新生血管的成熟[21]。而Ang-2则降低周细胞的连接间隙,导致血管稳定性降低,促进病理性血管新生[22-23]。
本研究结果显示,模型组兔出现了明显的易损斑块,细胞外脂质和泡沫细胞增加,胶原成分和平滑肌细胞减少,斑块易损指数显著增加,模型组的HIF-1α、VEGF、VEGFR2、Ang-2、FGF免疫组化阳性和蛋白表达增加,说明易损斑块内病理性血管新生与HIF-1α/VEGF/VEGFR2通路激活有关。各剂量心痛泰、氟伐他汀干预后,细胞外脂质和泡沫细胞减少,胶原成分和平滑肌细胞增加,斑块易损指数显著降低,斑块组织内HIF-1α、VEGF、VEGFR2、Ang-2、FGF的免疫组化阳性和蛋白表达均降低,且心痛泰中、高剂量组及氟伐他汀组的效果优于心痛泰低剂量组。
综上,心痛泰可能通过抑制HIF-1α/VEGF/VEGFR2通路,减轻易损斑块内病理性血管新生,稳定易损斑块,改善痰瘀互结证。但本研究存在一定的局限性,缺少心痛泰干预血管内皮细胞实验的研究。我们下一步将通过细胞实验继续探索心痛泰对易损斑块中内皮细胞的病理改变、超微结构、成管功能等方面的影响,并且将进一步完善与细化中医证候积分评价体系,以期为心痛泰稳定易损斑块、治疗痰瘀互结证提供更深层次的实验依据。
Angiogenesis in the atherosclerotic plaque
[J].Redox Biology,2017,12:18-34.doi: 10.1016/j.redox. 2017. 01.007.易琼,彭清华,郭志华等.心痛泰对痰瘀互结证腹主动脉易损斑块模型兔病理性血管新生及HIF-1α/VEGF/VEGFR2信号通路的影响[J].中医杂志,2023,64(02):159-166.
YI Qiong,PENG Qinghua,GUO Zhihua,et al.Effects of Xintongtai (心痛泰) on Pathological Angiogenesis and HIF-1α/VEGF/VEGFR2 Signaling Pathway in Abdominal Aortic Vulnerable Plaque Model Rabbits with Binding of Phlegm and Stasis Syndrome[J].Journal of Traditional Chinese Medicine,2023,64(02):159-166.

