脊髓损伤(spinal cord injury,SCI)是一种中枢神经严重受损的疾病,目前尚缺乏有效的修复治疗方法[1]。一方面,SCI造成病变区域大量神经元死亡,而成人脊髓缺乏神经元再生能力可导致神经支配环路中断,神经元新生成为SCI的一个治疗难题;另一方面,SCI后反应性星形胶质细胞增生,小胶质细胞和星形胶质细胞激活形成致密瘢痕而阻碍轴突的再生[2]。如何在不破坏胶质瘢痕保护作用的前提下尽量降低致密瘢痕的阻碍作用,逆转成为神经元,成为治疗SCI的一个难题,目前中枢神经原位再生技术将胶质细胞重编程转化为神经元已经取得了一定进展[3]。
SCI属于中医学“痿证”“体惰”范畴。中医理论认为,急性SCI后所产生的各种临床症状,多因瘀滞督脉、枢机统率失职,导致督脉与其他经络、脏腑、气血功能紊乱所致[4]。我们认为SCI的病机为肾督虚损,瘀阻督脉,枢机统率失职,进而筛选出具有祛瘀通督、补益肝肾、调和气血功效的中药复方脊髓康。脊髓康是南京中医药大学无锡附属医院院内制剂,已获国家发明专利(ZL200910026193.7)。前期临床验证,脊髓康对于脊髓损伤具有促进疾病康复、改善运动行为的作用[5-6]。实验研究[7]发现,脊髓康具有促进胶质细胞向神经元分化的效应。另有研究发现,SRY转录盒因子2(SOX-2)能将体细胞转化为神经元细胞,但效率较低[8]。本研究观察脊髓康含药血清联合SOX-2转录因子对星形胶质细胞直接重编程诱导为神经元细胞的影响,为其临床治疗脊髓损伤提供依据。本研究经无锡市中医医院医学伦理委员会批准(批准号SZYYKJFZJH2020111810)。
1 材料与方法
1.1 动物
清洁级雄性SD大鼠5只,出生1~4天,体质量5~15 g;清洁级成年雄性SD大鼠10只,7~8周龄,体质量210~230 g。均由无锡市血吸虫病防治研究所提供,实验动物使用许可证号:SYXK(苏)2017-0050。饲养环境:温度(23±2)℃,相对湿度50%~70%,光照12 h的普通清洁环境,所有大鼠均可自由获得食物和水。
1.2 药物
脊髓康药物组成:黄芪30 g,枳实10 g,当归尾12 g,川芎10 g,丹参20 g,淫羊藿10 g,赤芍12 g,土鳖虫10 g,水蛭10 g,蜈蚣1条,厚朴10 g,肉苁蓉10 g,益智仁10 g,泽泻10 g,车前子15 g(包煎),茯苓10 g。以上诸药经无锡市中医医院药剂科煎制成含生药浓度为1.25 g/ml的溶液,4 ℃冷藏。
1.3 主要试剂及仪器
胎牛血清(YOSHi公司,批号A1005);多聚-D-赖氨酸(Absin公司,批号abs9173);平衡盐溶液PBS(Solarbio公司,批号P1020);碱性成纤维细胞生长因子(Peprotech公司,批号96-400-29);胰蛋白酶-EDTA(0.25%,批号25200056)、B27添加剂(批号17504-044)、N2添加剂(批号17502-048)、表皮生长因子(批号PH60311)、Neurobasal培养基(批号21103049)、DMEM高糖培养基(批号11965092),Gibco公司;免疫染色封闭液(凯诗源生物科技有限公司,批号SH-0687);Triton X-100(伊塔生物科技有限公司,批号YT2185);抗荧光淬DAPI(XYBio公司,批号XY4082);cDNA逆转录试剂盒(TOYOBO公司,批号FSQ-101);RIPA细胞裂解液(碧云天生物科技有限公司,批号MT0068);寡霉素(普利莱基因技术有限公司,批号C1509),线粒体解偶联剂(Biovision公司,批号2398-25);多聚甲醛(批号672002-0500)、山羊血清(批号E510009-0100),BBI公司;抗GFAP抗体(批号ab7260)、山羊抗兔IgG(批号ab150077),Abcam公司;抗微管相关蛋白2(MAP2)抗体(批号AF4081)、S腺苷甲硫氨酸(SAM)抗体(批号DF12822)、乙酰辅酶A(acetyl-CoA)抗体(批号AF6421),Affinity公司;HRP标记的山羊抗兔IgG(Servicebio公司,批号GB23303)。
TaqMan基因表达分析系统(型号AriaMx)、7900HT快速实时PCR仪(型号AriaMx)、细胞能量代谢分析仪(型号102342-100),Agilen公司;光学显微镜(型号BX60)、荧光显微镜(型号CKX53),Olympus公司;细胞恒温培养箱(PHCbi公司,MC0-170AICL);常温低速离心机(Eppendorf公司,型号Centrifuge5702RH)。
1.4 星型胶质细胞的提取、培养、鉴定
取新生1~4天内SD大鼠,断头取脑组织,分离出大脑皮质,仔细剥离软脑膜和血管后剪成微小组织块,室温1200 r/min离心5 min,离心半径8 cm,用0.25%胰酶消化30 min,加入胎牛血清后混匀,终止消化,室温1200 r/min离心5 min,离心半径8 cm,弃去上清,加入含胎牛血清的DMEM吹打混匀,使用200目筛网过滤,接种于T25培养瓶中,置于细胞恒温培养箱中培养,保持温度37 ℃、CO2浓度为5%,每3天进行1次换液,细胞融合至90%可以进行传代。选取第三代星形胶质细胞进行下一步实验。第三代细胞接种在聚D-赖氨酸涂层的盖玻片24孔板上,用PBS洗3次,每次5 min;每孔适量加入提前预冷的多聚甲醛室温固定20 min,PBS洗3次,每次5 min;Triton-X100室温透化15 min,PBS洗3次,每次5 min;使用体积分数为10%山羊血清室温进行封闭30 min后,每孔滴加提前稀释好的一抗(GFAP 1∶200),以覆盖为宜,4℃孵育过夜。第2天回收一抗,PBS洗3次,每次5 min;滴加提前稀释好的二抗(山羊抗兔IgG 1∶300),室温避光孵育60 min,PBS洗3次,每次5 min;沥干液体,滴加含有DAPI的封片剂进行封固,在荧光显微镜下采集图片。
1.5 含药血清制备
将成年SD大鼠采用随机数字表法分为空白组和给药组各5只。给药组大鼠以20 g/(kg·d)脊髓康溶液(生药浓度为1.25 g/ml)灌胃,早晚各灌胃1次,连续给药3天;空白组给予16 ml/(kg·d)生理盐水灌胃,连续给药3天。两组大鼠末次灌胃后1 h腹主动脉采血,4 ℃静置1 h,室温4000 r/min离心6 min,离心半径8 cm,分离血清,56 ℃水浴30 min灭活补体,经0.22 μm微孔滤膜过滤除菌后分装,-20 ℃保存备用。
1.6 细胞分组及干预方法
在24孔板中将第三代星形胶质细胞接种在聚D-赖氨酸涂层的盖玻片(12 mm)上,分为空白血清组、SOX-2组、SOX-2+脊髓康血清组,每组3个复孔,每孔1×104个细胞。铺板培养2天后,仔细将培养基吸出,用PBS轻柔地洗3次,吸干PBS,每孔加入800 μl含10% FBS的DMEM高糖培养基。SOX-2组:将10 mmol/L SOX-2溶入培养基中,每孔加入800 μl,连续刺激星形胶质细胞7天,随后更换含有生长因子脑源性神经营养因子(BDNF)、神经营养因子3(NT-3)(含B27N2添加剂)的神经元培养基培养至21天。SOX-2+脊髓康血清组:将2.5%脊髓康含药血清(课题组前期实验得出的最佳效应浓度[9])、10 mmol/L SOX-2溶入培养基中,并使培养基中血清终浓度为10%,每孔加入800 μl,连续刺激星形胶质细胞7天,随后更换含有生长因子BDNF、NT-3(B27N2)的神经元培养基培养至21天。空白血清组:将空白血清融入培养基中,并使培养基中血清终浓度为10%,每孔加入800 μl,并于7天后更换含有生长因子BDNF、NT-3(B27N2)的神经元培养基培养至21天。
1.7 观察指标与方法
1.7.1 光镜下观察重编程神经元
21天后在光镜下观察各组细胞形态并拍照。
1.7.2 免疫荧光多标染色验证重编程神经元
通过免疫荧光多标染色神经元轴突标志物MAP2,DAPI染色细胞核双链DNA验证重编程的神经元。使用红色标记MAP2、蓝色标记DAPI,检测MAP2表达和DAPI染色情况,荧光显微镜下观察并拍照。
1.7.3 细胞能量代谢分析仪检测细胞胞外酸化率(ECAR)和耗氧率(OCR)
为了研究SOX-2+脊髓康血清组和SOX-2组细胞代谢以及功能的改变,本研究评估了两组细胞糖酵解细胞ECAR和OCR。干预21天后,SOX-2组、脊髓康+SOX-2组细胞以1×104个在无CO2培养箱孵育1 h上机检测,根据试剂盒的说明进行细胞ECAR测量,ECAR基线平衡后,每隔7 min测量3次后,机器按照时间点分别加入寡霉素62 μl,线粒体解偶联剂62 μl。根据说明进行OCR测量,OCR基线平衡后,机器按照时间点分别加入寡霉素56 μl,线粒体解偶联剂62 μl。实验数据由 Seahorse XFe 24 Wave software 处理。
1.7.4 Western blot法检测SAM和acetyl-CoA表达
以RIPA细胞裂解液提取3组细胞总蛋白,BCA测定蛋白浓度。垂直电泳分离,将蛋白转至PVDF膜,室温封闭1 h后,孵育一抗(SAM 1∶1000,acetyl-CoA 1∶1000)4 ℃过夜,室温孵育二抗(HRP标记的山羊抗兔IgG 1∶5000)2 h,于暗室中曝光和显影。所用内参为β-actin,条带灰度分析使用Quantity One 4.6.2软件系统,结果以灰度值表示。
1.7.5 PCR定量分析星形胶质细胞糖酵解相关基因的表达
提取细胞RNA,沉淀RNA。cDNA逆转录试剂盒合成cDNA。用Prime6设计引物,由上海生工生物工程有限公司合成,己糖激酶1(HK1):上游:GGAGATGAAGAATGTGGAGATGG,下游:CTTGGTGAAGTCAATCAGGATGT,扩增产物长度:226 bp;己糖激酶2(HK2):上游:CTGGTGCGTGTGCGTAATG,下游:TGAGGAGGATGCTCTGGTCTA,扩增产物长度:229 bp;磷酸果糖激酶1(PFK1):上游:CGACGAGAGGCAGTGAGTTA,下游:TGGTAGTGTTGGTGGCATCA,扩增产物长度:166 bp;磷酸果糖激酶2(PFK2):上游:TCCATCCTCGCACCATCTATC,下游:CACGCCAGCATCAATCTCATT,扩增产物长度:254 bp;M2型丙酮酸激酶同工酶(PKM2):上游:TGAATGTGGCTCGGCTGAA,下游:GCAACAGGTCGGTAG-AGAATG,扩增产物长度:121 bp;甘油醛-3-磷酸脱氢酶(GAPDH),上游:ATGCCATCACTGCCA-CTCA,下游:CCTGCTTCACCACCTTCTTG,扩增产物长度:258 bp。每个样品设立3个复孔,取均值,按照2-△△ct方法进行均一化处理,所有实验结果至少重复3次。
1.8 统计学方法
使用SPSS 19.0软件对数据进行处理,计量资料符合正态分布者采用均数±标准差(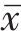
2 结果
2.1 星形胶质细胞的形态及其纯度鉴定结果
镜下可见细胞生长状态良好,胞体突起增大,透光度较低,细胞间连接密切,呈现铺路石样,无小胶质细胞或少突胶质细胞。在24孔板中将第三代星形胶质细胞培养在聚D-赖氨酸涂层的盖玻片(12 mm)上,用星形胶质细胞特异性抗体GFAP染色,荧光显微镜下发绿色荧光(见图1),星形胶质细胞的纯度大于95%,达到后期实验对于此细胞纯度的要求。
2.2 各组星形胶质细胞形态学比较
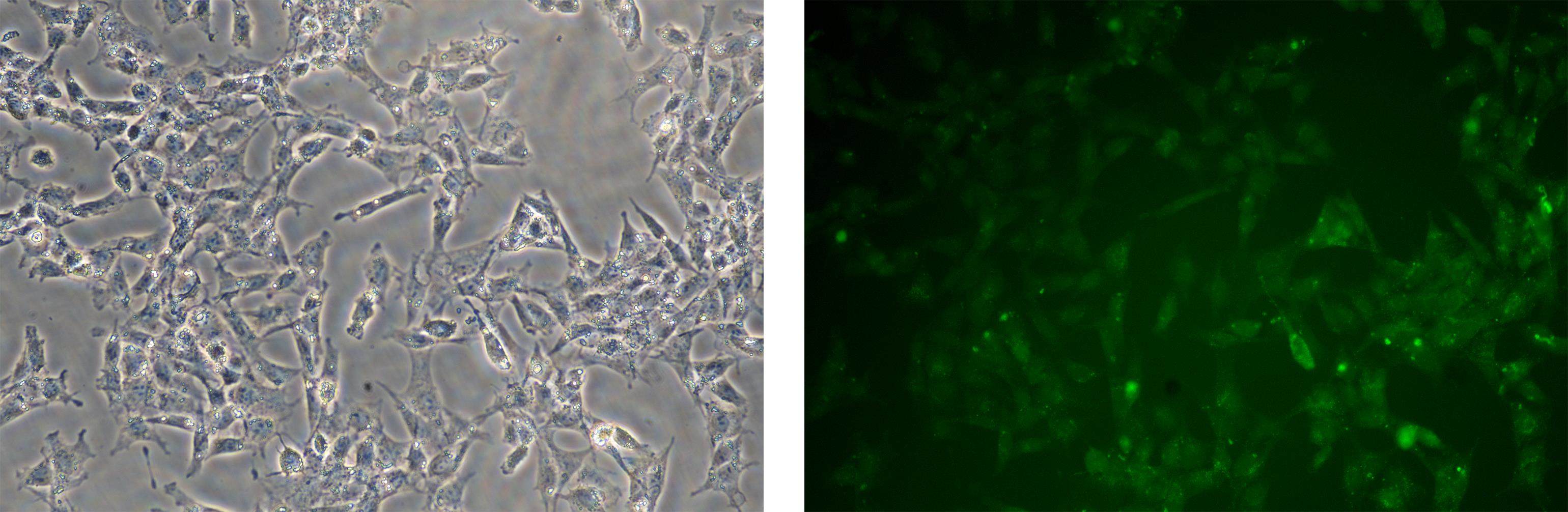
21天后光镜下观察到SOX-2+脊髓康血清组、SOX-2组胞体明显缩小变得细长,两端伸出较长轴突,呈现两极形态,且SOX-2+脊髓康血清组神经元样细胞数量明显多于SOX-2组;空白血清组细胞只观察到饱满的星形胶质细胞,未观察到神经元样细胞(见图2)。
2.3 各组细胞免疫荧光多标染色结果
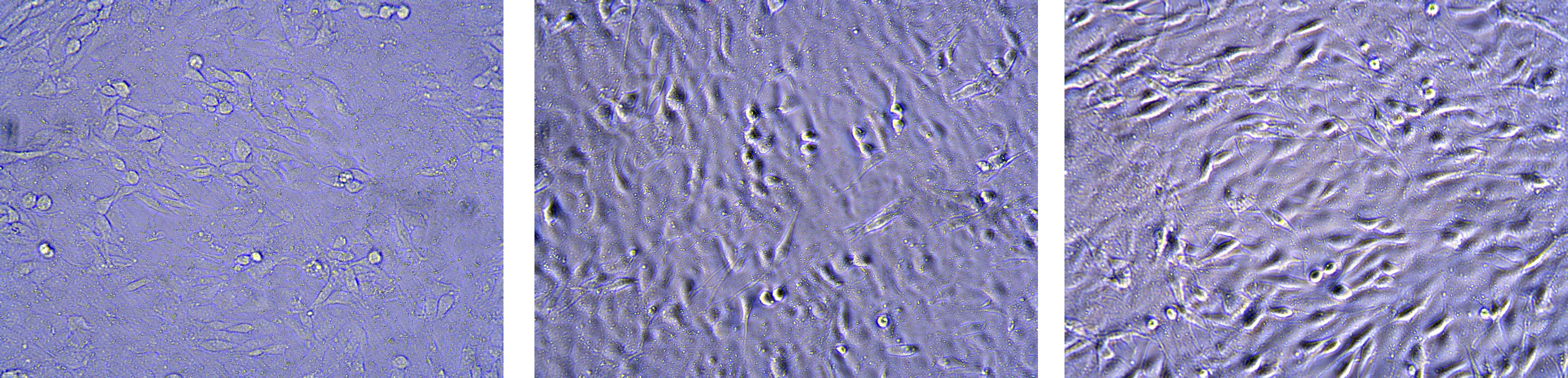
使用玫红色标记MAP2、蓝色标记DNA(DAPI),对各组细胞进行免疫荧光多标染色。图3示,SOX-2+脊髓康血清组及SOX-2组细胞核染色发生形态变化,成熟神经元轴突标志物MAP2表达阳性,且SOX-2+脊髓康血清组MAP2明显较SOX-2组增加,空白血清组细胞未见明显核染色形态变化及MAP2表达。表1示,SOX-2+脊髓康血清组MAP2表达较空白血清组和SOX-2组明显上调(P<0.05),而空白血清组和SOX-2组差异无统计学意义(P>0.05)。
| 组别 | 样本数 | MAP2 |
|---|---|---|
| 空白血清组 | 3 | 10.57±0.64a) |
| SOX-2组 | 3 | 12.11±1.05a) |
| SOX-2+脊髓康血清组 | 3 | 25.37±5.01 |
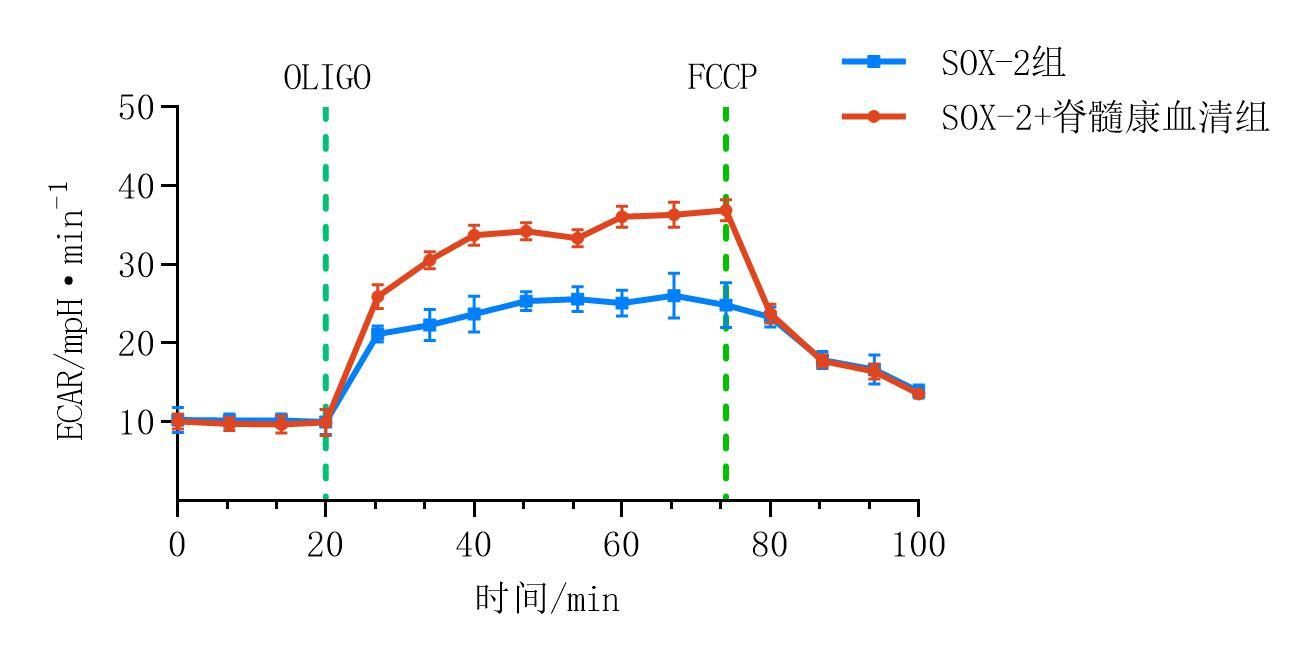
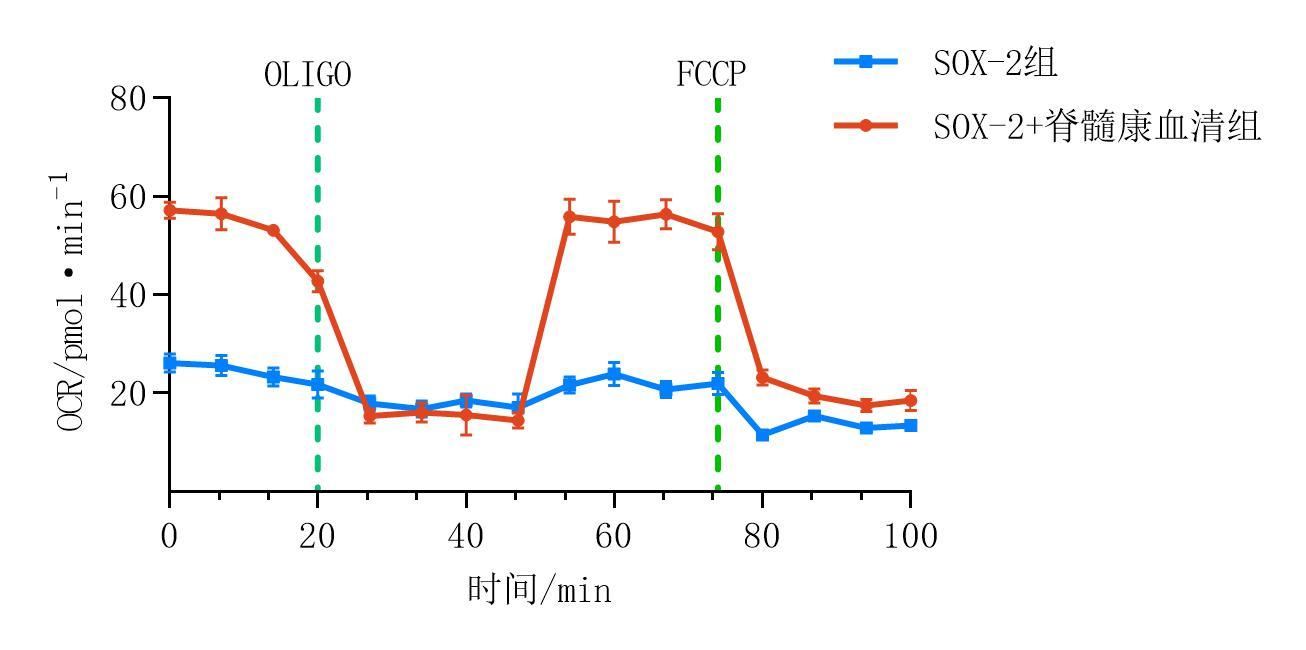
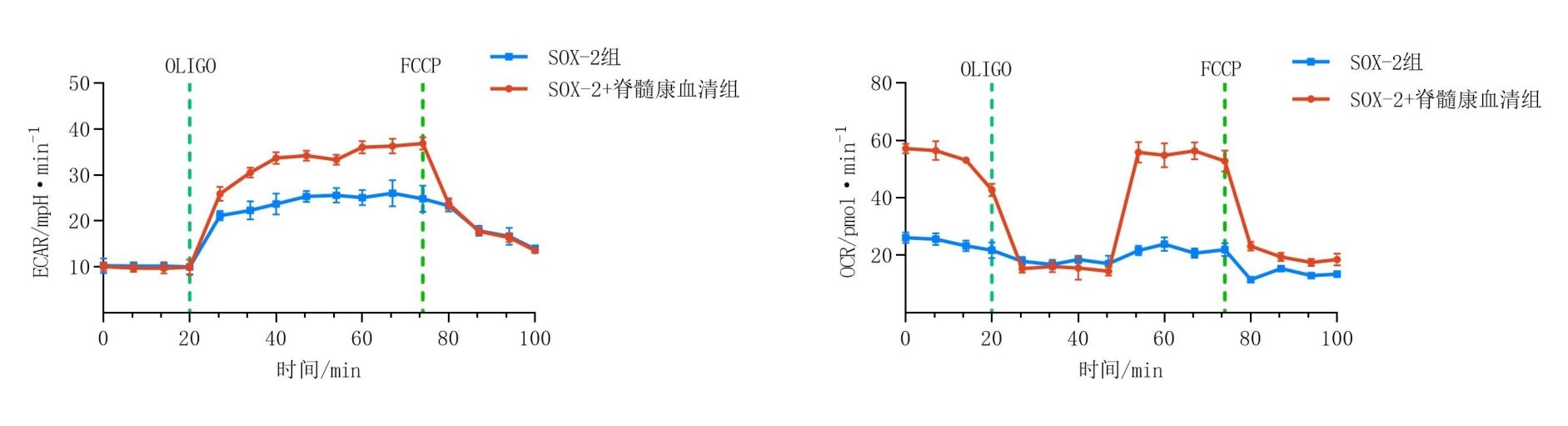
2.4 各组细胞ECAR和OCR比较
图4示,SOX-2+脊髓康血清组较SOX-2组ECAR和OCR均升高。
grid ="1,2;" source = "paralayout"图4SOX-2+脊髓康血清组和SOX-2组细胞 ECAR、OCR比较
2.5 各组细胞中SAM、acetyl-CoA蛋白表达比较
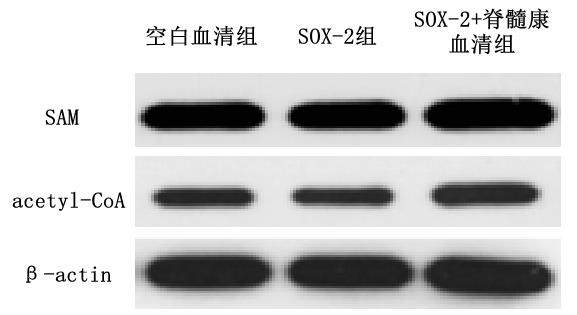
表2示,SOX-2+脊髓康血清组SAM、acetyl-CoA蛋白表达均较空白血清组和SOX-2组明显升高(P<0.05),空白血清组和SOX-2组SAM、acetyl-CoA蛋白表达差异无统计学意义(P>0.05)。各组细胞中SAM和acetyl-CoA蛋白电泳图见图5。
| 组别 | 样本数 | SAM | acetyl-CoA |
|---|---|---|---|
| 空白血清组 | 3 | 0.84±0.03a) | 0.35±0.04a) |
| SOX-2组 | 3 | 0.83±0.02a) | 0.36±0.03a) |
| SOX-2+脊髓康血清组 | 3 | 0.97±0.06 | 0.48±0.03 |
2.6 各组细胞中糖酵解相关基因表达比较
表3示,与空白血清组比较,SOX-2组PFK1、PFK2、PKM2基因表达显著升高,SOX-2+脊髓康血清组HK1、HK2、PFK1、PFK2、PKM2基因表达均显著升高(P<0.05或P<0.01)。与SOX-2组比较,SOX-2+脊髓康血清组HK1、HK2、PFK1、PFK2、PKM2基因表达均显著升高(P<0.01)。
| 组别 | 样本数 | HK1 | HK2 | PFK1 | PFK2 | PKM2 | |
|---|---|---|---|---|---|---|---|
| 空白血清组 | 3 | 1.00±0.13 | 0.99±0.07 | 1.01±0.05 | 0.99±0.06 | 0.99±0.08 | |
| SOX-2组 | 3 | 1.15±0.07 | 1.19±0.15 | 1.23±0.02a) | 1.50±0.11a) | 1.24±0.06b) | |
| SOX-2+脊髓康血清组 | 3 | 2.63±0.14a)c) | 2.69±0.11a)c) | 2.36±0.02a)c) | 3.15±0.08a)c) | 7.35±0.27a)c) | |
3 讨论
SCI病理过程复杂,造成病灶区域大量神经元死亡,损伤后星形胶质细胞逐渐迁移到病变周围,沉积富含硫酸软骨素蛋白多糖的细胞外基质,形成星形胶质细胞瘢痕,阻碍轴突再生[10-11]。干细胞移植被认为是一种行之有效的治疗手段,但其缺少稳定的细胞来源,成瘤风险较高,诱导分化过程可能错过脊髓损伤功能修复的最佳时期等,使得干细胞移植技术存在一定的风险和限制条件[12]。重编程是细胞从一种基因表达谱转换为另一套不相关表达谱的过程,但目前重编程效率仍然不理想[8],迫切需要找到一种高效诱导重编程的办法。如何在损伤区域补充充足的神经元,使之兼具较高的安全性又符合伦理,又能具有较高的可行性是研究的难点。
《灵枢·寒热病》记载:“身有所伤,血出多,若有所堕坠,四肢懈惰不收,名曰体惰”,这里描述的症状与SCI引起的瘫痪、半身不遂等症状较为接近,被认为是中医学对SCI的最早描述。现代中医学认为,SCI多由肝肾不足、督脉不通、气血不和导致[4],脊髓康是在“肾督同治”理论[13]指导下筛选出的中药复方。方中黄芪善于补益脾气,气足则促血行,祛瘀而不伤正;当归、川芎和营养血,行气止痛;赤芍、丹参祛瘀通络,清热凉血;水蛭、土鳖虫、蜈蚣破瘀消癥,续筋接骨,通络止痛;淫羊藿、肉苁蓉、益智仁补益肝肾,培本固元;枳实、厚朴泻热通便,行气散瘀;车前子、泽泻、茯苓清热利湿通淋;全方共奏补益肝肾、利湿清热、通利督脉、祛瘀通络、调和气血之功。前期临床研究显示,脊髓康可以改善SCI患者损伤局部微循环、延缓脊髓继发性损伤,能够促进其运动行为改善[14]。实验研究发现,脊髓康具有改善脊髓损伤后局部微环境、控制胶质瘢痕形成、改善轴突再生微环境的作用,可以支持、保护和营养神经元细胞并促进神经再生,减少继发损伤,并对脊髓继发性损伤引起的神经元凋亡具有明显的抑制作用[15-17]。本研究提取大鼠星形胶质细胞进行体外研究,研究脊髓康对星形胶质细胞重编程的作用效果以及内在机制。光镜下发现干预后SOX-2+脊髓康血清组、SOX-2组细胞形态发生改变,SOX-2+脊髓康组相较SOX-2组存在大量有两极且长轴突的神经元样细胞,而空白血清组只观察到饱满的星形胶质细胞,未见神经元样细胞。免疫荧光检测结果显示,空白血清组细胞几乎无神经元轴突标记物MAP2表达,细胞核染色呈圆球状未见明显细胞核形态变化;而SOX-2+脊髓康血清组MAP2表达阳性,细胞核发生形态改变。而SOX-2干预神经元再生效果不理想,这与目前研究[8]一致,说明脊髓康可促进神经元再生。
目前细胞重编程能否成功关键就在于表观遗传学是否得以重建[18]。有研究表明,糖酵解可能是重编程中组蛋白乙酰化的主要调控信号,并且在诱导多能性转变以及之后的重编程过程中,即使处于富氧条件下,糖酵解基因表达也保持上调[19-20]。OCR和ECAR分别反映线粒体呼吸能力和糖酵解能力[21],本研究发现,SOX-2+脊髓康血清组相比SOX-2组糖酵解能力明显增强,并且SOX-2+脊髓康血清组糖酵解能力在ECAR曲线后续片段继续增强,联系OCR曲线对应片段耗氧率提升,结果表明糖酵解在此阶段持续上调,并且SOX-2+脊髓康血清组有氧糖酵解能力显著提升。同时,SOX-2+脊髓康血清组有氧糖酵解中间代谢产物SAM、acetyl-CoA表达明显较SOX-2组增强,进一步说明有氧糖酵解促进了重编程过程。定量PCR分析星形胶质细胞糖酵解相关基因HK1、HK2、PFK1、PFK2、PKM2基因表达,发现SOX-2+脊髓康血清组各基因表达亦明显增强,推测脊髓康可能通过促进有氧糖酵解进而促进了重编程,这种效应可能与促进组蛋白乙酰化和组蛋白甲基化有关。
综上所述,脊髓康含药血清联合SOX-2可以诱导星形胶质细胞直接重编程为神经元细胞,并且提升神经元再生效率,为其临床治疗SCI提供科学依据。但本研究仅为体外实验,还需后续体内实验进一步证实。
Corrigendum: dissecting the dual role of the glial scar and scar-forming astrocytes in spinal cord injury
[J]. Front Cell Neurosci,2020,14:270. doi: 10.3389/fncel.2020.00270.Metabolic remodeling during somatic cell reprogramming to induced pluripotent stem cells: involvement of hypoxia-inducible factor 1
[J]. Inflamm Regen, 2020,40:8. doi: 10.1186/s41232-020-00117-8.Mitochondrial fission protein Drp1 inhibition promotes cardiac mesodermal differentiation of human pluripotent stem cells
[J]. Cell Death Discov,2018,4:39. doi: 10.1038/s41420-018-0042-9.所有作者声明无利益冲突。
王浩阗,王建伟,吴毛等.脊髓康含药血清联合SOX-2对星形胶质细胞重编程诱导为神经元细胞的影响[J].中医杂志,2023,64(03):288-294.
WANG Haotian,WANG Jianwei,WU Mao,et al.Effect of Jisuikang-containing Serum Combined with SOX-2 on Astrocyte Being Reprogrammed and Induced into Neurons[J].Journal of Traditional Chinese Medicine,2023,64(03):288-294.

