
中药升降浮沉药性理论概括药物对人体作用的趋向性,主要解释中药对于疾病病症、病势发展趋向的影响[1]。中医学认为,临床用药应遵循“顺病位、逆病势”的用药原则[2]。由于疾病有在上、在表、在下和在里等病位之分和向上、向下、向内和向外等病势趋向,药物的升降浮沉性能正是针对疾病的病势趋向,作用于相应的病势,达到治疗疾病的目的[3]。因此,在临床用药时,病位在上在表者宜升浮不宜沉降,病位在下在里者宜沉降不宜升浮;病势上逆者宜降不宜升,病势下陷者宜升不宜降[4]。
前期通过网络药理学结合正常大鼠实验研究,发现典型升浮和沉降中药作用靶点区别主要在毒蕈碱乙酰胆碱受体M3(CHRM3)、毒蕈碱乙酰胆碱受体M1(CHRM1)和过氧化物酶体增殖物激活受体γ(PPAR-γ)[5],但麻黄升浮药性和葶苈子沉降药性的潜在靶点是否与上述靶点相关仍需进一步验证。麻黄性温,味辛、微苦,具有发汗散寒、宣肺平喘、利水消肿之功效,药性主升浮[6]。前期研究表明,可以将麻黄拆分为成分互不交叉的生物碱、非生物碱和多糖组分[7],并且生物碱组分为麻黄药性升浮的物质基础[8-9]。葶苈子性大寒,味辛、苦,具有泻肺平喘、行水消肿之功效,药性主沉降[10]。前期研究表明,可以将葶苈子拆分为互不交叉的低聚糖、脂肪油、黄酮苷、黄酮苷元和多糖组分,并且低聚糖、黄酮苷和脂肪油为葶苈子沉降药性的物质基础[11]。本实验旨在基于“顺病位、逆病势”治疗原则,采用麻黄和葶苈子及其功效对应的疾病模型(风寒表证、风水水肿、痰饮停聚、肺水),探究麻黄升浮药性和葶苈子沉降药性的潜在作用靶点。本研究通过河南中医药大学动物伦理委员会伦理审批,伦理审批号:DWLL2018080003。
1 材料
1.1 动物
SPF级雄性SD大鼠340只,6~8周龄,体质量180~220 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0011。大鼠饲养于SPF级动物房中,12 h光照,恒温24 ℃,湿度40%,自由饮食、饮水。
1.2 药物
麻黄购买于内蒙古自治区鄂托克前旗九康中药材开发有限责任公司,葶苈子购买于北京同仁堂郑东新区药店,经河南中医药大学董诚明教授鉴定其分别为麻黄科植物草麻黄Ephedra sinica Stapf的干燥草质茎和十字花科植物播娘蒿Descurainia sophia (L.) Webb ex Prantl.的干燥成熟种子。通宣理肺丸购买于北京同仁堂股份有限公司同仁堂制药厂,批号:19015355,规格:每丸重6 g。
麻黄和葶苈子水提物制备:均取2 kg的药材,麻黄提前用10倍量水浸泡30 min,葶苈子提前10倍量水浸泡50 min,然后用水煎煮两次,每次1 h,合并滤液,纱布过滤后,滤液浓缩,得到各药材的水煎液总提物。
麻黄和葶苈子拆分组分的制备参考课题组前期研究成果[7,11]:其中麻黄多糖提取率为5.9%,生物碱组分提取率为1.1%,非生物碱组分提取率为4.6%;葶苈子多糖组分提取率为1.231%,低聚糖组分提取率为1.306%,黄酮苷组分提取率为0.289%,黄酮苷元组分提取率为0.517%,脂肪油组分提取率为28.8%。
1.3 主要试剂与仪器
注射用盐酸多柔比星(批号:2006E1),深圳万乐药业有限公司;Ⅱ级和Ⅴ级致敏液OVA(批号:A5253、A5503),美国Sigma公司;SDS-PAGE凝胶制备试剂盒(货号:64136301),美国Bio-Rad公司;一抗毒蕈碱乙酰胆碱受体M3(CHRM3,货号:A1602)、过氧化物酶体增殖物激活受体γ(PPAR-γ,货号:A0270)、β-肌动蛋白(β-actin抗体,货号:AC026),ABclonal公司;二抗山羊抗兔(货号:925-68071)和山羊抗鼠(货号:925-32210),美国Li-Cor公司;HiScript Ⅲ RT SuperMix(货号:R323-01)、ChamQ Universal SYBR qPCR Master Mix(货号:Q711-02),南京诺维赞生物科技股份有限公司;总RNA提取试剂盒(货号:R1200)、全蛋白提取试剂盒(货号:BC3710)、BCA蛋白浓度测定试剂盒(货号:PC0020),北京索莱宝科技有限公司。
ABI QuantStudio 5型实时荧光定量PCR系统(美国赛默飞世尔公司);BioTek型多功能酶标仪(美国伯腾仪器有限公司);Odyssey-CLx型双色红外荧光成像系统(美国Li-Cor公司);FS-75型落地电风扇(佛山市杨柳清泉电器有限公司)。
2 方法
2.1 动物实验
将340只大鼠采用随机数字表法分为风寒表证模型组80只、风水水肿模型组90只、痰饮停聚模型组90只、肺水模型组80只,各组大鼠适应性喂养1周后,按体质量均衡原则(根据体质量由大到小依次进行分组,第1次从第一组开始直到最后一组,每组1只,第2次从第二组开始直到最后一组,然后再将第一组补齐2只,依次进行直至将大鼠均分到每组)及造模需要再行分组。
2.1.1 风寒表证模型大鼠造模、分组及给药方法
80只大鼠中10只设为正常对照组,剩余70只大鼠造模。造模大鼠放置在透风的不锈钢丝笼内饲养,调节风扇距离和转速,使大鼠感受到的风力为5~6级,室温为3~5 ℃,相对湿度(40%±5%)的环境中,让动物自由摄食活动[12]。正常对照组大鼠放置在正常环境中。造模期间,每天观察大鼠状态并测量大鼠体温和体质量,以大鼠出现打喷嚏、流涕、弓背耸毛、蜷缩聚卧并且体温升高表明风寒表证模型成功[12]。本模型造模成功大鼠64只,根据大鼠体质量均衡原则去掉体质量最大的2只和最小的2只,剩余60只大鼠分为风寒表证组、麻黄组、生物碱组、多糖组、非生物碱组、通宣理肺丸组6组,每组10只。
除正常对照组和风寒表证组大鼠灌胃蒸馏水1 ml/100 g外,其余给药组大鼠灌胃相应药物1 ml/100 g,每日1次,连续给药4天。课题组前期研究[13]表明,麻黄中剂量即麻黄按照人与大鼠等效剂量[14]的14倍量约2340 mg/kg给药对该模型作用效果最好,因此本实验采用该剂量。然后根据生物碱、多糖和非生物碱组分的提取率1.1%、5.9%和4.6%计算其给药剂量分别为25.74、138.06、107.64 mg/kg。通宣理肺丸按照人与大鼠等效剂量[14]的14倍量给药为5600 mg/kg。
2.1.2 风水水肿模型大鼠造模、分组及给药方法
90只大鼠中10只设为正常对照组,剩余80只大鼠造模。先制备水肿模型:将注射用盐酸多柔比星粉末用生理盐水溶解,对大鼠进行尾静脉注射,首次按4 mg/kg(浓度为0.4 mg/ml)进行注射,7天后用同样方法按3.5 mg/kg(浓度为0.35 mg/ml)大鼠体重注射第2次[15]。大鼠出现大便溏泄、精神萎靡、畏寒喜暖、自主活动和尿量减少、尿蛋白水平增加视为水肿模型造模成功[16]。将水肿模型造模成功大鼠置于四面透风的鼠笼中,调节电风扇风速2.5 m/s,湿度为(40±5)%,每天刺激4~6 h,时间为2~6天,以大鼠出现恶风、弓背毛松、瘙痒、喷嚏、流涕、小便减少、体温略升高等类似表证的表现认为风水水肿造模成功,模型判定标准参照《金匮要略·水气病脉证并治第十四》[17]中对风水水肿疾病症状的描述制定。68只大鼠造模成功,除去体质量最大的4只和体质量最小的4只,剩余60只大鼠根据大鼠体质量均衡原则分为风水水肿组,麻黄组、生物碱组、多糖组、非生物碱组、通宣理肺丸组6组,每组10只。
各组大鼠以1 ml/100 g药量灌胃给药连续21天,正常对照组和风水水肿组给予同体积蒸馏水。根据课题组前期研究结果[18],麻黄高剂量即按照人与大鼠等效剂量的28倍量约4680 mg/kg给药效果对该模型最好,因此本实验采取该剂量。然后根据生物碱、多糖和非生物碱组分的提取率1.1%、5.9%和4.6%计算其给药剂量分别为51.48、276.12、215.28 mg/kg。通宣理肺丸剂量依据同2.1.1。
2.1.3 痰饮停聚模型大鼠造模、分组及给药方法
90只大鼠中10只设为正常对照组,剩余80只大鼠造模。将痰饮停聚造模时间分为致敏期和激发期,分别在第0、8天,腹腔注射V级致敏液(OVA 1 mg+氢氧化铝10 mg)1 ml/200 g致敏;第15至20天连续雾化激发7天,激发液为2%的Ⅱ级致敏液OVA 30 ml,每次雾化激发30 min[19]。造模完成后,大鼠出现点头呼吸,喘息次数明显增多、呼吸幅度增大,腹肌收缩频率加快证明模型成功[19]。造模成功大鼠共76只,根据体质量均衡原则,除去体质量最大的3只和体质量最小的3只,将剩余70只大鼠分为痰饮停聚组、葶苈子组、黄酮苷组、黄酮苷元组、低聚糖组、多糖组、脂肪油组7组,每组10只。
各组大鼠以1 ml/100 g药量灌胃给药连续7天,正常对照组和痰饮停聚组给予同体积蒸馏水。按照人与大鼠等效剂量的14倍量即2334 mg/kg给药,然后根据黄酮苷、黄酮苷元、低聚糖、多糖和脂肪油的提取率0.289%、0.517%、1.306%、1.231%和28.8%计算其给药剂量分别是6.75、12.07、30.48、28.74、672.19 mg/kg。
2.1.4 肺水模型大鼠分组、造模及给药方法
80只大鼠中10只设为正常对照组,剩余70只大鼠分为肺水组(2 mg/100 g)、葶苈子组(2334 mg/kg)、黄酮苷组(6.75 mg/kg)、黄酮苷元组(12.07 mg/kg)、低聚糖组(30.48 mg/kg)、多糖组(28.74 mg/kg)、脂肪油组(672.19 mg/kg),每组10只。给药第7天,除正常对照组按照0.2 ml/100 g体积胸腔注射生理盐水外,其余各组大鼠从肋间肌处向胸膜腔内注射角叉菜胶溶液进行造模,以大鼠出现咳嗽、喘促、呼吸困难、弓背现象、鼻子湿润及鼻孔出现泡沫液体等症状为模型成功标准[29]。
给药剂量依据同2.1.3。各给药组先连续灌胃给药7天(1 ml/100 g),正常对照组和肺水组给予同体积蒸馏水,每天1次。
2.2 实时荧光定量PCR检测大鼠肺组织中CHRM3、CHRM1和PPAR-γ mRNA表达
提取大鼠肺脏组织总RNA,使用HiScript ⅢRT SuperMix预混液进行逆转录得到cDNA,最后采用ChamQ通用SYBR qPCR预混液,以实时荧光定量PCR对CHRM3、CHRM1和PPAR-γ的mRNA水平进行分析,采用2-ΔΔCt法,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因计算mRNA相对表达量。引物由武汉塞维尔生物有限公司设计合成。引物序列:CHRM3上游(5'-3'):ACCAGGGCCATCTAT-TCCATT,下游(5'-3'):ACGGCAGACTCTAAC-TGGATGG,长度:224 bp;CHRM1上游(5'-3'):GCTGGTTTCCTTCGTTCTCTG,下游(5'-3'):ACAC-ATGACCGTGACAGGGAG,长度:166 bp;PPAR-γ上游(5'-3'):CCCTTTACCACGGTTGATTTC,下游(5'-3'):CTTCAATCGGATGGTTCTTCG,长度:321 bp;GAPDH上游(5'-3'):CTGGAGAAACCTGCCAAG-TATG,下游(5'-3'):GGTGGAAGAATGGGAGTT-GCT,长度:138 bp。
2.3 Western Blot检测大鼠肺组织中CHRM3、PPAR-γ蛋白表达
取大鼠肺组织,采用全蛋白提取试剂盒提取总蛋白,并使用BCA法进行蛋白定量。每孔蛋白上样量60 μg进行10% SDS-PAGE凝胶电泳,半干法电转移至PVDF膜,封闭1.5 h后,加入一抗CHRM3和PPAR-γ抗体,稀释比例参照说明书推荐比例均是1∶1000,4 ℃孵育过夜,回收一抗,PBST洗5次,每次5 min,加入二抗,稀释比例1∶20 000,室温孵育1 h,PBST洗3次,每次5 min。Odyssey双色红外荧光成像系统进行成像,采用Image Studio 5.2.5软件进行数据分析。在风寒表证和风水水肿模型中发现,CHRM3的基因表达具较强的规律性,因此在这两个模型中检测CHRM3的蛋白表达。在痰饮停聚和肺水模型中发现,PPAR-γ的基因表达具有较强的规律性,因此在这两个模型中检测PPAR-γ的蛋白表达。
2.4 统计学方法
采用SPSS 26.0软件进行数据分析,计量数据均符合正态分布以(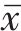
3 结果
3.1 风寒表证大鼠模型研究结果
3.1.1 风寒表证模型各组大鼠肺组织中CHRM3、CHRM1和PPAR-γ mRNA水平比较
表1示,与正常对照组比较,风寒表证组CHRM3的mRNA水平显著降低,CHRM1和PPAR-γ的mRNA水平显著升高(P<0.05或P<0.01);与风寒表证组相比,麻黄组、通宣理肺丸组和生物碱组CHRM3的mRNA水平显著升高(P<0.01),非生物碱组CHRM3的mRNA水平显著降低(P<0.05);麻黄组CHRM1的mRNA水平显著升高(P<0.01),通宣理肺丸组和非生物碱组CHRM1的mRNA水平显著降低(P<0.01);麻黄组、通宣理肺丸组、生物碱组和多糖组PPAR-γ的mRNA水平显著降低(P<0.01)。
| 组别 | 鼠数 | CHRM3 | CHRM1 | PPAR-γ |
|---|---|---|---|---|
| 正常对照组 | 10 | 1.00±0.01 | 1.01±0.17 | 1.00±0.01 |
| 风寒表证组 | 10 | 0.64±0.04a) | 3.48±0.17a) | 1.15±0.04b) |
| 麻黄组 | 10 | 0.90±0.06c) | 5.20±1.05c) | 0.60±0.06c) |
| 通宣理肺丸组 | 10 | 1.05±0.08c) | 1.82±0.25c) | 0.71±0.02c) |
| 生物碱组 | 10 | 0.92±0.08c) | 2.93±1.31 | 0.80±0.17c) |
| 多糖组 | 10 | 0.66±0.06 | 2.37±0.39 | 0.67±0.08c) |
| 非生物碱组 | 10 | 0.47±0.13d) | 1.68±0.73c) | 1.25±0.03 |
3.1.2 风寒表证模型中各组大鼠肺组织中CHRM3蛋白表达比较
表2示,与正常对照组相比,风寒表证组大鼠CHRM3蛋白水平显著降低(P<0.01);与风寒表证组相比,麻黄组、通宣理肺丸组和生物碱组大鼠CHRM3的蛋白水平显著升高(P<0.01)。蛋白电泳图见附件(图1, 扫描本文二维码获取)。
| 组别 | 鼠数 | CHRM3 |
|---|---|---|
| 正常对照组 | 10 | 1.00±0.10 |
| 风寒表证组 | 10 | 0.47±0.03a) |
| 麻黄组 | 10 | 0.81±0.18b) |
| 通宣理肺丸组 | 10 | 0.90±0.06b) |
| 生物碱组 | 10 | 0.82±0.13b) |
| 多糖组 | 10 | 0.44±0.04 |
| 非生物碱组 | 10 | 0.35±0.14 |
3.2 风水水肿模型研究结果
3.2.1 风水水肿模型各组大鼠肺组织中CHRM3、CHRM1和PPAR-γ mRNA表达比较
表3示,与正常对照组相比,风水水肿组大鼠CHRM3和PPAR-γ的mRNA水平显著降低,CHRM1的mRNA水平显著升高(P<0.05或P<0.01);与风水水肿组相比,麻黄组、通宣理肺丸组和生物碱组CHRM3的mRNA水平显著升高,麻黄组和通宣理肺丸组CHRM1的mRNA水平显著升高,麻黄组PPAR-γ的mRNA水平降低,通宣理肺丸组、生物碱组、非生物碱组和多糖组PPAR-γ的mRNA水平显著升高(P<0.05或P<0.01)。
| 组别 | 鼠数 | CHRM3 | CHRM1 | PPAR-γ |
|---|---|---|---|---|
| 正常对照组 | 10 | 1.00±0.13 | 1.00±0.11 | 1.00±0.06 |
| 风水水肿组 | 10 | 0.70±0.04a) | 2.70±0.44a) | 0.60±0.02b) |
| 麻黄组 | 10 | 1.24±0.06c) | 5.87±0.69c) | 0.53±0.00d) |
| 通宣理肺丸组 | 10 | 1.01±0.04d) | 4.36±0.78d) | 0.70±0.03c) |
| 生物碱组 | 10 | 1.36±0.10c) | 2.93±0.06 | 0.74±0.03c) |
| 多糖组 | 10 | 0.68±0.02 | 2.85±0.60 | 0.97±0.02c) |
| 非生物碱组 | 10 | 0.83±0.06 | 3.17±0.22 | 0.88±0.06c) |
3.2.2 风水水肿模型各组大鼠肺组织中CHRM3蛋白表达比较
表4示,与正常对照组相比,风水水肿组大鼠CHRM3蛋白表达水平显著降低(P<0.01);与风水水肿组相比,麻黄组、通宣理肺丸组和生物碱组CHRM3的蛋白水平显著升高(P<0.01)。蛋白电泳图见附件(图2,扫描本文二维码获取)。
| 组别 | 鼠数 | CHRM3 |
|---|---|---|
| 正常对照组 | 10 | 1.00±0.06 |
| 风水水肿组 | 10 | 0.58±0.06a) |
| 麻黄组 | 10 | 0.78±0.10b) |
| 通宣理肺丸组 | 10 | 0.88±0.05b) |
| 生物碱组 | 10 | 1.23±0.16b) |
| 多糖组 | 10 | 0.60±0.07 |
| 非生物碱组 | 10 | 0.57±0.05 |
3.3 痰饮停聚模型研究结果
3.3.1 痰饮停聚模型各组大鼠肺组织中CHRM3、CHRM1和PPAR-γ mRNA表达比较
表5示,与正常对照组相比,痰饮停聚组大鼠CHRM3和CHRM1的mRNA水平显著降低(P<0.05或P<0.01);与痰饮停聚组相比,低聚糖组CHRM3的mRNA水平显著增加,葶苈子组、低聚糖组、黄酮苷组和脂肪油组PPAR-γ的mRNA水平显著增加,脂肪油组和黄酮苷元组CHRM1的mRNA水平显著降低(P< 0.01)。
| 组别 | 鼠数 | CHRM3 | CHRM1 | PPAR-γ |
|---|---|---|---|---|
| 正常对照组 | 10 | 1.01±0.15 | 1.00±0.12 | 1.00±0.10 |
| 痰饮停聚组 | 10 | 0.22±0.04a) | 0.70±0.05b) | 0.84±0.10 |
| 葶苈子组 | 10 | 0.36±0.02 | 0.67±0.14 | 1.85±0.11c) |
| 低聚糖组 | 10 | 0.62±0.38c) | 0.76±0.25 | 1.42±0.14c) |
| 黄酮苷组 | 10 | 0.37±0.07 | 0.59±0.05 | 1.59±0.11c) |
| 脂肪油组 | 10 | 0.15±0.05 | 0.20±0.09c) | 1.61±0.40c) |
| 多糖组 | 10 | 0.45±0.12 | 0.54±0.22 | 1.05±0.10 |
| 黄酮苷元组 | 10 | 0.16±0.04 | 0.26±0.08c) | 1.08±0.05 |
3.3.2 痰饮停聚模型各组大鼠肺组织中PPAR-γ蛋白表达比较
表6示,与正常对照组相比,痰饮停聚组PPAR-γ的蛋白表达差异无统计学意义(P>0.05);与痰饮停聚组相比,葶苈子组、低聚糖组、黄酮苷组和脂肪油组PPAR-γ的蛋白水平显著升高(P<0.05或P<0.01)。蛋白电泳图见附件(图3,扫描本文二维码获取)。
| 组别 | 鼠数 | PPAR-γ |
|---|---|---|
| 正常对照组 | 10 | 1.00±0.10 |
| 痰饮停聚组 | 10 | 1.10±0.28 |
| 葶苈子组 | 10 | 2.90±0.43a) |
| 低聚糖组 | 10 | 2.48±0.60a) |
| 黄酮苷组 | 10 | 2.14±0.20b) |
| 脂肪油组 | 10 | 2.20±0.23b) |
| 多糖组 | 10 | 1.32±0.54 |
| 黄酮苷元组 | 10 | 1.05±0.49 |
3.4 肺水模型研究结果
3.4.1 肺水模型各组大鼠肺组织中CHRM3 mRNA表达比较
表7示,与正常对照组相比,肺水组大鼠CHRM3和CHRM1的mRNA水平显著降低(P<0.01);与肺水组相比,葶苈子组CHRM3的mRNA水平显著降低,低聚糖组、脂肪油组和多糖组CHRM3的mRNA水平显著升高(P<0.05或P<0.01),葶苈子组、黄酮苷组、低聚糖组和脂肪油组PPAR-γ的mRNA水平显著升高,多糖组PPAR-γ的mRNA水平显著降低(P<0.01),多糖组和黄酮苷元组CHRM1的mRNA水平显著升高(P<0.01)。
| 组别 | 鼠数 | CHRM3 | CHRM1 | PPAR-γ |
|---|---|---|---|---|
| 正常对照组 | 10 | 1.00±0.11 | 1.01±0.18 | 1.00±0.05 |
| 肺水组 | 10 | 0.44±0.05a) | 0.60±0.08a) | 0.88±0.06 |
| 葶苈子组 | 10 | 0.29±0.01c) | 0.67±0.04 | 1.33±0.01b) |
| 低聚糖组 | 10 | 0.79±0.03b) | 0.58±0.19 | 1.24±0.17b) |
| 黄酮苷组 | 10 | 0.31±0.04 | 0.53±0.09 | 1.11±0.02b) |
| 脂肪油组 | 10 | 0.97±0.08b) | 0.49±0.12 | 1.04±0.05b) |
| 多糖组 | 10 | 1.22±0.16b) | 1.57±0.11b) | 0.40±0.03b) |
| 黄酮苷元组 | 10 | 0.36±0.01 | 1.02±0.20b) | 0.88±0.01 |
3.4.2 肺水模型各组大鼠肺组织中PPAR-γ蛋白表达比较
表8示,与正常对照组相比,肺水组PPAR-γ的蛋白表达差异无统计学意义(P>0.05),与肺水组相比,葶苈子组、低聚糖组、黄酮苷组和脂肪油组PPAR-γ的蛋白水平显著升高(P<0.05或P<0.01)。蛋白电泳图见附件(图4,扫描本文二维码获取)。
| 组别 | 鼠数 | PPAR-γ |
|---|---|---|
| 正常对照组 | 10 | 1.00±0.17 |
| 肺水组 | 10 | 1.03±0.2 |
| 葶苈子组 | 10 | 1.94±0.46a) |
| 低聚糖组 | 10 | 3.05±0.70a) |
| 黄酮苷组 | 10 | 1.89±0.12a) |
| 脂肪油组 | 10 | 2.43±0.31a) |
| 多糖组 | 10 | 0.88±0.15 |
| 黄酮苷元组 | 10 | 0.86±0.19 |
4 讨论
升降浮沉是临床遣方用药的重要依据[21]。中医认为,临床治疗应遵循“顺病位、逆病势”的用药原则,可以利用药势调节脏腑气机紊乱,使之恢复正常的生理功能,亦或作用于机体的不同部位,因势利导,趋邪外出,从而达到治疗疾病的目的[3]。本实验旨在采用病位在表的风寒表证和风水水肿及病位在里的痰饮停聚和肺水动物模型分别探究麻黄升浮药性和葶苈子沉降药性的潜在作用靶点。
前期通过给予正常大鼠典型的升浮药(麻黄、柴胡、升麻、葛根、桔梗、薄荷)和沉降药(葶苈子、旋覆花、川牛膝、丁香、刀豆、茯苓、苦杏仁),发现升浮药和沉降药对正常动物的影响区别主要是CHRM3、CHRM1和PPAR-γ的表达水平[5]。中药升降浮沉主要解释中药对疾病病症、病势发展趋向的影响[22]。因此在正常动物找到升浮和沉降药性的规律后,根据麻黄发汗解表、利水消肿的功效建立风寒表证、风水水肿病位在表的动物模型,并检测CHRM3、CHRM1和PPAR-γ的水平从而进一步探究麻黄的升浮药性潜在靶点。前期研究发现生物碱为麻黄升浮药性的物质基础,且通宣理肺丸药性升浮,而本研究表明药性升浮的麻黄、生物碱组分和通宣理肺丸可显著增加病位在表的风寒表证和风水水肿模型大鼠肺中CHRM3蛋白及mRNA的表达。CHRM3为毒蕈碱型乙酰胆碱受体,乙酰胆碱受体是一种跨膜蛋白受体,结合神经递质乙酰胆碱而起到信号传递的作用。其中M受体主要分布在副交感神经纤维所支配的效应器上,乙酰胆碱作用于M受体时主要表现为心脏活动的抑制、汗腺分泌等[23]。肺主气、司呼吸,肺气的升降出入运动对全身气机具有重要的调节作用。肺主宣发功能可以使津液和水谷精微布散周身,外达皮毛,也可将津液化为汗液排出体外。麻黄通过肺气宣发生理功能发挥其升浮药性可能与CHRM3有关,CHRM3可能为麻黄升浮药性的潜在靶点之一。
根据葶苈子泻肺平喘、利水消肿的功效建立痰饮停聚、肺水病位在里的动物模型从而进一步研究葶苈子沉降药性的潜在靶点。前期研究表明,低聚糖、黄酮苷和脂肪油为葶苈子沉降药性的物质基础[11],药性沉降的葶苈子、低聚糖、黄酮苷和脂肪油可显著增加病位在里的痰饮停聚和肺水模型大鼠肺中PPAR-γ的蛋白及mRNA表达。PPAR-γ是过氧化物酶体增殖物激活受体γ,是核激素受体超家族的一部分,在能量、葡萄糖及脂质代谢,炎症基因表达与脂肪生成等过程中发挥着关键作用[24]。此外,有大量研究表明,PPAR-γ在很多肺部相关疾病如哮喘、肺纤维化和慢性阻塞性肺疾病等过程中也具有重要作用[25]。肺主肃降的生理功能可肃清肺和呼吸道内的异物,保持呼吸道洁净,有利于治疗哮喘和慢性阻塞性肺疾病等疾病。葶苈子通过促肺肃降发挥其沉降药性可能与PPAR-γ有关,PPAR-γ可能是葶苈子沉降药性的潜在靶点之一。
综上,CHRM3可能是麻黄升浮药性的潜在作用靶点之一,PPAR-γ可能是葶苈子沉降药性的潜在作用靶点之一。本研究存在一定局限性,只是针对该靶点的mRNA和蛋白表达水平进行检测,并未对该靶点所产生的效应进行评价。在未来的研究中将通过呼吸系统、消化系统、中枢系统、循环系统等整体评价CHRM3对麻黄升浮药性的影响以及PPAR-γ对葶苈子沉降药性的影响,进一步验证上述观点。
张贝贝,曾梦楠,王亚玺等.基于“顺病位逆病势”的麻黄升浮药性和葶苈子沉降药性潜在靶点研究[J].中医杂志,2023,64(03):303-310.
ZHANG Beibei,ZENG Mengnan,WANG Yaxi,et al.Study on Potential Targets for the Ascending and Floating Nature of Mahuang(Herba Ephedrae)and Descending and Sinking Nature of Tinglizi (Semen Descurainiae seu Lepidii) based on “Conforming to the Location of the Disease and Reversing the Tendency of the Disease”[J].Journal of Traditional Chinese Medicine,2023,64(03):303-310.

