胃癌是世界上常见的恶性肿瘤之一,我国胃癌发病率和病死率均居世界第3位[1]。随着诊疗对策的不断更新,世界范围内胃癌的总体发病率和死亡率已较以往明显下降。但在我国,早期胃癌的检出率低,发现时多为进展期胃癌,即使行根治性切除,仍有不等的复发转移风险,80%以上的胃癌患者最终进入晚期[2],晚期胃癌预后更差,严重危害国民健康。因此有效抑制肿瘤生长是胃癌治疗的重点[3]。
细胞自噬是细胞程序性死亡之一,是细胞通过吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,与溶酶体融合形成自噬溶酶体,以降解细胞内变性及衰老的蛋白或细胞,从而保持细胞稳态的过程[4]。近年来研究显示,自噬是把双刃剑,与细胞坏死、细胞凋亡共同存在[5],在肿瘤的治疗中有重要作用,多项研究证实自噬可抑制细胞增殖,诱导凋亡,表明人工诱导自噬在肿瘤治疗中的潜在效用[6-7]。胃肠安是邱佳信教授及其团队以健脾法为主,辨证结合软坚散结、清热解毒等治法形成的治疗胃癌的中药复方,具有多方面抗肿瘤功效,可抑制胃癌细胞增殖[8-9],抑制侵袭和黏附能力[10-11],调节裸小鼠NK细胞杀伤活性及红细胞免疫功能等作用[12]。但关于胃肠安与肿瘤细胞自噬的关系仍不清楚,因此本研究利用显微镜染色观察自噬小体变化,实时荧光定量聚合酶链式反应(Real-time PCR),蛋白免疫印迹法(Western blot)检测自噬相关标志物的表达变化,从细胞自噬角度来探讨健脾复方胃肠安抗胃癌的潜在作用机制。
1 材料
1.1 细胞株
人胃癌MKN45细胞株由华东理工大学刘建文课题组惠赠,传至第10代。
1.2 药物
胃肠安冻干粉制备,胃肠安方药组成:太子参12 g,炒白术12 g,茯苓30 g,姜半夏9 g,青皮4.5 g,陈皮4.5 g,生牡蛎30 g,夏枯草12 g,红藤30 g,菝葜30 g,白扁豆30 g等组成。单味生药由上海中医药大学附属龙华医院药剂科主任中药师奚燕鉴定为正品。①药物提取,第一煎中药饮片加10倍量水,加热至沸,保持微沸1 h,抽滤,第二煎加8倍量水,加热至沸,保持微沸1 h,抽滤,合并滤液。②药物浓缩,滤液减压浓缩至比重为1.10~1.12(60 ℃)。清膏质量要求,清膏中应澄明、无药渣、焦屑。③喷雾干燥,工艺参数,进风温度160~180 ℃,出风温度95~105 ℃收粉,适时收粉。④混合,喷干粉粉碎过80目筛。过筛所得浸膏粉用V型混合器混合30 min使均匀。⑤制粒,提取物制颗粒,以上制备工艺由江阴天江药业有限公司提供(批号1507342),临用时用磷酸盐缓冲液(PBS)溶解,0.22 μm微孔滤器过滤除菌。5-氟尿嘧啶注射液(5-FU,上海旭东海普药业有限公司,批号090906,0.25 g/支)。
1.3 试剂
RPMI 1640培养基,微管相关蛋白1轻链3(LC3)-Ⅱ,单丹磺酰尸胺(MDC)试剂盒(美国Sigma公司,批号分别为RNBG5440,GR3257983-1,BCBX0277);胎牛血清(美国Gibco公司,批号0270106);酵母ATG6同源物(Beclin1),自噬相关基因5(ATG5),自噬相关基因7(ATG7),β-肌动蛋白(β-actin)单克隆抗体(美国Bioworld公司,批号分别为CC02181,AAD12362,CC66171,AP0060);泛素结合蛋白-1(p62)抗体(华安生物公司,批号HH0718);山羊抗兔辣根过氧化物酶(HRP)标记的二抗,山羊抗鼠HRP标记二抗(美国Bioworld公司,批号均为BS13278);引物由上海闪晶分子生物科技有限公司合成(表1);细胞增殖活性检测(CCK-8)试剂盒(日本同仁公司,批号CK04);吖啶橙试剂[生工生物工程(上海)股份有限公司,批号E613BA0015];SYBR GREEN qPCR Super Mix,总RNA提取试剂盒(日本Toyobo公司,批号分别为836900,831300)。
| 引物 | 序列(5′-3′) | 长度/bp |
|---|---|---|
| LC3-Ⅱ | 上游AGCACCCCAGCAAAATCC | 176 |
| 下游GTTCACCAGCAGGAAGAAGG | ||
| Beclin1 | 上游TGAAAACCAGATGCGTTATGC | 122 |
| 下游CCAGCCTGAAGTTATTGATTGTG | ||
| p62 | 上游ATGAGGAAGATCGCCTTGG | 154 |
| 下游CGGATTCTGGCATCTGTAGG | ||
| ATG5 | 上游CGAGATGTGTGGTTTGGACG | 161 |
| 下游TGTCTCATAACCTTCTGAAAGTGC | ||
| ATG7 | 上游CCTGTGGCATCTGCTGACC | 176 |
| 下游AGGGCTCCTGCAATCACG | ||
| β-actin | 上游TGACGTGGACATCCGCAAAG | 205 |
| 下游CTGGAAGGTGGACAGCGAGG |
1.4 仪器
MCO-18AIC型CO2培养箱(日本Sanyo公司);Cedex XS型细胞计数仪(瑞士Roche公司);AlphaClean 1300型超净工作台(中国香港Heal Force公司);SpectraMax M5型全功能酶标仪(美国MD公司);DMI3000B型荧光倒置显微镜,TCS-SP8型激光共聚焦显微镜(德国Leica公司);StepOne Plus型Real-time PCR分析仪Step One Plus(美国ABI公司);Mini-PROTEAN®Tetra型蛋白垂直电泳系统,Trans-biot®Turbo型转膜仪(美国Bio-Rad公司);EC3 410型化学发光成像系统(美国UVP公司)。
2 方法
2.1 细胞培养
人胃癌MKN45细胞株使用含有10%胎牛血清及1%青霉素-链霉素的培养基培养于37 ℃ 5%CO2的培养箱内,当细胞融合达80%~90%时用0.5%(含EDTA)胰蛋白酶消化传代。2~3 d传代1次,传3代左右后取对数生长期的细胞进行实验。
2.2 CCK-8检测细胞增殖
取对数生长期的MKN45单细胞悬液计数,调整细胞密度至5×104个/mL,接种到96孔板中,培养24 h;每孔中分别加入不同浓度的胃肠安(250,500,1 000,2 000 mg·L-1),空白组加入正常培养液,每组设置5个复孔,培养24,48,72 h;加入CCK-8试剂10 μL,继续孵育2 h,震荡混匀,在450 nm波长下用酶标仪检测其吸光度A,并根据A计算肿瘤细胞的存活率,细胞存活率=A胃肠安组/ A空白组×100%。
2.3 AO染色检测自噬水平
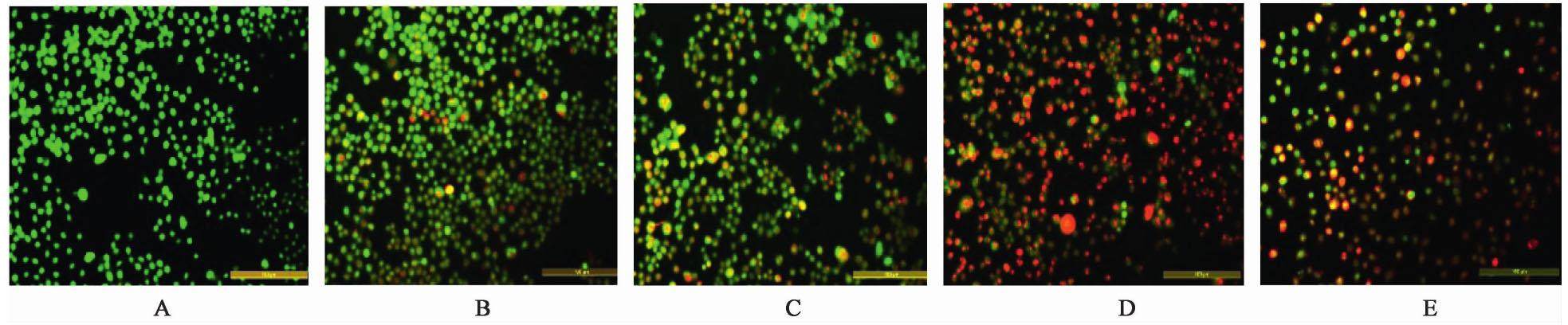
取传代MKN45细胞,以密度5×103个/mL接种于6孔板,于37 ℃ 5%CO2培养24 h,设置空白组,胃肠安低、中、高剂量组和5-FU组,每组设3个复孔,加药培养细胞48 h,吸弃上清,收集各组细胞,用吖啶橙(1 mg·L-1)室温避光染色20 min,离心后弃去染液,用磷酸盐缓冲液(PBS)清洗3次后,荧光显微镜检测荧光信号,FL1通道检测绿色荧光,FL3通道检测红色荧光,以红色荧光的强弱反映细胞内自噬小体的多少。
2.4 MDC染色检测自噬囊泡
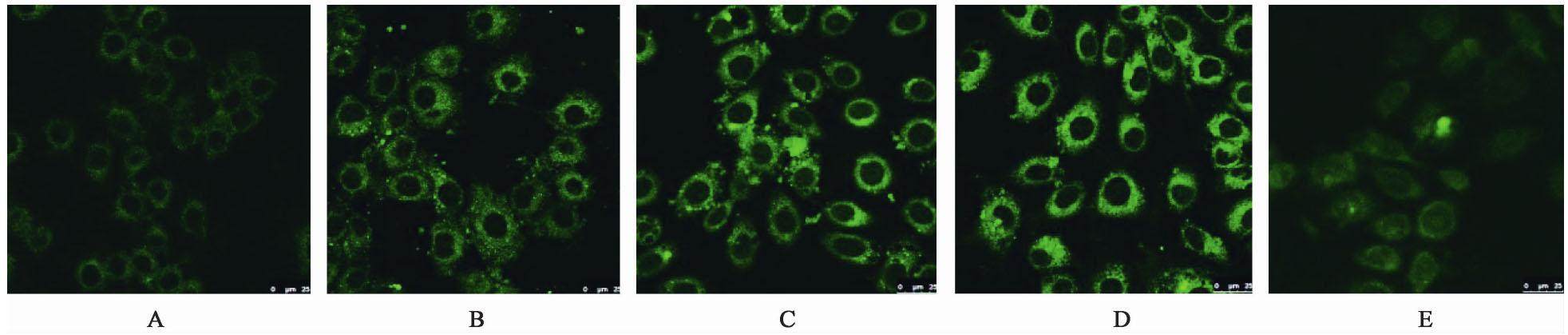
细胞培养、分组及给药同2.3项,加药培养48 h,弃上清液,PBS洗3次,每孔加入4%多聚甲醛1 mL固定10 min,弃上清液,每孔加入终浓度为50 μmol·L-1的MDC染液,于37 ℃培养箱中温育30 min,在激光扫描共聚焦显微镜下观察MKN45细胞中自噬囊泡的变化。
2.5 Real-time PCR检测自噬相关分子mRNA的表达
细胞培养、分组及给药同2.3项,加药培养48 h,弃上清液,收集各组细胞,用trizol试剂提取各组的细胞总RNA,使用RNase-free的DNaseⅠ去基因组。按照逆转录反应试剂盒的说明,每个样本取RNA 1 μL,作为逆转录模板合成cDNA,再以此为模板,按10 μL的反应体系进行PCR反应。反应条件为95 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s,40个循环,每个样本设4个复孔,重复3次。以β-actin为内参,分析扩增曲线,计算样本ΔΔCt,以2-ΔΔCt表示mRNA相对表达。
2.6 Western blot检测自噬相关分子的蛋白水平
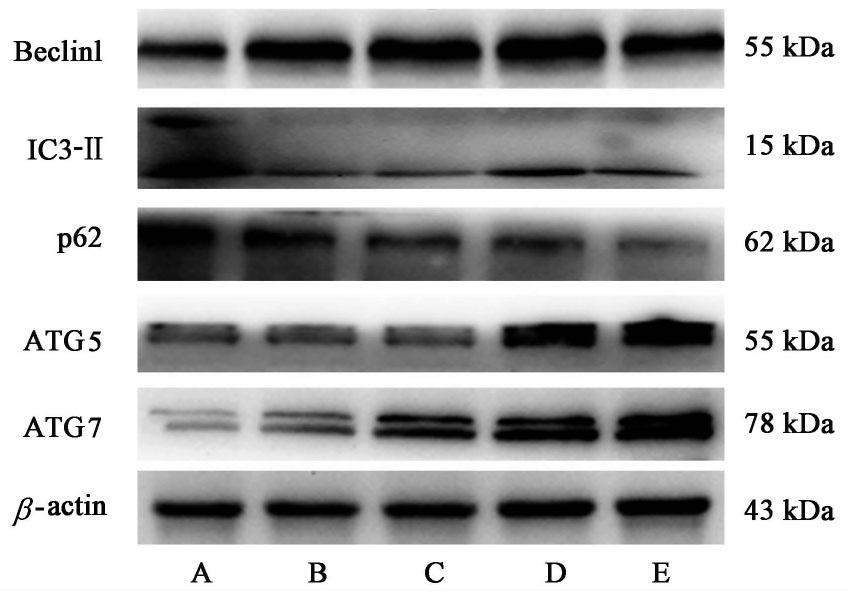
细胞培养、分组及给药同2.3项,加药培养48 h,弃上清液,收集各组细胞,提取不同干预组细胞总蛋白,蛋白浓度测定后,经SDS-PAGE凝胶电泳,80 V恒压20 min,120 V恒压电泳40 min,转移到PVDF膜上,5%脱脂牛奶室温封闭2 h,后加一抗(β-actin,LC3-Ⅱ,Beclin1,p62,ATG5,ATG7,1∶1 000)4 ℃暗盒过夜,TBST洗膜3次,10 min/次。加入相应的二抗37 ℃孵育1 h,TBST洗膜3次,10 min/次,采用ECL荧光底物进行化学发光、显色,于凝胶成像仪拍照,以Image J进行灰度分析。目的蛋白相对表达量=目的蛋白灰度值/同一样本内参灰度值。
2.7 统计学分析
采用SPSS 19.0软件进行数据处理,计量资料采用
3 结果
3.1 胃肠安对MKN45细胞增殖的影响
胃肠安(250,500,1 000,2 000 mg·L-1)作用MKN45细胞24,48,72 h,与空白组比较,随着药物浓度和作用时间增加,胃肠安对MKN45细胞增殖抑制作用逐渐增强,提示胃肠安可抑制MKN45细胞的增殖,采用SPSS 19.0计算胃肠安作用人胃癌MKN45细胞的半数抑制浓度(IC50),为1 014 mg·L-1(48 h),见表2。为进一步观察胃肠安对胃癌MKN45细胞自噬的影响,后续实验采用胃肠安低、中、高剂量组(250,500,1 000 mg·L-1)及空白组,5-FU组(32 mg·L-1)5组[13]进行观察,作用时间为48 h。
| 组别 | 质量浓度/mg·L-1 | 抑制率/% | ||
|---|---|---|---|---|
| 24 h | 48 h | 72 h | ||
| 胃肠安 | 250 | 15.07±3.49 | 15.87±1.231) | 20.5±5.132) |
| 500 | 20.33±1.991) | 40.65±1.312) | 43.77±0.772) | |
| 1 000 | 28.06±1.212) | 51.49±2.672) | 66.21±1.862) | |
| 2 000 | 36.74±1.432) | 64.21±1.752) | 69.33±1.172) | |
3.2 胃肠安对自噬小体的影响
AO染色时AO可进入细胞核中与DNA结合表现为绿色,与自噬溶酶体结合则表现为红色荧光。与空白组比较,胃肠安组出现酸性自噬小体的比例增加,胃肠安高剂量组,5-FU组细胞自噬小体比例均明显高于空白组,胃肠安低、中、高剂量组自噬小体逐渐增加,表明胃肠安可诱导人胃癌MKN45细胞自噬。见图1。
3.3 胃肠安对自噬囊泡的影响
MDC染色时MDC可与自噬溶酶体结合表现出绿色荧光。激光共聚焦显微镜下观察发现,空白组及5-FU组仅有极少量的黄绿色荧光小点-自噬囊泡,胃肠安组细胞中发现大量的荧光小点,说明胃肠安促进自噬囊泡形成数量增加,并呈剂量依赖性方式上调MKN45胃癌细胞的自噬。见图2。
3.4 胃肠安对MKN45细胞中自噬相关mRNA水平的影响
与空白组比较,胃肠安作用MKN45细胞48 h,胃肠安(500,1 000 mg·L-1)组Beclin-1,LC3-Ⅱ mRNA表达上调,p62 mRNA表达下调(P<0.05,P<0.01);胃肠安(1 000 mg·L-1)组ATG5,ATG7 mRNA表达上调(P<0.05),显示胃肠安在mRNA水平诱导MKN45细胞发生自噬。见表3。
| 组别 | 质量浓度/mg·L-1 | LC3Ⅱ | Beclin1 | p62 | ATG5 | ATG7 |
|---|---|---|---|---|---|---|
| 空白 | - | 1.03±0.03 | 1.01±0.08 | 1.06±0.23 | 1.02±0.15 | 1.04±0.05 |
| 胃肠安 | 250 | 0.96±0.11 | 0.97±0.56 | 1.05±0.10 | 1.03±0.02 | 1.06±0.29 |
| 500 | 1.39±0.371) | 1.68±0.291) | 0.82±0.061) | 1.46±0.22 | 1.26±0.08 | |
| 1 000 | 2.20±0.412) | 2.39±0.312) | 0.52±0.052) | 2.27±0.421) | 1.83±0.191) | |
| 5-FU | 32 | 1.58±0.281) | 0.92±0.20 | 1.46±0.132) | 1.98±0.401) | 1.54±0.68 |
3.5 胃肠安对MKN45细胞中自噬相关蛋白的影响
与空白组比较,5-FU组LC3-Ⅱ,ATG5,ATG7蛋白表达上调,p62蛋白表达下调(P<0.01);胃肠安(1 000 mg·L-1)组Beclin1,IC3-Ⅱ,ATG5,ATG7蛋白表达上调,p62蛋白表达降低(P<0.05,P<0.01),显示胃肠安在蛋白质水平诱导MKN45细胞发生自噬。见图3,表4。
| 组别 | 质量浓度/mg·L-1 | LC3-Ⅱ/β-actin | Beclin1/β-actin | p62/β-actin | ATG5/β-actin | ATG7/β-actin |
|---|---|---|---|---|---|---|
| 空白 | - | 0.80±0.14 | 1.03±0.22 | 1.88±0.12 | 1.09±0.12 | 0.49±0.03 |
| 胃肠安 | 250 | 0.82±0.07 | 1.48±0.27 | 1.64±0.081) | 1.05±0.11 | 0.92±0.072) |
| 500 | 1.39±0.091) | 1.64±0.39 | 1.21±0.101) | 1.11±0.07 | 1.54±0.112) | |
| 1 000 | 1.95±0.072) | 1.91±0.341) | 1.19±0.092) | 1.56±0.161) | 1.72±0.172) | |
| 5-FU | 32 | 1.47±0.112) | 1.37±0.35 | 1.01±0.052) | 1.73±0.172) | 1.80±0.212) |
4 讨论
胃癌是一种高度异质性的上皮源性恶性肿瘤,晚期胃癌预后极差。化疗是晚期胃癌的主要治疗措施,有效率一般在40%左右,中位生存时间仅为8.6~13.0个月[14]。近年来,分子靶向药物在胃癌方面运用不断发展,分子靶向药物在晚期胃癌中显示出一定的疗效,但目前仍然十分有限[15-17]。
古代并无胃癌的具体称谓,类似胃癌的证候记载多散在于“噎嗝”“反胃”“胃脘痛”“伏梁”等范畴内。中医药尤其是中药复方作为一种有效的肿瘤防治手段,其作用机制是多靶点、多途径的[16]。胃肠安方是邱佳信教授及其团队以健脾法为主,辨证结合软坚散结、清热解毒等治法形成了治疗胃癌的中药复方,运用于临床实践已30余年。方中以太子参、白术、茯苓、白扁豆等共为君药,针对脾胃虚弱的主要病机,发挥健脾理气之功效;红藤、菝葜等起佐使作用;牡蛎、夏枯草软坚化痰,姜半夏、青陈皮等和胃理气,起到辅助作用,全方共奏健脾理气、清热解毒、软坚化痰之效,多项多中心同期病例对照研究均证明了健脾复方胃肠安具有明确的临床疗效[18-19]。
自噬又称Ⅱ型程序化细胞死亡,以出现自噬体为基本特征[20]。自噬极为复杂且高度保守,受一系列自噬相关基因的调控,其中LC3是酵母的ATG8基因的同源物,是参与自噬调节的关键基因,LC3有LC3-Ⅰ和LC3-Ⅱ两存在形式,自噬发生时,LC3-Ⅰ的C端经过泛素样系统(包括ATG7和ATG3)的脂化形成LC3-Ⅱ,并参与自噬体的形成[21],Ⅱ型LC3表达的水平可以反映细胞自噬活性;Beclin1是自噬开启阶段不可或缺的基因,主要通过与PI3K形成复合体,从而促进自噬起始囊泡的形成[22];p62是自噬降解的一种选择性底物蛋白,与自噬呈负性相关。发生自噬时p62等泛素化蛋白在自噬体膜上与ATG8/LC3结合,以靶向自噬体进行降解[23];在自噬缺陷条件下p62表达上调,从而造成DNA损伤而产生肿瘤;ATG5和ATG7是自噬上游的关键蛋白,可抵抗细胞毒、帮助细胞减轻应激作用[24]。自噬是去除细胞内衰老破损的细胞器及过量沉积的蛋白质,维持机体正常的生理活动,广泛存在于生物体内,自噬功能低下将导致衰老的细胞器及蛋白质片段过量沉积,气虚则细胞生理活动减退,导致自噬过度或不足,出现一系列病理变化,自噬发生发展过程与中医认为的“气虚则邪实内生”相吻合[25],虚是胃癌形成的基础,痰、瘀、火、毒日久留而不去则聚成癌毒,是胃癌形成的关键因素,中医药治疗肿瘤强调整体观和辨证论治,补益脾胃,扶正培元是维持胃癌病态平衡、带瘤生存及延长生命的重要法则,这与肿瘤细胞自噬的机制和意义一致。
本实验首先观察了胃肠安对胃癌细胞株MKN45增殖的影响,与前期胃肠安可抑制细胞生长的研究结果一致[8]。有报道表明,多种抗肿瘤中药复方及单体在抑制增殖的同时会诱导细胞保护性自噬[26-27],自噬的特征表现是胞质内大量的酸性自噬小体形成,这些酸性自噬小体吞噬了细胞质和(或)细胞器后,经AO染色呈现亮红色荧光,MDC染色发现自噬囊泡增加,初步证实了胃肠安作用MKN45细胞后,细胞自噬增加。实验结果显示,胃肠安干预后LC3-Ⅱ,Beclin1,ATG5,ATG7 mRNA和蛋白表达上调,诱导MKN45细胞自噬发生从而抑制胃癌细胞增殖。
然而,中药复方的药味多,成分复杂多样,而且作用机制和靶点不一,即使同一中药复方在不同肿瘤类型或细胞株中亦可能有不同的自噬调节作用[28],而且自噬作为细胞对内外刺激的一种应激反应机制,本身与凋亡之间存在着丰富的交叉网,如某些药物诱导的保护性自噬会减轻凋亡的作用,抑制这些自噬有可能会减轻治疗抵抗。比较中药单体、复方在抗肿瘤的作用及机制方面存在着较大争议,以及自噬本身的复杂性及双向性,因此,进行更深入的研究以明确胃肠安对胃癌自噬的影响将是下一步研究的方向。
CRITICS-Ⅱ: a multicentre randomised phase Ⅱ trial of neo-adjuvant chemotherapy followed by surgery versus neo-adjuvant chemotherapy and subsequent chemoradiotherapy followed by surgery versus neo-adjuvant chemoradiotherapy followed by surgery in resectable gastric cancer
[J].BMC Cancer,2018, 18(1):877.
