由结核分枝杆菌(MTB)感染的结核病(TB)仍然是危害人类健康的主要传染性疾病之一[1]。耐多药结核病(MDR-TB)一直是全球结核病控制的难点[2]。2017年全球新发MDR-TB 46万例,我国是全球30个MDR-TB高负担国家之一,MDR-TB的治疗非常困难,成功率仅为50%左右[1,3],因此,抗结核新药的研制迫在眉睫。抗结核化学药物往往靶向MTB本身,很容易出现耐药问题[4-5]。加上肝损伤的发生率高,贻误抗结核治疗致病情恶化而死亡,或发生肝衰竭死亡的严重后果[6]。目前,MDR-TB的治疗陷入困境,面临严重的挑战。细胞自噬(Autophagy)已成为研究的热点[7]。巨噬细胞自噬在MTB感染中是一种重要的免疫调控机制[8],在宿主防御TB感染过程中发挥重要的作用[9],促进自噬可以产生强效杀灭MTB的效应,诱导自噬可作为治疗TB的有效手段[10]。这种以调节免疫应答的宿主靶向治疗方法[11],可以破解药物产生细菌耐药的难题[5]。对于MDR-TB,能够诱导自噬的免疫治疗提供了一种新的解决的方法。
月华胶囊源于月华丸,月华丸是清代医家程钟龄所制,为中医抗痨名方。由天冬、麦冬、熟地黄、生地黄、山药、百部、沙参、川贝母、阿胶各一两,茯苓、獭肝、三七粉各五钱,白菊花、霜桑叶各二两组成;功用滋阴润肺,宁嗽杀虫;主治肺肾阴虚之由痨瘵久嗽及久咳或痰中带血而致。研究发现,月华胶囊体外对MDR-TB有抑菌效力[12];对MDR-TB鼠,能调控T淋巴细胞亚群CD4+,CD4+/CD8+,及其γ-干扰素(IFN-γ),白细胞介素(IL)-2,IL-10和肿瘤坏死因子(TNF)-α的失衡[13];对异烟肼、利福平合用所致的大鼠肝损伤具有保护作用[14]。本文研究月华胶囊对MDR-TB巨噬细胞自噬的影响及其机制,为月华胶囊治疗MDR-TB的研发利用提供依据和支持。
1 材料
1.1 动物、细胞及细菌株
12只SPF级雄性SD大鼠,体质量(200±10) g,由湖南斯莱克景达实验动物有限公司提供,合格证号SCXK(湘)2016-0004。小鼠单核巨噬细胞RAW264.7,源于美国生物资源中心(ATCC),由中南大学湘雅医学院医学实验细胞中心提供。耐多药结核分支杆菌由原湖南省结核病防治所提供,菌型鉴定为人型,编号478,药敏培养为对异烟肼、利福平、链霉素、乙胺丁醇、利福喷丁多种化疗药产生耐药,保存于湖南中医药大学病原微生物和免疫实验室。
1.2 药物
月华胶囊与月华丸组成一致,由天冬、麦冬、熟地黄、生地黄、山药、百部、沙参、川贝母、阿胶,茯苓、三七粉、白及、白菊花、霜桑叶组成,依原著用量,按2∶2∶2∶2∶2∶2∶2∶2∶2∶1∶1∶1∶4∶4比例配伍。所有中药饮片均购自湖南中医药大学附属第一医院中药房同一批次,并经湖南中医药大学中药教研室吴红娟教授做生药材鉴定。将中药饮片除阿胶外洗净,浸泡12 h,加水煎煮3次,中药与水的比例及煎煮的时间分别为第1次1∶8,煎煮3 h,在煎煮完成前20 min时加入菊花、桑叶;第2次1∶6,煎煮2 h;第3次1∶4,煎煮1 h。合并煎液,滤过,于水浴锅浓缩至药液用玻璃棒挑起呈“挂旗状”,再加入已隔水烊化好的阿胶,搅拌均匀,以-20 ℃低温冷冻干燥至固化浸膏,4 ℃储存备用,粉碎入胶囊,即为月华胶囊。3-甲基腺嘌呤(3-MA),雷帕霉素(Rap)(美国Sigma公司,批号分别为IPA1009-0010MG,IPA1021-0100MG)。
1.3 试剂
无酚红高糖完全培养基(DMEM)培养液,胰蛋白酶,胎牛血清(美国Gibco公司,批号分别为21063-029,25200-056,16140-0890);细胞增殖及毒性检测试剂盒-8(CCK-8),免疫球蛋白(Ig)G(碧云天生物科技有限公司,批号分别为C0038,A0562);BCA蛋白定量分析试剂盒,cDNA逆转录试剂盒(北京索莱宝科技有限公司,批号分别为P0012,TQ2501-02);RIPA细胞裂解液(上海奥威生物科技有限公司,批号P0013);Middlebrook 7H9液体培养基,Middlebrook OADC增菌液(美国BD公司,批号分别为271310,212351);B型微管相关蛋白轻链3(LC3-Ⅱ)一抗(北京百奥莱博科技有限公司,批号YT816);兔抗鼠LC3-Ⅰ单克隆抗体,兔抗鼠Beclin 1单克隆抗体,鼠抗β-肌动蛋白(β-actin)单克隆抗体,辣根过氧化物酶(HRP)标记羊抗兔二抗(美国Santa Cruz公司,批号分别为ABM-0004,ABM-0003,ABM-0001,ABP114/103);DAB显色试剂盒(上海贝博生物科技公司,批号BB-3503BestBio);trizol(上海联硕生物科技公司,批号15596026)。
1.4 仪器
MC0-18M型CO2培养箱(日本Sanyo公司);BacT/ALERT MP120型微生物快速培养监测系统(法国梅里埃公司);JEOL-1230型透射电镜(日本电子株式会社);BX51型荧光显微镜(日本Olympus公司);Synergy 4型全自动型酶联免疫检测仪,ELX800型多功能酶标仪,CFX96型荧光定量PCR仪,Mini-Protean TetraSDS-PAGE型垂直电泳及转膜设备(美国BioTek公司);NanoDrop2000型超微量分光光度计(美国Thermo公司)。
2 方法
2.1 月华胶囊含药血清的制备
将实验用大鼠共12只,先按体质量分层,再按随机数字表法分为正常组和月华胶囊组,每组6只。月华胶囊组大鼠,按人与大鼠体表面积折算得临床等效剂量,以3.02 g·kg-1灌胃给药;正常组给予等溶剂量的蒸馏水。每天1次,连续灌胃7 d。大鼠第7天灌胃后1 h,无菌条件下两组动物分别腹主动脉取血,3 000 r·min-1离心15 min取血清,同组血清混合置于离心管中,0.22 μm滤器过滤,分装,-20 ℃保存备用。
2.2 细胞培养
将RAW264.7细胞按常规复苏,然后将混匀的细胞液移至装有10%胎牛血清DMEM培养基的细胞培养瓶中,置37 ℃ 5%CO2培养箱中培养;24 h倒置式生物显微镜下观察细胞的贴壁状况,待细胞生长融合至80%左右,即传代备用。
2.3 含药血清有效浓度的选择
将所取得的月华胶囊含药血清、正常组血清,用无酚红的高糖DMEM培养基分别稀释为5%,10%,20%,40%的不同体积分数浓度组,96孔培养板,分别加入各孔RAW264.7细胞中;并设无细胞空白组。每组5个复孔,重复3次。37 ℃ 5% CO2孵育24 h后,每孔加入CCK-8 10 μL,37 ℃ 5% CO2继续孵育3 h后,于酶标仪450 nm处测定吸光度A,计算细胞增殖率。
2.4 菌悬液制备
在生物安全柜中,将MTB接种于Middlebrook 7H9液体培养基,接种后的培养瓶于微生物快速培养监测系统内行快速液体培养,取3周培养物,用0.05% Tween80/PBS充分吹散成菌悬液,用细菌浓度比浊仪测定其浊度,配制成1×105个/mL的菌悬液,备用。
2.5 细胞分组、感染及干预
将RAW264.7细胞调整细胞密度为1×107个/mL,并随机分为5组,每孔2 mL铺于24孔板中,每组5复孔,重复3次。分别为模型组:每孔加不含抗生素的10%胎牛血清DMEM培养液,培养24 h;月华胶囊含药血清组:每孔以终体积分数10%月华胶囊含药血清的DMEM培养液(不加抗生素与胎牛血清)培养,作用24 h;自噬抑制剂3-MA+月华胶囊含药血清组:每孔加入配成终质量浓度为5 mg·L-1的3-MA和终体积分数10%月华胶囊含药血清的DMEM(不加抗生素与胎牛血清)培养液培养,作用24 h;Rap组:每孔加入配成终质量浓度为200 mg·L-1 Rap和终质量浓度10%胎牛血清DMEM培养液培养,作用24 h。以上各组均置37 ℃ 5% CO2环境细胞培养箱中培养,按各组作用时间满足后,每组每孔分别按照细胞:细菌个数比为1∶10的比例加入耐多药结核分支杆菌,感染4 h,PBS洗细胞4次,清除未被细胞吞噬的耐多药结核分支杆菌,加入不含抗生素的10%胎牛血清DMEM培养液继续37 ℃ 5% CO2培养4 d。依法使细胞成为均匀的单细胞悬液后,收集细胞。另设正常组,含10%胎牛血清DMEM培养液,培养时间同其他组。
2.6 指标检测
2.6.1 透射电镜观察自噬体
收集待测各组细胞悬液置于洁净1.5 mL离心管,加入冰预冷的PBS,1 000 r·min-1离心5 min,洗涤细胞2次;调整细胞密度1×107个/mL,再用冰预冷的PBS洗涤1次,每管细胞加入固定液(2.5%戊二醛)1 mL,4 ℃固定过夜,JEOL-1230透射式电镜显微镜下观测。
2.6.2 蛋白免疫印迹法(Western blot)检测LC3,Beclin-1蛋白的表达
分别收集各组细胞,弃去培养基,用预冷的PBS洗涤1次,收集细胞于离心管1 000 r·min-1离心5 min,于冰上裂解细胞10 min,裂解液转入1.5 mL离心管,4 ℃以下12 000 ×g离心5 min,取上清。用BCA蛋白浓度测定试剂盒测定出蛋白浓度。将每组含50 μg蛋白质标本注入加样孔电泳,依法经SDS-PAGE分离,以湿转法电转移动至PVDF膜。加入LC3单克隆抗体(1∶1 000),兔抗鼠Beclin-1(1∶1 000),β-actin的一抗(1∶1 000),加入二抗(1∶5 000)孵育,增强型DAB显影液进行显色反应。使用Image J图象分析各条带灰度值,计算LC3-Ⅱ/LC3-Ⅰ及Beclin-1/β-actin的值。
2.6.3 间接免疫荧光法观察LC3B的荧光颗粒或斑点
将实验各组待测细胞接种到含有细胞爬片的6孔培养板中,37 ℃ 5%CO2环境中孵育12 h,细胞生长约80%融合时,弃掉培养液,用PBS洗3次,每次5 min,各孔分别先后依法加入多聚甲醛固定,5 mL·L-1 Triton X-100通透后,采用10 g·L-1BSA封闭1 h,去封闭液,洗涤后每孔加入LC3B一抗(1∶400),37 ℃孵育1 h。回收一抗,洗涤后,加入二抗(1∶500),避光室温1 h,回收二抗,洗涤。最后加入DAPI作用5 min,洗涤,加抗荧光淬灭剂,封片,荧光显微镜下观察。
2.6.4 实时荧光定量聚合酶链式反应(Real-time PCR)检测Beclin-1,LC3 mRNA的表达
将分组的各孔培养细胞用trizol法提取细胞的总RNA,以超微量分光光度计测定RNA浓度。按照cDNA逆转录试剂盒方法进行cDNA的合成,后加入PCR仪中37 ℃孵育50 min,70 ℃孵育15 min后终止反应。以逆转录的cDNA为模板,采用Real-time PCR反应方法,测定自噬相关基因LC3,Beclin-1的mRNA的表达,以β-actin和甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,LC3,Beclin-1,β-actin和GAPDH引物序列见表1。PCR反应经退火温度优化,步骤确定为94 ℃ 2 min起始模板变性,94 ℃ 15 s循环中模板变性,58 ℃ 30 s退火,68 ℃ 1 min延伸,共40个循环。采用2-ΔΔCt法计算各组细胞LC3,Beclin-1的mRNA表达水平。
| 引物 | 序列 | 长度/bp |
|---|---|---|
| LC3 | 上游5′-CCACACCCAAAGTCCTCACT-3′ | 220 |
| 下游5′-CACTGCTGCTTTCCGTAACA-3′ | ||
| Beclin-1 | 上游5′-ACAGTGGACAGTTTGGCACA-3′ | 283 |
| 下游5′-CGGCAGCTCCTTAGATTTGT-3′ | ||
| β-actin | 上游5′-TGACGGGGTCACCCACACTGTGCCCATCTA-3′ | 661 |
| 下游5′-CTAGAAGCATTTGCGGTGGACGATGGA-3′ | ||
| GAPDH | 上游5′-GTCTTCACCACCATGGAG-3′ | 494 |
| 下游5′-CCAAAGTTGTCATGGATGACC-3′ |
2.7 统计学方法
采用SPSS 19.0统计学软件进行数据处理,计量资料以
3 结果
3.1 对RAW264.7细胞增殖率的影响
与正常组比较,5%,10%,20%,40%不同体积分数的月华胶囊含药血清均能使RAW264.7细胞增殖率有所增加,且在5%~40%与浓度呈正相关,无明显细胞毒性反应,其中10%,20%,40%浓度含药血清增殖率明显升高(P<0.05);月华胶囊含药血清不同体积分数组间比较,细胞增殖率随浓度的增加而升高。考虑到血清、血药的浓度太高可能会影响到实验的客观性,且又要与相关含10%胎牛血清的DMEM培养条件中血清浓度相一致,故选择10%的月华胶囊含药血清作为对MDR-TB感染RAW264.7细胞的药效干预浓度。见表2。
| 组别 | 体积分数/% | A( |
增殖率/% |
|---|---|---|---|
| 正常 | 40 | 0.256±0.002 | - |
| 20 | 0.259±0.009 | - | |
| 10 | 0.255±0.006 | - | |
| 5 | 0.252±0.004 | - | |
| 月华胶囊含药血清 | 40 | 0.361±0.0021) | 40.581) |
| 20 | 0.340±0.0101) | 31.271) | |
| 10 | 0.280±0.0071) | 9.801) | |
| 5 | 0.254±0.004 | 0.78 |
3.2 对MDR-TB感染小鼠RAW264.7自噬体的影响
与正常组比较,模型组未见有自噬体出现。与模型组比较,10%月华胶囊含药血清组及Rap组细胞中,均可观察到自噬小体的出现和形成,胞浆中出现闭合的双层膜的囊泡状结构,呈杯口状或变形延伸,包裹着线粒体、内质网等胞浆成分;3-MA+10%月华胶囊含药血清组细胞,没有发现自噬体。见图1。

3.3 对MDR-TB感染RAW264.7细胞LC3,Beclin-1蛋白表达的影响
与正常组比较,模型组细胞LC-3Ⅱ/β-actin,LC-3Ⅱ/LC-3Ⅰ,Beclin-1/β-actin均无明显改变;与模型组比较,10%月华胶囊含药血清组,Rap组细胞的LC-3Ⅱ/β-actin,LC-3Ⅱ/LC-3Ⅰ,Beclin-1蛋白表达均明显升高(P<0.05);3-MA+10%月华胶囊含药血清组LC-3Ⅱ,LC-3Ⅱ/LC-3Ⅰ,Beclin-1蛋白表达均无明显增加;与10%月华胶囊含药血清组比较,Rap组Beclin-1/β-actin明显增加(P<0.05)。见图2,表3。

| 组别 | LC-3Ⅱ/β-actin | LC-3Ⅰ/β-actin | LC-3Ⅱ/LC-3Ⅰ | Beclin-1/β-actin |
|---|---|---|---|---|
| 正常 | 0.90±0.02 | 1.51±0.04 | 0.59±0.03 | 0.93±0.08 |
| 模型 | 0.92±0.03 | 1.41±0.04 | 0.65±0.03 | 1.14±0.08 |
| 月华胶囊含药血清 | 1.25±0.031) | 0.95±0.04 | 1.32±0.041) | 3.19±0.102) |
| Rap | 1.39±0.051) | 0.93±0.06 | 1.49±0.061) | 3.87±0.142,4) |
| 3-MA+月华胶囊含药血清 | 1.06±0.03 | 1.38±0.04 | 0.76±0.04 | 1.13±0.11 |
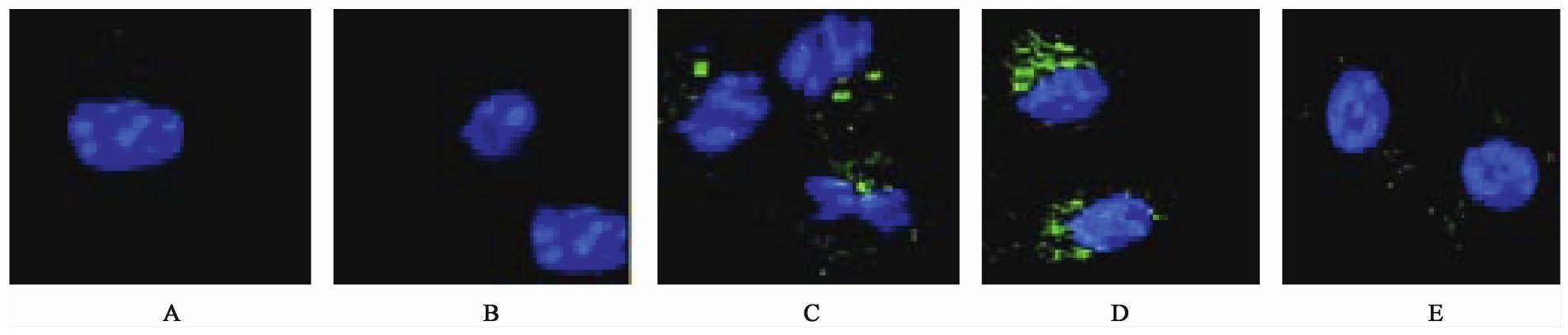
3.4 对MDR-TB感染RAW264.7细胞LC3B的影响
与正常组比较,模型组细胞未见黄(绿)色荧光颗粒或斑点出现,无荧光。与模型组比较,10%月华胶囊含药血清组细胞,黄(绿)色荧光颗粒和荧光斑点明显增加,荧光明亮,Rap组细胞,黄(绿)色荧光颗粒和荧光斑点增加非常明显,荧光闪亮,可判其细胞荧光呈现为阳性;3-MA+10%月华胶囊含药血清组细胞,未见黄(绿)色荧光颗粒或斑点明显增多,极弱的可疑荧光。表明月华胶囊含药血清、自噬诱导剂Rap细胞浆中LC3B蛋白颗粒明显增加,并进行聚集,以斑点的形式表现出来,斑点的数量可表示自噬体的多少。见图3。
3.5 对MDR-TB感染RAW264.7细胞LC3,Beclin-1 mRNA表达的影响
与正常组比较,模型组细胞中LC3,Beclin-1 mRNA表达无明显变化;与模型组比较,10%月华胶囊含药血清组,Rap组细胞中LC3,Beclin-1 mRNA明显升高(P<0.05),3-MA+10%月华胶囊含药血清组细胞中LC3,Beclin-1 mRNA无明显变化;与月华胶囊含药血清组比较,Rap组Beclin-1 mRNA表达明显升高(P<0.05)。见表4。
| 组别 | Beclin-1 | LC3 |
|---|---|---|
| 正常 | 0.58±0.34 | 0.62±0.39 |
| 模型 | 0.74±0.50 | 0.79±0.54 |
| 月华胶囊含药血清 | 3.06±0.371) | 3.21±0.411) |
| Rap | 4.24±0.391,2) | 3.88±0.421,2) |
| 3-MA+月华胶囊含药血清 | 0.92±0.54 | 0.89±0.47 |
4 讨论
自噬是一种进化上高度保守的细胞内稳态的过程,在维持细胞能量稳定、细胞分化及器官发育、炎症及免疫调节方面发挥着重要的作用[15]。自噬可分为巨自噬、微自噬、分子伴侣介导的自噬3种形式,而巨自噬则指传统的细胞自噬,是最主要的自噬形式[16]。细胞自噬分为自噬前体的形成、自噬体的形成、自噬溶酶体的形成以及自噬溶酶体的降解的系列过程,其中自噬体的形成是细胞发生自噬的标志[17]。
自噬相关蛋白参与调节自噬起始和延伸等过程。LC3是第一个被发现的自噬体标志蛋白,参与自噬体隔离膜的形成,是细胞自噬信号通路最为关键的蛋白,被认为是判断自噬形成的标志[18-19]。LC3在细胞中以2种形式存在,LC3-Ⅰ存在于胞质中,自噬形成时,胞浆型LC3-Ⅰ经泛素样加工修饰,与自噬膜表面的磷脂酰乙醇胺结合,会转变为自噬体膜型的LC3-Ⅱ,经过加工修饰的LC3-Ⅱ则始终定位于自噬体膜上[20]。因此,LC3-Ⅱ为自噬体膜特征性蛋白,其含量的多少与自噬体数量的多少成正比,LC3-Ⅱ的表达强度以及LC3-I向LC3-Ⅱ转化的比例,均可以作为衡量自噬水平的高低和自噬活性的指标;又LC3蛋白家族包括LC3A,LC3B,LC3C等亚家族,其中对于LC3B的研究最为广泛[21]。自噬时,LC3B聚集在自噬体膜上,使用LC3B可追踪自噬过程。Beclin-1是与酵母ATG6同源的哺乳动物自噬基因,是自噬体形成的必需分子,可介导其他自噬蛋白定位于吞噬泡,进而调控自噬体的形成及成熟[22]。Rap可通过抑制内源性mTOR活性而激活自噬,是常用的自噬诱导剂。3-MA是Ⅲ类磷脂酰肌醇3-激酶抑制剂,可阻断自噬体形成,是广泛使用的自噬抑制剂。
TB是MTB引起的慢性细胞内感染,MTB是TB致病病原菌,其特征是高感染率和低根除率。MTB是兼性胞内微生物,入侵机体后被巨噬细胞所吞噬,未被机体免疫系统清除而潜伏下来的MTB也主要寄生于巨噬细胞内长期存活。因此巨噬细胞是MTB的主要靶细胞,也是机体的主要应激、防御细胞。细胞自噬在胞内致病性MTB感染的防御机制方面发挥着重要作用,自噬体形成后可与溶酶体融合,并借助于溶酶体酸性环境降解入侵的MTB,达到免疫防御的目的,被认为可能是对抗菌胞内感染最有效的武器之一。但细胞自噬又是一把“双刃剑”,一方面,宿主感受MTB感染产生调节自噬的免疫应答因子,这样胞内感染性MTB在逃脱非吞噬细胞的内吞作用之后,可以被自噬作用内化、降解,从而促进细胞对其的清除作用以对抗感染;另一方面,胞内感染性MTB通过各种因子抑制宿主细胞自噬,以达到免疫逃逸而利于其胞内生存;耐药结核菌(DR-TB)感染时,免疫应答更低[23]。
最近针对MDR-TB,通过调节宿主对结核病的应答反应,即宿主定向治疗,学者们开发或引进新的疗法;对于MDR-TB来说,自噬是一种细胞内的分解代谢过程,可以通过溶酶体降解过程帮助维持稳态并清除入侵的病原体,并通过自噬来加强对MDR-TB感染的抗菌防御;多种药物或药剂激活自噬可能是一种有希望的治疗MTB感染的策略,即使是抗药性菌株[24-26]。
月华胶囊以天冬、麦冬、熟地黄、生地黄为君药,大力滋阴补肺,金水相生。沙参、阿胶、贝母辅以为臣,加强滋补而能止血,且润肺化痰。故以茯苓、山药健脾益中,培土生金;加上三七止血化瘀与阿胶同用而善治咳血,并使血止而不留瘀;五药共为佐药。桑叶、菊花能清肺止咳,气清上浮,主入肺经,用为佐使[27]。全方合用共奏滋阴润燥,宁嗽止血,杀虫护肺之功,体现了“痨瘵”“一则杀其虫以绝根本,一则补其虚以复其真元”的治疗原则。相比其他同类方剂滋补养阴之力强,为治肺肾阴虚,痨瘵久嗽之要方[28]。月华丸为传统抗痨名方,因其效用兼全,力量大,且独具有杀痨虫之功,为治结核的特效方[29]。
本次月华胶囊含药血清对MDR-TB感染RAW264.7细胞的实验研究,结果显示月华胶囊能激发感染巨噬细胞自噬的发生,有效地促进自噬体的形成;能调控自噬相关蛋白及其基因的表达量和表达水平。促进自噬关键蛋白并定位于自噬体膜之LC3及其LC3-Ⅱ表达量的增加,使LC3-Ⅱ/LC3-I增加,LC3-I趋向LC3-Ⅱ的转化加快,增加其表达强度;使细胞胞浆中LC3B蛋白颗粒明显增多,并进行聚集。促进和提高自噬体形成和成熟的必需分子Beclin-1及其mRNA的表达水平。表明月华胶囊能提高MDR-TB感染巨噬细胞自噬的水平和增强细胞自噬的活力。这种良性的、有效性的自噬可以促进感染MTB,尤其是MDR-TB巨噬细胞内吞噬体的成熟,从而破坏MTB,MDR-TB的免疫逃逸机制,通过自噬体形成后与溶酶体的融合,并借助于溶酶体酸性环境降解入侵的MTB,达到免疫防御的目的。
如此,月华胶囊将通过自噬定向方法的免疫有效应答作用在抗MDR-TB的治疗中提供创新性的改进。月华胶囊激发自噬的具体信号通路途径及对自噬流多步骤的全程跟踪及其量效探讨等还应更进一步地深入和全面展开。本研究为月华丸临床治疗难治性的耐多药结核病提供了比较好的理论基础和依据,对指导耐多药结核的中西结合综合治疗方案中月华胶囊的运用,进行了现代研究的论证和支撑。

