人骨髓间充质干细胞(BMSCs)是存在于骨髓当中、具有多向分化潜能的干细胞,能调节造血干细胞的增殖和分化,因此对于维持骨髓造血微环境的稳定具有重要意义[1-2]。甲醛作为一种环境污染物对机体多种细胞具有毒性作用,有报道甲醛不但可以诱发人骨髓血祖细胞和小鼠骨髓中嗜多染红细胞的染色体损伤程度增加,也可诱发鼠BMSCs微核形成及姐妹染色单体互换(SCE)频率的升高[3-5]。因此,甲醛通过对骨髓造血系统产生毒性损伤,从而影响骨髓的正常造血,可能导致白血病的发生。
黄芪具有补气升阳、益卫固表、利尿消肿、托毒生肌之功效,始载于《神农本草经》,谓其“主痈疽,久败疮,排脓,止痛,大风癞疾,五痔,鼠瘘”,列于上品,是常用补益药之一。我国临床常用于各类中晚期癌症患者的扶正固本方剂中,如当归补血汤、补中益气汤等,对提高患者近期、远期疗效都有益处。近年来,国内对其主要活性成分——黄芪多糖(APS)抗肿瘤作用的研究较为活跃[6-7],但其在白血病方面,尤其对甲醛的毒性防护作用少有报道。本研究用APS多糖干预甲醛环境中的人BMSCs,通过检测微核形成及姐妹染色单体互换频率来研究APS的保护作用,并试图从分子水平探讨APS的作用机制,为黄芪防护甲醛对机体的毒性作用提供实验依据。
1 材料
1.1 细胞株
人骨髓间充质干细胞(BMSCs)购自于美国Cyagen Biosciences公司,批号HUXMA-01001。
1.2 药物与试剂
APS(北京索莱宝科技有限公司,批号SA9790,质量分数≥98%);甲醛(美国Sigma公司,批号47608,质量分数37%);人BMSCs完全培养基,ECL超敏发光液(美国Cyagen Biosciences公司,批号分别为HUXMA-90011,HM30A-LB);秋水仙素,Giemsa,Brdu(北京索莱宝科技有限公司,批号分别为SC8400,G8220,B8010);增殖细胞核抗原(PCNA),着色性干皮病基因D,F,G(XPD,XPF,XPG),甘油醛-3-磷酸脱氢酶(GAPDH)抗体,山羊抗兔免疫球蛋白(Ig)G(江苏睿瀛生物有限公司,批号分别为RLM3031,RLN0325,RLT1615,RLT4915,RLM3029,RS0007);XPB(美国CST公司,批号8746);Western及IP细胞裂解液(上海碧云天生物技术有限公司,批号P0013);PVDF膜(美国Millipore公司,批号IPVH00010);trizol总RNA提取试剂盒,第一链cDNA Synthesis Kit,2倍SYBR Green qPCR mix(德国Qiagen公司,批号分别为74106,205311,330502)。
1.3 仪器
MCO-18AIC型CO2细胞培养箱(日本三洋电机公司);BX51型倒置式基础型相差显微镜及成像系统(日本奥林巴斯株式会社);CFX96™型实时荧光定量聚合酶链式反应(Real-time PCR)仪,Chemi DOC XRS+型凝胶成像系统,Mini Protean Tetra Cell Mini Trans-blot cell型蛋白核酸凝胶电泳转印系统(美国Bio-Rad公司)。
2 方法
2.1 细胞培养及分组
人BMSCs专用完全培养基,置于5%CO2 37 ℃饱和湿度的培养箱中培养。每2~3 d换1次液,待细胞达到80%~90%融合时,0.25%胰酶消化传代,第5代细胞用于实验。实验分为空白组,甲醛组,APS 40,100,400 mg·L-1组。空白组用BMSCs专用完全培养基,甲醛组用含终质量浓度为120 μmol·L-1甲醛的BMSCs专用完全培养基,APS组用含终浓度为40,100,400 mg·L-1 APS和120 μmol·L-1甲醛的BMSCs专用完全培养基,培养24 h后进行后续实验。APS组给药质量浓度根据细胞增殖活性结果进行确定,40 mg·L-1 APS开始促进BMSCs增殖,400 mg·L-1 APS开始抑制细胞增殖。
2.2 微核实验
胰酶消化、收集细胞,KCl溶液低渗3 min,固定,滴片,Giemsa染色。每张玻片随机观察细胞1 000个,细胞中含有的微核多数呈圆形,边缘光滑整齐,直径为主核的1/16~1/3,无折光性,与主核不相连,嗜色性与核质一致,呈紫红色或蓝紫色,一个细胞内可以出现1个或多个微核。统计出现微核的细胞数目,微核细胞率(‰)=具有微核的细胞总数/观察细胞总数×1 000‰。
2.3 姐妹染色单体互换实验(SCE)
细胞分组培养24 h后,加入终质量浓度为10 mg·L-1 BrdU继续避光培养48 h,秋水仙碱终止培养,胰酶消化、收集细胞。加入KCl溶液低渗20 min,固定、滴片,紫外灯照射30 min后,Giemsa染色。选择染色体分散和差别染色良好、数目为46条的中期分裂相进行拍照和观察计数,凡在染色体端部出现的交换计为1个SCE,中部出现的交换计为2个SCE,着丝粒处发生的交换在判明不是2个染色单体扭转者计为1个SCE。各组计数20个中期分裂相,SCE交换频率(次/中期分裂相)=SCE总交换次数/中期分裂相数。
2.4 Real-time PCR检测PCNA,XPB,XPD,XPF和XPG mRNA表达情况
细胞分组培养24 h后,根据trizol法提取细胞总RNA,按照逆转录反应试剂盒说明书,合成cDNA,按照Real-time PCR试剂盒说明书,检测mRNA表达水平。mRNA引物序列为GAPDH上游5′-ATGGTTTACATGTTCCAATATG-3′,下游5′-ATTTTGGAGGGATCTCGCTC-3′,产物长度128 bp;PCNA上游5′-ATGTTCGAGGCGCGCCT-3′,下游5′-ACCAAAGAGACGTGGGAC-3′,产物长度143 bp;XPB上游5′-ATGGGCAAAAGAGACCGAG-3′,下游5′-AACCGCTTCCTGAGGGTC-3′,产物长度116 bp;XPD上游5′-ATGAAGCTCAACGTGGACG-3′,下游5′-ATCTCCAGGACTCCATGAC-3′,产物长度125 bp;XPF上游5′-TCCTCTACCACTTTCTCCA-3′,下游5′-GAGGTGTTCAACTCCTTCT-3′,产物长度121 bp;XPG上游5′-CCTGGCTGTTGATATTAGC-3′,下游5′-TAAGAGTTTGCAGAGCCGA-3′,产物长度121 bp。根据公式:ΔCt=Ct均值-管家基因的Ct均值,ΔΔCt=ΔCt(药物组)-ΔCt(空白组),计算得出各基因表达的ΔCt和ΔΔCt值。通过2-ΔΔCt计算实验组各mRNA的相对表达水平。
2.5 蛋白免疫印迹法(Western blot)检测PCNA,XPB,XPD,XPF和XPG蛋白表达情况
细胞分组培养24 h后,加入裂解液200 μL,细胞刮棒刮取、收集细胞。12 000 r·min-1离心5 min,取上清液,按BCA法测定蛋白浓度。按1∶3的比例加入上样缓冲液,煮沸变性,-20 ℃冰箱备用。配置SDS-PAGE凝胶,电泳,PVDF转膜后脱脂牛奶封闭2 h,4 ℃孵育一抗(1∶1 000)过夜,TBST洗膜后室温孵育二抗(1∶4 000)2 h,ECL发光剂显影成像。用Quantity One图像分析软件分析各目的条带与相应GAPDH的灰度比值,表示各蛋白的相对表达水平。
2.6 统计学方法
实验数据均以
3 结果
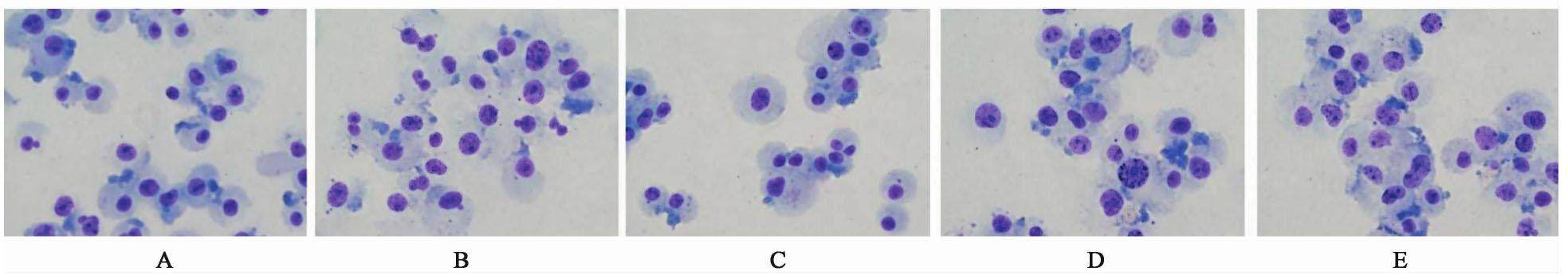
3.1 对甲醛染毒BMSCs细胞形态的影响
空白组BMSCs贴壁生长,呈长梭形或星形,大小较一致,排列紧密呈旋涡状。甲醛组细胞数量减少,部分细胞悬浮,体积缩小且大小不一,呈圆形,甚至表现为不规则形状。APS 40,100,400 mg·L-1组,与甲醛组比较,细胞数量明显增加,少部分细胞悬浮,呈圆形,以100 mg·L-1 APS组最为明显。见图1。

3.2 对甲醛染毒BMSCs微核的影响
微核实验结果显示与空白组比较,甲醛作用BMSCs形成微核率显著升高(P<0.01);与甲醛组比较,APS 40,100,400 mg·L-1作用后,微核率显著降低(P<0.01),以APS 100 mg·L-1作用最为明显。见图2,表1。
| 组别 | 质量浓度/ mg·L-1 | 微核率‰(n=3) | SCE/mitosis(n=20) |
|---|---|---|---|
| 空白 | - | 2.00±0.63 | 0 |
| 甲醛 | - | 85.33±4.932) | 13.42±2.762) |
| APS | 40 | 47.50±4.644) | 5.71±1.984) |
| 100 | 24.50±3.624) | 2.14±0.904) | |
| 400 | 32.67±3.394) | 5.00±1.834) |
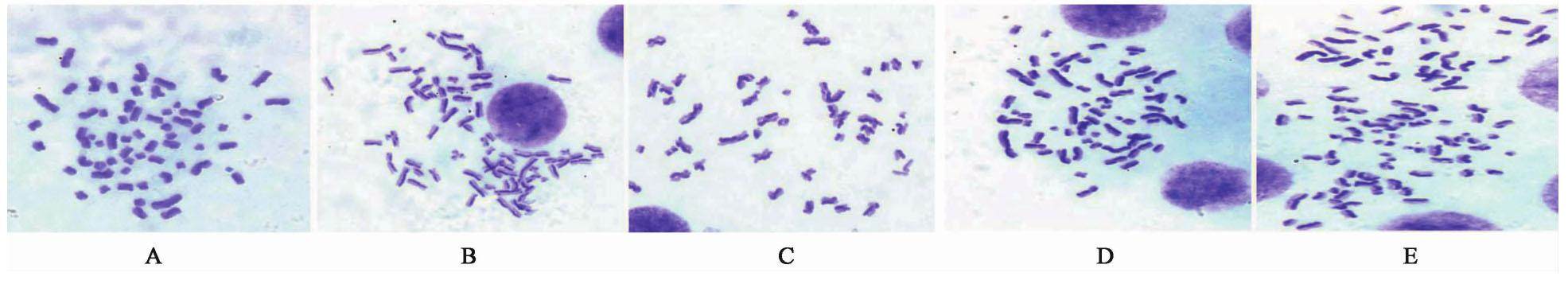
3.3 对甲醛染毒BMSCs SCE的影响
与空白组比较,甲醛导致BMSCs每个中期分裂相的SCE频率升高(P<0.01)。与甲醛组比较,APS 40,100,400 mg·L-1作用后,BMSCs每个中期分裂相的SCE频率显著降低(P<0.01)。其中100 mg·L-1APS作用组与空白组无明显差异。见图3,表1。
3.4 对甲醛染毒BMSCs PCNA,XPB,XPD,XPF和XPG mRNA表达的影响
与空白组比较,甲醛作用时,PCNA mRNA表达明显下调(P<0.05);与甲醛组比较,而在APS 40,100,400 mg·L-1作用后,表达显著上升(P<0.01);与空白组比较,XPB,XPD,XPF和XPG mRNA在甲醛,APS 40,100,400 mg·L-1作用后均较空白组明显升高(P<0.05,P<0.01),与甲醛组比较,PCNA,XPB,XPD,XPF和XPG mRNA表达均在APS 40,100,400 mg·L-1作用时明显升高(P<0.05,P<0.01)。见表2。
| 组别 | 质量浓度/mg·L-1 | PCNA | XPB | XPD | XPF | XPG |
|---|---|---|---|---|---|---|
| 甲醛 | - | 0.70±0.081) | 2.08±0.242) | 1.37±0.221) | 1.53±0.101) | 1.36±0.111) |
| APS | 40 | 1.54±0.122,4) | 2.86±0.162,4) | 1.79±0.062,3) | 2.00±0.162,3) | 1.72±0.122,3) |
| 100 | 1.97±0.092,4) | 3.28±0.082,4) | 2.30±0.282,4) | 2.09±0.222,3) | 1.99±0.122,4) | |
| 400 | 1.76±0.132,4) | 3.14±0.192,4) | 1.85±0.302,3) | 2.01±0.192,3) | 1.96±0.172,4) |
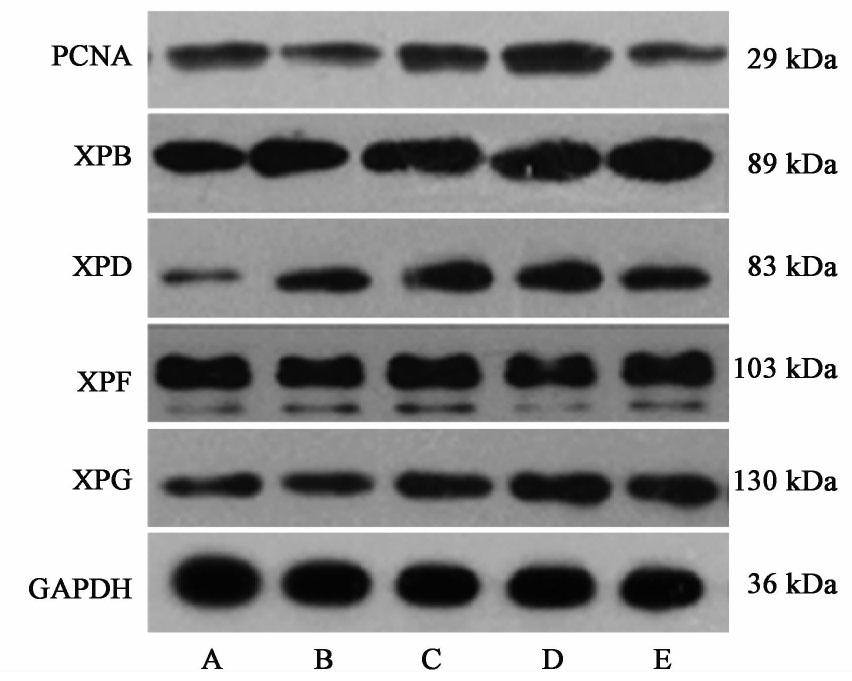
3.5 对甲醛染毒BMSCs PCNA,XPB,XPD,XPF和XPG蛋白表达的影响
与空白组比较,PCNA蛋白在甲醛作用时表达明显下调(P<0.01),与甲醛组比较,在APS 40,100,400 mg·L-1作用后表达明显上升(P<0.01),其中APS 100 mg·L-1升高最为明显;与空白组比较,XPB,XPD,XPF和XPG蛋白表达在甲醛,APS 40,100,400 mg·L-1作用后均明显升高(P<0.01),以APS 100 mg·L-1升高最为明显,并且APS 40,100,400 mg·L-1组升高较甲醛组有明显差异(P<0.05,P<0.01)。见图4,表3。
| 组别 | 质量浓度/mg·L-1 | PCNA/GAPDH | XPB/GAPDH | XPD/GAPDH | XPF/GAPDH | XPG/GAPDH |
|---|---|---|---|---|---|---|
| 空白 | - | 0.34±0.01 | 0.48±0.01 | 0.31±0.01 | 0.68±0.01 | 0.45±0.01 |
| 甲醛 | - | 0.24±0.002) | 0.81±0.012) | 0.51±0.012) | 0.92±0.022) | 0.52±0.012) |
| APS | 40 | 0.39±0.012,4) | 0.95±0.102,4) | 0.89±0.022,4) | 0.97±0.022,4) | 0.62±0.012,4) |
| 100 | 0.49±0.012,4) | 1.15±0.022,4) | 1.96±0.022,4) | 0.98±0.012,4) | 0.77±0.012,4) | |
| 400 | 0.40±0.012,4) | 1.09±0.012,4) | 1.04±0.022,4) | 0.76±0.032,4) | 0.56±0.012,3) |
4 讨论
微核是染色体、染色单体的无着丝点断片或者由于细胞分裂时纺锤丝受损而丢失的整个染色体,在有丝分裂后期形成子细胞核时,不能包被在子核中而形成。SCE是一条染色体中两条姐妹染色单体间的同源片段之间的互换。二者形成都与DNA的稳定性有关,DNA损伤增加或修复能力削弱均可增加微核形成和SCE发生的频率[8-9]。前期研究证实,甲醛作为一种环境污染物,可以引起细胞微核形成,SCE频率增高等染色体损伤[10],因此,本实验主要通过检测微核和SCE来研究APS对甲醛染毒人BMSCs染色体损伤的保护作用。实验发现,BMSCs经APS干预后,微核形成和SCE频率均较甲醛组明显减轻,而且通过细胞形态观察,APS组细胞形态较甲醛组明显改善。说明APS能够对甲醛环境中人BMSCs的染色体损伤起到保护作用。
机体细胞在受到外界因素作用时会导致DNA损伤,为保持基因组的稳定性,细胞会动员一系列完善而精确的修复机制来逆转这些损伤。核苷酸切除修复(NER)通路是体内功能最广泛、参与修复DNA损伤类型最多的通路[11]。NER主要修复过程为①识别损伤DNA;②转录修复因子(TFIIH)复合体被招募到损伤部位,TFIIH的两个亚基XPB(ERCC3)和XPD(ERCC2)具有解旋酶活性,负责打开损伤的DNA螺旋结构;③核酸内切酶XPF-ERCC1复合体切除损伤DNA的5′端,核酸内切酶XPG切除3′端,去除包含损伤部位的24~32个核苷酸片段;④5′端切口产生后,增殖细胞核抗原PCNA被加载到损伤位点的5′端[12],招募DNA聚合酶δ和聚合酶ε合成新的DNA片段,填充间隙,最后由DNA连接酶补平缺口[13]。本研究发现,甲醛和APS组XPB,XPD,XPF,XPG mRNA和蛋白表达均较对照组明显升高,而且APS组较甲醛组升高更为明显,说明XPB,XPD,XPF,XPG既参与了甲醛导致人BMSCs染色体损伤的修复,也参与了APS促进染色体损伤的修复,这与APS明显减轻甲醛染毒人BMSCs微核形成和SCE频率这一结果相一致。说明APS对甲醛染毒人BMSCs染色体损伤的保护作用可能与上调XPB,XPD,XPF,XPG mRNA和蛋白表达有关。
PCNA是DNA复制过程的必需因子,也在NER修复途径中能够与DNA聚合酶、连接酶等结合从而发挥重要修复作用[13-15]。本研究中,PCNA mRNA和蛋白在甲醛组表达明显降低,而在APS干预后表达明显升高,说明PCNA未参与甲醛引起染色体损伤的修复,可能参与了黄芪多糖的保护作用,促进了DNA的修复。另外,细胞内DNA复制与DNA修复是两个相辅相成的过程,DNA复制的保真性依赖于DNA修复,而DNA修复过程也包含了DNA复制的众多因素[16],因此,甲醛作用BMSCs细胞产生DNA损伤时,DNA复制也会减弱,因而PCNA mRNA和蛋白表达减弱,而随着APS的作用,DNA损伤逐渐修复,PCNA表达逐渐增强。已有报道,可以通过检测PCNA的表达情况来反映细胞的损伤与修复的情况[17]。
本研究还发现APS对甲醛染毒人BMSCs的染色体保护作用呈现出先增高后降低趋势,在40 mg·L-1和100 mg·L-1 APS作用时,细胞微核形成和SCE频率逐渐降低,PCNA,XPB,XPD,XPF,XPG mRNA和蛋白表达逐渐升高;然而在400 mg·L-1 APS作用时,细胞微核形成和SCE频率较100 mg·L-1 APS增多,PCNA,XPB,XPD,XPF,XPG mRNA和蛋白表达较100 mg·L-1 APS下降,但均较甲醛组比较,仍然有明显保护作用。提示APS质量浓度>100 mg·L-1时,可能会对人BMSCs产生毒性影响,抑制NER修复,也说明APS虽然具有良好的促进DNA损伤修复的功能,但是具有一定的安全使用范围,其在体内所对应的安全剂量范围,还需进一步研究、明确。
综上所述,APS对甲醛染毒人BMSCs染色体损伤具有保护作用,尤其以APS 100 mg·L-1作用最为显著,可能与上调NER通路上的PCNA,XPB,XPD,XPF,XPG mRNA表达,促进DNA损伤修复有关。

