脊髓损伤(SCI)是中枢神经系统严重受损的疾病之一,可导致感觉和运动功能的丧失以及生活质量的下降[1]。随着人口基数的增加,SCI病例总数也显著增加。其中,老年患者的发病率增幅最大,但其住院死亡率仍然很高[2]。虽然近期研究已部分阐明SCI后的病理生理过程,但目前除了常规的SCI治疗和康复外,创新且有效的治疗选择仍然有限[1]。温彬宇等[3]研究表明,地黄饮子可抑制能量代谢障碍导致的内质网应激,调节凋亡相关蛋白,显著减少神经元凋亡。邱静等[4]研究表明,加减薯蓣丸可上调核转录因子E2相关因子2(Nrf2)蛋白表达,从而减轻内质网应激诱导的神经元凋亡。现代药理研究和临床实践证明,淫羊藿及其活性化合物(淫羊藿苷)具有广泛的药理作用,特别是在激素调节、抗骨质疏松、免疫功能调节、抗氧化、抗衰老等方面的作用[5]。淫羊藿苷可抑制SCI后的炎症反应、脂质过氧化和细胞凋亡,减轻脊髓组织病理损伤,改善运动功能,具有明显的神经保护作用[6]。有研究表明,淫羊藿苷对SCI后运动功能的恢复及神经的保护作用与减轻内质网应激(ERS)有关[7]。当细胞暴露于外部应激因子以及结构异常时,未折叠的蛋白质在ER中积累,从而触发了ERS途径。其可激活介导程序性细胞死亡的促凋亡因子,CCAAT/增强子结合蛋白同源蛋白(CHOP)。葡萄糖调节蛋白78(Grp78)是ER的分子伴侣,为了保护细胞免受未折叠蛋白质的影响,其可介导未折叠蛋白质的重折叠[8]。因此,CHOP和Grp78是ERS作用的关键因子,淫羊藿苷可能通过此途径保护神经元,促进SCI的恢复,但具体机制仍不清晰,应通过实验进一步验证。
1 材料
1.1 细胞
PC12细胞系(可经神经生长因子诱导分化为神经元)购自江苏凯基生物技术有限公司,备存于南京中医药大学唐仲英科技楼临床医学实验研究中心实验室。
1.2 药物及试剂
F-12K培养基(美国Boster公司,批号pyg0056);胎牛血清(FBS,美国Life Technology公司,批号10099141);马血清,二甲基亚砜(DMSO)(北京索莱宝科技有限公司,批号分别为s9050-200,d8372);青霉素/链霉素(上海源培生物科技股份有限公司,批号s110jv);台盼蓝染液(大连美伦生物公司,批号mb4681);胰蛋白酶-乙二胺四乙酸(EDTA),BCA蛋白含量测定试剂盒(南京金益柏生物科技有限公司,批号分别为t1320-100,pt0001);多聚左旋赖氨酸(上海源叶生物科技有限公司,批号s20054-250 mg);神经生长因子(北京博奥森生物技术有限公司,批号bs-0073p);神经元特异性烯醇化酶(NSE),微管相关蛋白2(MAP2)抗体(英国Abcam公司,批号分别为ab53025,ab134124);Grp78抗体(美国Santa Cruz公司,批号sc-376768);CHOP,甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Cell Signaling Technology公司,批号分别为2895,2679);二抗(美国Bio-Rad公司,批号12004162);毒胡萝卜素(上海晶纯生化科技股份有限公司,批号t135258);淫羊藿苷(成都瑞芬思生物科技有限公司,批号Y-004-180228);细胞增殖毒性检测试剂盒-8(CCK-8)试剂盒(安徽Biosharp生物科技有限公司,批号bs350b);Annexin V-FITC凋亡试剂盒(上海碧云天生物技术有限公司,批号c1062s);PrimeScript™RT Master Mix反转录试剂盒,TB Green™ Premix Ex Taq TMⅡPCR试剂盒(日本TaKaRa公司,批号分别为RR036A,RR820A)。
1.3 仪器
ACB-4A1型垂直流超净工作台(新加坡Esco公司);HERAcell 150i型二氧化碳培养箱(美国Thermo Fisher公司);HWS-26型热恒温水浴锅(上海一恒电器厂); DMI 3000B型倒置荧光显微镜(德国Leica公司);CA94545型细胞分析仪(美国Millipore公司);ELX800型Perkin Elmer酶标仪(美国Bio-Tek公司);FC500MPL型流式细胞仪(美国Beckman公司);Applied Biosystems 7500型实时荧光定量聚合酶链式反应(Real-time PCR)自动化分析仪(美国ABI公司);221BR 46894型蛋白半干转印仪及电泳仪(美国Bio-Bad公司);6131-26843型微孔板离心机及各量程移液器(德国Eppendorf公司)。
2 方法
2.1 分组
实验分为4组,空白组PC12诱导分化的神经元细胞;溶剂组PC12诱导分化的神经元细胞+0.1%DMSO;毒胡萝卜素组PC12诱导分化的神经元+2 μmol·L-1毒胡萝卜素(毒胡萝卜素可诱导ERS[9]);淫羊藿苷组PC12诱导分化的神经元+2 μmol·L-1毒胡萝卜素+0.1 μmol·L-1淫羊藿苷(经过前期实验及文献查阅,提示0.1 μmol·L-1淫羊藿苷可增强PC12细胞的活力[10])。
2.2 PC12细胞的培养
将PC12细胞从液氮罐中取出,迅速于37 ℃水浴锅中融化。将冻存管中细胞悬液吸至15 mL离心管中,加入完全培养基1 mL,1 000 r·min-1离心5 min。吸弃上清液后加入含有10%马血清+5%FBS+1%青霉素/链霉素的F-12K培养基5 mL,重悬PC12细胞。吸取台盼蓝染液和细胞悬液20 μL,混匀并打入计数板中,利用细胞计数仪进行计数。以1×104个/mL接种至25 cm2培养皿中,加入含有10%马血清+5%FBS+1%青霉素/链霉素的F-12K培养基10 mL,放入37 ℃ 5%CO2培养箱中培养。隔1~2 d换液,倒置显微镜下观察细胞的形态特征及生长状况,细胞铺满80%培养瓶底面时进行传代。
2.3 PC12细胞的诱导分化与鉴定
选择生长良好的PC12细胞,观察细胞铺满培养瓶底80%面积,吸弃培养基后加入含50 μg·L-1的NGF的F-12K培养基,并重悬细胞。计数后按1∶1或1∶2接种至10 cm培养皿中,另加入含50 μg·L-1的NGF的F-12K培养基至10 mL,置于37 ℃ 5%CO2培养箱中培养。隔1~2 d换液,同时密切观察细胞形态特征。选择生长良好的PC12细胞,接种至预先用100 mg·L-1 L-多聚赖氨酸包被的6孔板中,置于37 ℃ 5%CO2培养箱中诱导分化培养5 d。待PC12细胞长出突起后,吸弃上清,用0.25%的胰蛋白酶-EDTA消化1~2 min,镜下观察细胞收起触角,变圆,加含10%血清的完全培养基终止消化。吹打下PC12细胞,1 000 r·min-1离心6 min。用1 mL冷磷酸盐缓冲液(PBS)吹打细胞沉淀至悬液,测细胞浓度,按每1.5 mL的离心管2×105~10×105个细胞分为2组、每组3管,1 000 r·min-1离心6 min。吸弃上清,一组加入PBS稀释的NSE抗体200 μL,一组加入MAP2抗体200 μL,轻轻吹打混匀,4 ℃孵育1 h。1 000 r·min-1离心6 min,吸弃上清,各组加入冷PBS离心洗涤2次。细胞中加入预冷PBS 500 μL,吹打均匀,转移至流式细胞管中,4 ℃避光保存或直接上流式细胞仪进样检测。
2.4 CCK-8法检测细胞增殖状态
取生长良好的神经元,吸弃上清,用0.25%的胰蛋白酶-EDTA消化1~2 min,镜下观察细胞收起触角,变圆,加含10%血清的完全培养基终止消化。吹打下神经元,1 000 r·min-1离心6 min,收集细胞。加入含有10%马血清+5%FBS+1%青霉素/链霉素的F-12K培养基5 mL,重悬神经元,进行计数。按照终浓度1×104个/mL,每孔200 μL接种于3块96孔培养板中,同时设置与实验平行的无细胞空白组,每组6孔,将培养板静置于37 ℃ 5%CO2培养箱内培养12~24 h。神经元贴壁后,吸弃原培养基,加入各组干预含药培养基。将96孔板置于37 ℃ 5%CO2培养箱中分别培养24,48,72 h。吸弃原培养基,改加有含10%马血清+5%FBS+1%青霉素/链霉素的F-12K培养基,同时每孔加入CCK-8溶液10 μL(避免产生气泡),静置于37 ℃ 5%CO2培养箱中孵育4 h,多功能酶标仪测定450 nm处的吸光度A。
2.5 流式细胞术检测细胞凋亡情况
取生长良好的神经元,以1×106个/mL接种至6孔板,在37 ℃ 5%CO2培养箱中培养。待细胞贴壁后,吸弃原培养基,按上述实验分组给药干预48 h。吸弃上清,用0.25%的胰蛋白酶-EDTA消化1~2 min。镜下观察细胞收起触角,变圆,加含10%血清的完全培养基终止消化。吹打下神经元,1 000 r·min-1离心6 min。加入冷PBS重悬,再1 000 r·min-1离心6 min,重复1次,清洗细胞。加入结合缓冲液悬浮细胞195 μL,加入MAP2 5 μL混匀,避光暗室孵育1 h。加入Annexin V-FITC 5 μL,室温避光孵育10 min。1 000 r·min-1离心6 min,弃上清,加入结合缓冲液重悬细胞重复3次,再加入结合缓冲液重悬细胞190 μL。加入20 mg·L-1 PI(终质量浓度1 mg·L-1)10 μL混匀,上流式细胞仪进样检测,重复3次。
2.6 蛋白免疫印迹法(Western blot)检测CHOP,Grp78蛋白的表达
取生长良好的神经元,以1×106个/mL接种至6孔板,在37 ℃ 5%CO2培养箱中培养。待细胞贴壁后,吸弃原培养基,按上述实验分组给药干预48 h。吸弃培养基,6孔板中每孔加入RIPA(含1%PMSF)裂解液150 μL。裂解1~2 min后,用细胞刷将细胞层刮下,转移至1.5 mL离心管中,置于冰上裂解10 min,12 000 r·min-1离心10 min。取上清至另一1.5 mL离心管中,使用BCA法检测各组总蛋白的含量。取相同质量总蛋白,稀释至同一体积,加入1/3体积的4倍loading buffer,沸水浴10 min后,保存于-20 ℃待测。100 V恒压电泳90 min,100 V,400 mA转膜60 min。5%脱脂奶粉室温封闭2 h,弃封闭液,TBST漂洗蛋白条带3次,每次10 min。配制5%BSA溶液,按1∶1 000比例配制CHOP,Grp78及GAPDH抗体,4 ℃过夜孵育。次日,加入TBST漂洗3次,每次10 min。用5%BSA稀释二抗,室温孵育2 h。回收二抗,TBST漂洗3次,每次5 min。滴加ECL显影液,凝胶成像系统显影。利用Image J图像分析系统分析条带,计算条带灰度值与GAPDH蛋白条带灰度值的比值,表示蛋白相对含量。
2.7 Real-time PCR检测CHOP,Grp78的mRNA表达
取生长良好的神经元,以1×106个/mL接种至6孔板,在37 ℃ 5%CO2培养箱中培养。待细胞贴壁后,吸弃原培养基,按上述实验分组给药干预48 h。吸弃上清,用0.25%的胰蛋白酶-EDTA消化1~2 min,镜下观察细胞收起触角,变圆,加含10%血清的完全培养基终止消化。用移液器轻柔吹打,1 000 r·min-1离心6 min,收集细胞。使用trizol法提取RNA,并测定各组RNA浓度。使用反转录试剂盒进行反转录。在Genbank上查找CHOP,Grp78,β-肌动蛋白(β-actin)序列,设计并由生工生物工程(上海)股份有限公司进行引物合成,CHOP,上游5′-AAATAACAGCCGGAACCTGA-3′和下游5′-CTTTTCCTGGGGATGAGATA-3′,产物长度83 bp;Grp78,上游5′-CCCCAACTGGTGAAGAGGAT-3′和下游5′-CCCCAAGACATGTGAGCAAC-3′,产物长度95 bp;β-actin,上游5′-TACAACTCCTTGCAGCTCC-3′和下游5′-ATCTTCATGAGGTAGTCAGTC-3′,产物长度157 bp。以β-actin为内参,利用PCR试剂盒进行CHOP,Grp78进行相对定量分析。使用Real-time PCR系统,设置Real-time PCR扩增条件进行PCR反应,采用2-ΔΔCt法对数据进行相对定量分析。
2.8 统计学分析
所有数据分析由统计软件SPSS 19.0完成,所有检测数据均表示为
3 结果
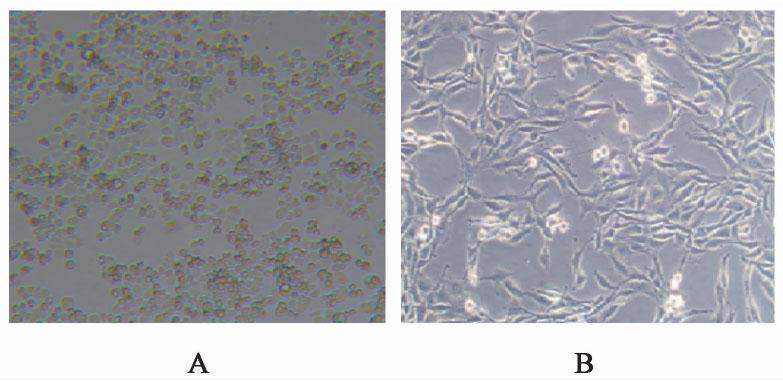
3.1 NGF诱导的神经元样PC12细胞鉴定
使用倒置显微镜观察经NGF培养7 d后的PC12细胞,镜下可见PC12细胞的突起较前明显变长,细胞形态呈三角形,且呈贴壁样生长,说明诱导后的PC12细胞已具有神经元样形态。见图1。使用流式细胞测定MAP2和NSE表达阳性率,结果显示MAP2平均阳性率为(62.54±1.00)%,NSE平均阳性率为(93.32±2.87)%,表明经NGF诱导后的PC12细胞已具有神经元样的作用,可供后续实验使用。
3.2 对受损神经元增殖的影响
与空白组比较,溶剂组A无明显差异,表明DMSO对细胞无明显影响;与溶剂组比较,毒胡萝卜素组A显著降低(P<0.01),表明毒胡萝卜素抑制细胞增殖活性;与毒胡萝卜素组比较,淫羊藿苷组A显著增高(P<0.01),表明淫羊藿苷组能改善毒胡萝卜素对神经元增殖活性的抑制。见表1。
| 组别 | 浓度/μmol·L-1 | 干预时间 | ||
|---|---|---|---|---|
| 24 h | 48 h | 72 h | ||
| 空白 | - | 1.018±0.176 | 1.366±0.173 | 2.141±0.146 |
| 溶剂 | - | 0.826±0.082 | 1.295±0.101 | 2.293±0.196 |
| 毒胡萝卜素 | 2 | 0.425±0.0313) | 0.573±0.1273) | 1.367±0.1253) |
| 淫羊藿苷 | 0.1 | 0.494±0.236 | 0.927±0.1675) | 1.774±0.1075) |
3.3 对受损神经元凋亡的影响
与溶剂组比较,神经元经毒胡萝卜素干预后,48 h细胞凋亡率显著增多(P<0.01);与毒胡萝卜素比较,使用淫羊藿苷干预毒胡萝卜素作用后的神经元,48 h细胞凋亡率显著减低(P<0.01)。见表2。
| 组别 | 浓度/μmol·L-1 | 细胞凋亡率/% |
|---|---|---|
| 空白 | - | 4.103±0.174 |
| 溶剂 | - | 4.793±0.573 |
| 毒胡萝卜素 | 2 | 19.04±1.7863) |
| 淫羊藿苷 | 0.1 | 13.03±2.7655) |
3.4 对受损神经元CHOP,Grp78蛋白表达的影响
与溶剂组比较,毒胡萝卜组CHOP,Grp78的蛋白表达升高(P<0.01);与毒胡萝卜素组比较,淫羊藿苷组CHOP,Grp78的蛋白表达降低(P<0.01)。见图2,表3。
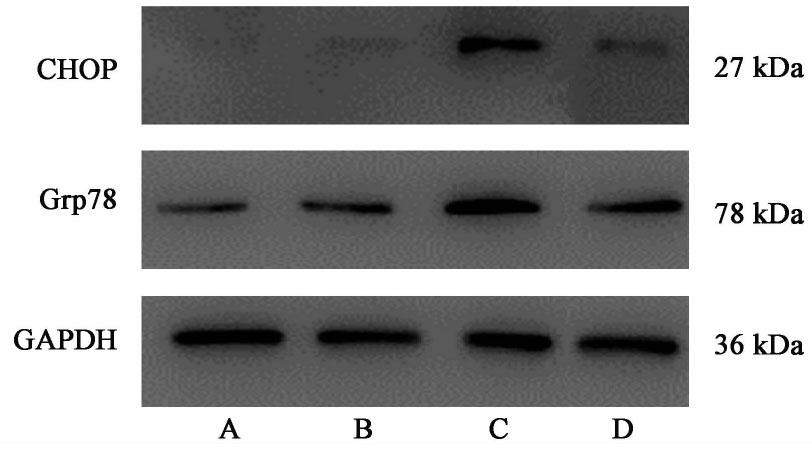
| 组别 | 浓度/μmol·L-1 | CHOP/GAPDH | Grp78/GAPDH |
|---|---|---|---|
| 空白 | - | 0.088±0.003 | 0.264±0.005 |
| 溶剂 | - | 0.067±0.003 | 0.531±0.014 |
| 毒胡萝卜素 | 2 | 0.479±0.0093) | 1.069±0.0213) |
| 淫羊藿苷 | 0.1 | 0.198±0.0045) | 0.715±0.0125) |
3.5 对受损神经元CHOP,Grp78 mRNA表达的影响
与空白组比较,溶剂组CHOP,Grp78 mRNA表达明显降低(P<0.05);与溶剂组比较,毒胡萝卜组CHOP,Grp78 mRNA表达明显升高(P<0.01);与毒胡萝卜素组比较,淫羊藿苷组CHOP,Grp78的mRNA表达明显降低(P<0.05)。见表4。
| 组别 | 浓度/μmol·L-1 | CHOP | Grp78 |
|---|---|---|---|
| 溶剂 | - | 0.741±0.2581) | 0.926±0.2171) |
| 毒胡萝卜素 | 2 | 14.011±6.2313) | 37.258±3.7673) |
| 淫羊藿苷 | 0.1 | 6.997±3.3614) | 25.690±6.8555) |
4 讨论
ER具有调节跨膜蛋白和细胞内钙浓度、合成磷脂和胆固醇以及影响蛋白质折叠的功能[11],但机体在缺氧、缺血、外伤等情况下会出现ERS反应,表现为ER腔内蛋白质折叠和未折叠蛋白质的累积[12]。ERS是SCI病理学的主要机制之一[13],其可通过激活CHOP使细胞发生凋亡[14]。然而,细胞中的肌醇必需酶-1(IRE-1),活化转录因子6(ATF6),蛋白激酶R样内质网激酶(PERK)3个ERS传感器可缓解ERS[15-16],消除错误折叠或未折叠蛋白,并使细胞重新回到稳态[17]。在正常细胞中,伴侣蛋白Grp78结合ER膜蛋白PERK并阻止其活化。当未折叠蛋白质在ERS下而积累时,Grp78与PERK发生解离,导致其活化,进而抑制蛋白质合成,最终减轻ER内错误折叠蛋白的过载[14,18]。由于其mRNA上存在内部核糖体进入位点,一些mRNA(如ATF4)的翻译未被抑制,ATF4蛋白可增加参与蛋白质折叠和控制氧化还原的基因表达[19-20]。如果ERS反应剧烈,ATF4则会增加CHOP的表达,从而引发细胞凋亡[21]。
SCI部位微环境的改变可导致蛋白质错误折叠[22-23],ERS的下调或许能减少神经细胞的凋亡,促进神经功能恢复[12,24-25]。淫羊藿,味辛、甘,性温,具有补肾阳、强筋骨、祛风湿等功效,淫羊藿苷为其有效药理成分[26]。有研究表明,五味子与淫羊藿混合提取物可改善D-半乳糖致脑衰老小鼠的学习记忆能力[27];淫羊藿苷能显著降低丙二醛含量,增加超氧化物歧化酶活性,改善脊髓脂质过氧化,脊髓水肿和组织病理学损伤,并促进CSI大鼠运动功能的恢复[28];高剂量淫羊藿苷的早期和持续治疗通过线粒体凋亡途径抑制促炎因子,氧化应激和神经细胞凋亡,显着增强CSI后的运动恢复[29];淫羊藿苷能抑制CSI后的炎症、脂质过氧化和细胞凋亡,减轻脊髓组织病理学损伤,具有明显的神经保护作用[30]。因此,淫羊藿苷促进受损神经元修复可能与ERS有关。
本研究通过淫羊藿苷干预受损神经元,验证淫羊藿苷调控ERS修复受损神经元的有效性及部分机制。CCK-8,流式细胞术检测的实验结果均显示,毒胡萝卜素可促进ERS促使经神经生长因子诱导的神经元样PC12细胞发生凋亡,且凋亡率较高;淫羊藿苷组方中药物可缓解毒胡萝卜素诱发的ERS,减少神经元凋亡。Western blot及Real-time PCR结果显示,毒胡萝卜素作为ESR激动剂,能够上调CHOP,Grp78的表达,表明毒胡萝卜素可上调CHOP,Grp78的表达激活ERS,进而诱导神经元凋亡;与毒胡萝卜素组相比,经淫羊藿苷组干预后下调CHOP,Grp78的表达,表明淫羊藿苷可通过下调CHOP,Grp78的表达抑制毒胡萝卜素诱导的ERS。据上可得,CHOP,Grp78高表达提示ERS,淫羊藿苷可通过下调CHOP和Grp78的表达抑制ERS,促进受损神经元的修复。
有研究表明,上调Grp78有利于ER中蛋白质的正确折叠,促进细胞的恢复;而下调Grp78可引起ER中未折叠蛋白积累,ERS持续激活导致细胞凋亡[31-32]。CHOP高表达提示ERS的激活,细胞呈现凋亡趋势[33];另有研究表明,CHOP具有抗细胞凋亡的作用[34]。在本实验中,淫羊藿苷可抑制ERS,下调受损神经元CHOP和Grp78的表达,从而抗神经元凋亡。此与有些文献研究结果不同,也许存在其他通路影响CHOP和Grp78的表达,应进行多实验验证及多系统通路研究。然而,本实验尚有部分不足,如未做动物实验、未涉及基因敲除、未进行系统通路研究等,应进行下一步研究。
Cell signaling and stress responses
[J].Cold Spring Harb Perspect Biol,2016, doi: 10.1101/cshperspect.a006072.The effects of icariin on enhancing motor recovery through attenuating pro-inflammatory factors and oxidative stress via mitochondrial apoptotic pathway in the mice model of spinal cord injury
[J].Front Physiol,2018,doi: 10.3389/fphys.2018.01617.
