阿尔茨海默病(AD)是一种最常见的痴呆类型,主要表现为年龄相关性的进行性认知功能障碍,包括学习记忆能力丧失。随着全世界人口老龄化日趋严重,对社会和家庭的影响愈加明显。对于AD发病机制,目前广泛接受的包括以下几种:淀粉样蛋白级联假说,Tau蛋白异常磷酸化假说、胆碱能假说等[1-2]。最近的研究表明,氧化应激是AD发生中一个非常重要的病理特征,在AD的病理早期即出现氧化应激水平的增高[3]。是发生于老年斑形成之前的上游病理事件[4]。在AD的可能发病机制中,氧化应激的作用可能是一个新的研究靶点[5]。核转录因子E2相关因子2(Nrf2)/抗氧化反应原件(ARE)/血红素加氧酶-1(HO-1)通路在机体抗氧化应激中有着不可小觑的作用,AD的抗氧化研究方面主要可考虑提高Nrf2/ARE/HO-1通路的激活及下游相关基因的表达。天麻为兰科植物天麻的干燥块茎,2015年版《中国药典》记载,天麻中含有天麻素、香草醛、香荚兰醇、维生素A类等多种微量元素[6]。当代的药理学研究发现天麻素具有抗氧化、抗炎、抗凋亡等多种生物学活性[7]。也有相关研究报道,天麻提取物可以改善血管性痴呆大鼠学习记忆能力[8],在AD中有一定的抗氧化作用[9-10],但其作用机制并未清晰。在此项研究中,通过在AD未出现病理特征前长期给予天麻以及出现病理特征后再给予天麻粉,依此检测痴呆小鼠模型学习记忆能力的变化、抗氧化应激变化情况并进一步检测Kelch样环氧氯丙胺相关蛋白1(Keap1)-Nrf2/HO-1通路上下游蛋白表达变化,明确天麻粉及Keap1-Nrf2/HO-1通路在AD模型小鼠中的关系。因此,本研究旨在探究天麻粉在APP/PS1小鼠中的抗氧化作用机制以及长期给药是否可以从预防的角度来缓解AD进程,为AD的防治提供参考依据。
1 材料
1.1 动物
30只8周龄雄性野生型小鼠,45只8周龄APP/PS1双转基因阿尔茨海默病雄性模型小鼠,均购自上海南方模式生物科技股份有限公司,合格证号SCXK(沪)2017-0010,实验动物均按照国家实验动物饲养和使用指南,饲养于贵州医科大学动物实验中心SPF级环境,使用独立通风柜饲养,动物房温度(22±2) ℃,湿度40%~60%。所有动物实验操作均获得贵州医科大学实验动物伦理委员会许可。
1.2 药物与试剂
天麻粉由贵州医科大学药学院赠送,由贵州医科大学沈祥春教授鉴定为正品;兔抗鼠Nrf2多克隆抗体,兔抗鼠HO-1多克隆抗体;兔抗鼠Keap1多克隆抗体(美国GeneTex公司,批号分别为GTX103322,GTX101147,GTX54329);鼠抗鼠β-肌动蛋白(β-actin)单克隆抗体(上海Absin公司,批号abs830031);抗兔二抗,抗鼠二抗(美国CST公司,批号分别为7074,7076);BCA蛋白定量试剂盒(美国Thermo公司,批号TL276913);RNA提取试剂盒(RNA-Quick Purification Kit)及RNA逆转录试剂盒(Fast All-in-One RT Kit)(上海奕杉生物公司科技有限公司,批号分别为RN002plus,RT001);β-actin,Nrf2,HO-1引物由生工生物工程(上海)股份有限公司设计合成,引物序列见表1,表2。
| 引物 | 序列(5′-3′) | 长度/bp | 退火温度/℃ |
|---|---|---|---|
| APP | 上游GACTGACCACTCGACCAGGTTCTG | 400 | 55 |
| 下游CTTGTAAGTTGGTCATATCCG | |||
| PS1 | 上游AATAGAGAACGGAGCA | 600 | 55 |
| 下游GCCATGAGGGCACTAATCAT |
| 引物 | 序列(5′-3′) | 长度/bp | 退火温度/℃ |
|---|---|---|---|
| Nrf2 | 上游ACCAAGGGGCACCATATAAAAG | 114 | 57 |
| 下游CTTCGCCGAGTTGCACTCA | |||
| HO-1 | 上游AGGTACACATCCAAGCCGAGA | 86 | 57 |
| 下游CATCACCAGCTTAAAGCCTTCT | |||
| Keap1 | 上游CGGGGACGCAGTGATGTATG | 85 | 61 |
| 下游TGTGTAGCTGAAGGTTCGGTTA | |||
| β-actin | 上游GTGCTATGTTGCTCTAGACTTCG | 174 | 57 |
| 下游ATGCCACAGGATTCCATACC |
1.3 仪器
Morris水迷宫及水迷宫配套分析软件(中国医学科学院药物研究所);Illumina Eco型实时荧光定量PCR(Real-time PCR)仪(美国Illumina公司);TANON 4200型全自动化学发光成像系统(上海天能科技有限公司);BG-power600型转膜仪及电泳仪(北京白晶生物技术有限公司)。
2 方法
2.1 动物分组及给药
将30只雄性野生型小鼠随机分为2组,即正常(野生型小鼠空白)组;正常给药(野生型小鼠天麻粉处理)组,每组15只。将45只APP/PS1双转基因小鼠随机分为3组,即模型(APP/PS1双转基因小鼠空白)组;天麻粉预防(APP/PS1双转基因小鼠天麻粉处理)组;天麻粉治疗(APP/PS1双转基因小鼠正常饲养至22周龄时给予天麻粉处理)组,每组15只。各组小鼠适应性饲养后,正常给药组、天麻粉预防组在饲养至8周龄时开始灌胃同等剂量的天麻粉(1.5 g·kg-1)[11],正常组、模型组每日灌胃等量的生理盐水,统一灌胃至24周龄。天麻粉治疗组则当APP/PS1双转基因小鼠饲养至22周龄时,开始灌胃同等剂量的天麻粉(1.5 g·kg-1)至24周龄。后行Morris水迷宫检测各组小鼠学习和记忆能力,然后腹腔注射4%水合氯醛(20 mL·kg-1)进行麻醉,开胸暴露小鼠心脏,用1 mL注射器经左心室抽取小鼠血液,再用磷酸盐缓冲液(PBS)冲洗血管床约4 min,剪开颅骨,小心取出脑组织在冰上分离得到海马组织,-80 ℃冰箱保存备用。
2.2 APP/PS1双转基因小鼠繁殖及鉴定
待小鼠发育成熟后,采用1只APP/PS1双转基因雄性小鼠与3只同背景野生型雌性小鼠合笼的方式进行繁殖,剪取2周龄小鼠鼠尾提取DNA扩增进行基因型鉴定,鉴定PCR反应条件为预变性94 ℃ 300 s,循环1次;变性94 ℃ 30 s,40个循环;退火55 ℃ 30 s,延伸72 ℃ 60 s,终延伸72 ℃ 300 s,40个循环。
2.3 Morris水迷宫检测小鼠学习记忆能力
各组小鼠饲养至24周龄时,采用Morris水迷宫进行行为学测试,测试持续5 d。记录Morris测试过程中小鼠的逃避潜伏期及穿越平台次数。实验主要包括两方面,一是定位航行实验,将小鼠依次从各象限中点面向池壁放入水中,使其自由寻找平台,记录其运动轨迹和时间,设定寻找时间为60 s,如超时未找到平台则将其引导至平台停留10 s,记录其逃避潜伏期为60 s,定位航行实验持续进行4 d;二是空间探索实验,在测试的第5天撤除平台,在平台所在象限对侧象限中点使小鼠面向池壁入水,记录并分析小鼠的逃避潜伏期以及在60 s内穿越平台所在位置的次数和在目标象限停留时间及路程。
2.4 Real-time PCR检测海马组织中Nrf2,HO-1,Keap1 mRNA表达水平
按RNA提取试剂盒步骤提取组织总RNA,将mRNA经逆转录合成cDNA存于-80 ℃备用。采用Real-time PCR仪以逆转录的产物为模板进行Nrf2,HO-1 mRNA水平检测定量。反应条件为预变性954 ℃ 600 s,循环1次;变性95 ℃ 15 s,40个循环;退火605 ℃ 60 s,延伸72 ℃ 60 s,40个循环。用2-ΔΔCt法计算mRNA的表达水平。
2.5 蛋白免疫印迹法(Western blot)检测海马中Nrf2,HO-1,Keap1蛋白的表达水平
取各组小鼠海马组织加入适量裂解液,用手动组织匀浆器匀浆,匀浆液12 000 r·min-1,4 ℃离心20 min,上清液即为总蛋白。各抗体稀释倍数:Nrf2(1∶1 000),HO-1(1∶1 000),Keap1(1∶1 000),β-actin(1∶4 000),二抗(1∶1 000)。采用BCA蛋白定量试剂盒测定各组蛋白含量,以此来计算Western blot蛋白上样量,检测海马组织中Nrf2,HO-1,Keap1的表达水平及其内参的蛋白表达情况。用Image J软件分析各条带灰度值。
2.6 统计学分析
实验数据采用SPSS 20.0进行数据统计,实验结果均用
3 结果
3.1 APP/PS1双转基因小鼠模型鉴定结果
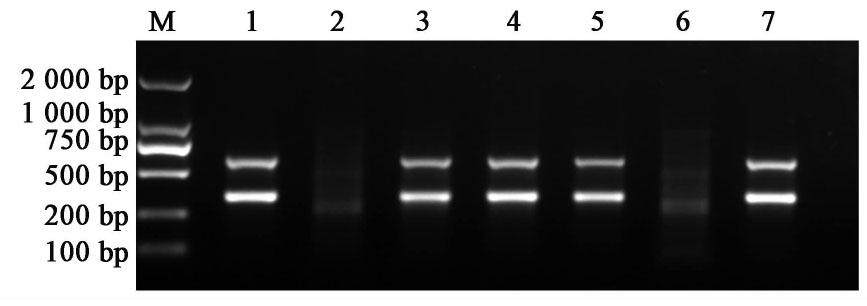
对2周龄小鼠剪取鼠尾进行基因型鉴定,APP基因条带大小为400 bp,PS1基因条带大小为600 bp,1,3,4,5,7泳道同时出现两条带视为APP/PS1双转基因小鼠,2,6泳道没有出现相应条带则为阴性小鼠。见图1。
3.2 对小鼠学习记忆的影响
与正常组比较,模型组小鼠逃避潜伏期明显延长(P<0.05,P<0.01),平台所在象限停留时间和穿越目标平台次数显著减少(P<0.01);与模型组比较,天麻粉预防组、天麻粉治疗组小鼠逃避潜伏期明显缩短(P<0.05,P<0.01),平台所在象限停留时间和穿越目标平台次数均有不同程度增加(P<0.01)。见表3,表4。
| 组别 | 剂量/g·kg-1 | 第1天 | 第2天 | 第3天 | 第4天 | 第5天 |
|---|---|---|---|---|---|---|
| 正常 | - | 32.67±20.79 | 23.63±18.19 | 13.05±12.46 | 9.12±7.36 | 9.80±7.29 |
| 正常给药 | 1.5 | 25.30±18.37 | 18.08±16.84 | 10.65±9.59 | 10.74±10.57 | 8.68±7.79 |
| 模型 | - | 43.46±14.511) | 35.04±18.042) | 21.19±12.802) | 16.53±9.462) | 19.3±12.692) |
| 天麻粉预防 | 1.5 | 34.59±16.38 | 22.18±17.354,5) | 13.15±10.584) | 11.64±8.364) | 10.20±8.544) |
| 天麻粉治疗 | 1.5 | 37.02±20.343) | 32.49±20.83 | 15.73±16.59 | 14.97±13.17 | 10.19±6.744) |
| 组别 | 剂量/g·kg-1 | 平台所在象限停留时间/s | 穿越平台次数/次 |
|---|---|---|---|
| 正常 | - | 22.53±1.52 | 5.00±0.76 |
| 正常给药 | 1.5 | 20.16±3.51 | 5.36±1.13 |
| 模型 | - | 10.78±0.892) | 1.63±0.752) |
| 天麻粉预防 | 1.5 | 19.33±2.904) | 4.40±0.951) |
| 天麻粉治疗 | 1.5 | 21.30±5.014) | 4.40±0.841) |
3.3 对小鼠海马组织中Nrf2,HO-1,Keap1 mRNA表达水平的影响
与正常组比较,模型组小鼠海马组织中Nrf2,HO-1 mRNA表达水平降低(P<0.01),Keap1 mRNA差异无统计学意义;与模型组比较,天麻粉预防组、天麻粉治疗组海马组织中Nrf2,HO-1 mRNA表达水平显著增高(P<0.01)。见表5。
| 组别 | 剂量/g·kg-1 | Nrf2 | HO-1 | Keap1 |
|---|---|---|---|---|
| 正常给药 | 1.5 | 0.98±0.07 | 1.24±0.25 | 0.93±0.28 |
| 模型 | - | 0.60±0.062) | 0.69±0.102) | 1.01±0.26 |
| 天麻粉预防 | 1.5 | 1.30±0.094) | 1.05±0.134) | 0.98±0.23 |
| 天麻粉治疗 | 1.5 | 1.14±0.144) | 1.11±0.224) | 1.00±0.09 |
3.4 对海马组织中Nrf2,HO-1,Keap1蛋白表达的影响
与正常组比较,模型组小鼠海马组织中Nrf2,HO-1蛋白表达水平均明显降低(P<0.05),Keap1蛋白表达水平变化差异无统计学意义;与模型组比较,天麻粉预防组小鼠海马组织中Nrf2,HO-1蛋白表达水平均有不同程度增高(P<0.05),天麻粉治疗组小鼠海马组织中Nrf2,HO-1蛋白表达水平差异无统计学意义,天麻粉预防组和天麻粉治疗组小鼠海马组织中Keap1蛋白表达水平变化差异无统计学意义;与天麻粉治疗组比较,天麻粉预防组小鼠海马组织中Nrf2,HO-1蛋白均有不同程度增加(P<0.05)。见图2,表6。

| 组别 | 剂量/g·kg-1 | Nrf2/β-actin | HO-1/β-actin | Keap1/β-actin |
|---|---|---|---|---|
| 正常 | - | 140.3±36.3 | 83.3±10.5 | 100.3±11.7 |
| 正常给药 | 1.5 | 120.3±24.6 | 83.3±15.6 | 108.0±15.3 |
| 模型 | - | 75.3±14.61) | 61.9±10.01) | 116.7±7.6 |
| 天麻粉预防 | 1.5 | 136.2±21.43) | 81.0±4.23) | 108.2±7.6 |
| 天麻粉治疗 | 1.5 | 77.3±22.3 | 63.2±10.3 | 89.0±19.8 |
4 讨论
AD是目前世界上最为常见的痴呆类型[12]。AD国际调查指出,全世界AD患者已经超过5 000万[13],并仍在持续增长。伴随着全世界人口老龄化的加剧,预计至2050年,AD患者将超过1.3亿[14]。近年来的研究发现氧化应激损伤是AD的重要早期病理变化,在AD的发病过程中发挥着重要的作用。Aβ聚集对氧化应激的介导在AD的发生和进展中的重要作用也得到了证实[15]。脑组织的高代谢状态,以及其较弱的抗氧化能力,加上高龄患者体内的抗氧化剂如还原性谷胱甘肽,过氧化氢酶等含量降低,最终导致脑内氧化应激水平增高,加重脑组织的损伤[16]。Nrf2已被证明是AD病理变化中的一种保护因子,并且在老年AD动物模型和AD患者脑中Nrf2表达降低。在Aβ沉积时,APP/PS1转基因小鼠脑中Nrf2蛋白表达降低[17]。Nrf2作为一种调节氧化应激相关基因的主转录因子,其启动子中含有抗氧化反应元件。Nrf2的结构和功能改变在大多数神经退行性疾病中发现,包括AD,帕金森病(PD)和肌萎缩侧索硬化。这些神经退行性疾病是由各种危险因素发展而来的,如累积的氧化应激、遗传和环境因素。Nrf2通过上调抗氧化防御途径激活,抑制炎症和维持蛋白质稳态来保护机体免于氧化应激损伤。Nrf2已成为AD的新治疗靶点,实际上,最近的研究表明Nrf2激活剂在AD动物模型和表达AD病理的培养的人细胞中具有治疗效果[18]。现代药理学研究发现天麻素具有抗氧化、抗炎、抗凋亡等多种生物活性,可调节体内多种生理过程[19-20]。研究表明,天麻具有很好的神经保护作用并能改善学习记忆能力,对AD患者具有较好的治疗作用[21]。
本课题研究中采取不同给药方案,长期及短期给予天麻粉来探究天麻粉在APP/PS1双转基因小鼠中的抗氧化作用的效果。Morris研究结果显示天麻粉能够改善APP/PS1双转基因小鼠的学习记忆能力,且正常给药组与正常组比较,正常给药组小鼠的逃避潜伏期和穿越平台次数均有提高,但差异无统计学意义;天麻粉预防组小鼠在对抗AD抗氧化的效果优于天麻粉治疗组,且与模型组比较,天麻粉预防组小鼠的Nrf2,HO-1在mRNA水平及蛋白表达水平均有不同程度的提高,天麻粉治疗组与模型组比较Nrf2,HO-1 mRNA水平有增高现象,但在蛋白水平差异没有统计学意义。与天麻粉治疗组比较较,天麻粉预防组小鼠海马组织中Nrf2,HO-1在mRNA水平均有增高,但在蛋白水平天麻粉预防组蛋白有相应增高,天麻粉治疗组变化无统计学意义,各组中Keap1 mRNA及蛋白水平变化差异无统计学意义,这些提示天麻粉在AD发挥抗氧化作用需要一定的作用时间和累积作用,Keap1 mRNA及蛋白水平无变化,笔者猜测天麻粉在提高小鼠抗氧化能力中并不直接通过提高整条抗氧化应激通路来增强抗氧化能力,而是通过改变Keap1的结构来实现的[22]。在APP/PS1双转基因小鼠模型中,随着小鼠周龄增加,Aβ的积聚加重,Nrf2表达水平均降低。其他研究表明,随着Aβ的聚集,Nrf2调节的抗氧化相关基因的表达也存在异常[23],这些正好与前面所述一致,天麻粉可能通过改变Keap1的结构来激活Nrf2通路,促进Nrf2的细胞核转位,增强下游抗氧化基因的表达,提高机体的抗氧化能力,最终改善APP/PS1双转基因小鼠认知功能;另外,关于传统中药天麻粉也有文献研究发现其具有抗氧化、抗炎作用[24],故笔者推测天麻粉在改善小鼠记忆方面可能与提高抗氧化应激Keap1-Nrf2/HO-1通路上相关蛋白表达有一定关联,且中医药的作用特点是长期、反复,猜测天麻粉对AD的作用中,可能预防的作用要比后期治疗作用表现的更有意义。
天麻微量元素测定研究
[J].湖南中医杂志,1998,doi:10.16808/j.cnki.issn1003-7705.1998.04.072.Therapeutic approaches to Alzheimer' s disease through modulation of NRF2
[J].Neuro Mol Med,2019,doi:10.1007/s12017-018-08523-5.
