酒精性肝病(ALD)是一类由于长期性饮酒导致的慢性进行性肝脏疾病,有数据显示与酒精相关的肝硬化患者的病死率占全球患者病死率的0.9%及占所有肝硬化相关疾病死亡患者的47.9%,对人类的健康造成极大的威胁[1]。目前临床上治疗ALD的药物主要有皮质类固醇、己酮可可碱、抗肿瘤坏死因子-α(TNF-α)制剂和一些抗氧化剂等,但都存在其各自的弊端,如不同个体药物疗效存在差异、只能短期改善症状且并发症多等[2]。藏族药作为我国医药学中仅次于中医药学的一门民族医药,历史悠久,理论体系完整、健全,药物来源纯净,疗效显著[3-4]。而近年来的一些研究表明[5-7],传统医药对ALD的治疗具有良好的疗效,这为寻找治疗ALD的有效药物提供了途径。
短穗兔耳草,藏族药名“直打洒曾”,为玄参科植物短穗兔耳草的干燥全草,主要分布于甘肃、四川、青海和西藏等地。《晶珠本草》记载短穗兔耳草味苦、平,能清肺胃瘀血、排脓,治疗肺痈咳逆、胸满吐脓血等证,具有清热去火、消炎解毒的功效[8-10]。课题组前期研究表明短穗兔耳草对四氯化碳(CCl4)[11],α-异硫氰酸萘酯(ANIT)[12]和乙醇[13]所致的多种小鼠急性肝损伤均有良好的治疗效果。因此本研究在前期实验的基础上基于Toll样受体(TLR)2/髓样分化因子88(MyD88)/核转录因子-κB(NF-κB)和NOD样受体蛋白3(NALP3)信号通路进一步研究短穗兔耳草对慢性酒精性肝损伤的保护作用及其作用机制。
1 材料
1.1 动物
昆明种雄性大鼠60只,SPF级,体质量180~220 g,购自江西中医药大学动物中心,合格证号SCXK(赣)2018-0003,自由饮水,适应性喂养1周后进行实验,本实验符合江西中医药大学动物伦理委员会标准。
1.2 药材
短穗兔耳草由江西中医药大学钟国跃研究员鉴定为玄参科Lagotis brachystachys短穗兔耳草全草。称取短穗兔耳草840 g,晒干剪碎,加10倍体积75%乙醇加热回流提取3次,过滤提取液,用旋转蒸发仪减压回收乙醇,浓缩至无醇味,加双蒸水定容至4.2 L,此为高剂量组(相当于生药给药量2 g·kg-1),取出2.1 L加等体积的蒸馏水得到中剂量组(相当于生药给药量1 g·kg-1),同法制得低剂量组。给药剂量按照人的临床给药剂量(10~15 g)换算成大鼠中剂量给药量剂量,再按照低∶中∶高剂量1∶2∶4的比例得出高剂量组的给药剂量[23]。
1.3 试剂
56度红星二锅头(北京红星股份有限公司,批号20180409);联苯双酯滴丸(万邦德制药集团股份有限公司,批号20151210);天门冬氨酸氨基转移酶(AST),丙氨酸氨基转移酶(ALT),谷胱甘肽(GSH),考马斯亮兰,甘油三酯(TC),总胆固醇(TG)试剂盒,苏木素-伊红(HE)染色液(南京建成生物工程研究所,批号分别为20180628,20180614,20180611,20180609,20180613,20180611,20180528);大鼠白细胞介素-1β(IL-1β)酶联免疫吸附测定(ELISA)试剂盒(欣博盛生物科技有限公司,批号20180607);脱脂奶粉(美国BD公司,批号5160902);过硫酸铵(麦克林生化科技有限公司,批号C10168590);TLR2,NALP3抗体(博奥森生物技术有限公司,批号分别为bs-1019R,bs-10021R);MyD88,NF-κB,二抗(武汉Proteintech公司,批号分别为23230-1-AP,10745-1-AP,SA00001-2);β-肌动蛋白抗体(β-actin,美国GeneTeX公司,批号42858)。
1.4 仪器
DY89-Ⅱ型电动匀浆机(宁波新芝生物科技股份有限公司);Multiskan Go1510型酶标仪(美国Thermo公司);UV2100型紫外分光光度计(日本岛津有限公司);PowerPac Basic型电泳仪,Chemic Dox XR+型凝胶成像仪(美国Bio-Rad公司);WD-9405B型水平摇床(沃德生物医学仪器公司);Centrifuge 5430R型低温冷冻离心机(美国Eppendorf公司);HI1210型捞片机;HistoCore Arcadia C型切片机,TP1020-1型包埋机(德国Leica公司);Nikon elipse ci-s型生物显微镜(日本尼康公司)。
2 方法
2.1 造模、分组及给药
将60只大鼠随机分成6组,每组10只,为正常组,模型组,联苯双酯组(100 mg·kg-1),短穗兔耳草低、中、高剂量组(0.5,1.0,2.0 g·kg-1)。参考文献[14]方法除空白组每天给予蒸馏水灌胃以外,其余各组均采用梯度乙醇法灌胃56%的红星二锅头,连续灌胃8周,第1周用量4 mL·kg-1,以后的每周依次递增2 mL·kg-1,直至增加到10 mL·kg-1。造模的同时进行给药治疗,正常组和模型组给予等体积蒸馏水灌胃,每天1次,灌胃体积按10 mL·kg-1计算。末次给药后12 h内禁食不禁水,12 h后10%水合氯醛(0.35 mL·kg-1)麻醉大鼠,腹主动脉取血,3 000 r·min-1离心10 min分离血清;取血后于冰台上迅速取大鼠肝脏,每组取大鼠肝脏相同部位置于10%的甲醛固定液中固定,取其他肝脏置于离心管中于-80 ℃冰箱保存。
2.2 指标检测
2.2.1 检测大鼠血清中TC,TG,ALT,AST,GSH及IL-1β的含量
取大鼠血清,采用微量酶标法根据试剂盒说明书测定血清中TC,TG,ALT,AST的含量;ELISA检测大鼠血清中IL-1β的含量;取大鼠10%的肝组织匀浆,微量酶标法检测GSH的含量。
2.2.2 HE染色检测肝组织病理学变化
取已经固定好的大鼠肝组织,用刀片切成小块于包埋盒中流水冲洗过夜,梯度乙醇脱水,石蜡浸腊,包埋,切片,HE染色等,于显微镜下观察其病理学形态变化。
2.2.3 Western blot测大鼠肝组织TLR2,MyD88,NF-κB和NALP3蛋白的表达
取60 mg大鼠肝组织放入1.5 mL的离心管中,加2% SDS裂解液1 mL,用组织匀浆仪磨碎后室温放置20 min使其充分裂解,于室温1 000 ×g离心15 min取上清,100 ℃变性15 min,采用BCA蛋白浓度测定试剂盒测定样品的蛋白浓度,根据浓度制备样品后进行常规上样电泳,电泳条件80 V 30 min,120 V 1 h,电泳完于有转膜液的转膜槽中转膜,250 mA 90 min,取出PVDF膜于5%的脱脂牛奶中室温封闭1 h,TBST洗膜3次,每次10 min,β-actin一抗(1∶5 000),TLR2,MyD88,NF-κB,NALP3(1∶2 000)4 ℃孵育过夜,所有抗体用3%BSA稀释,次日取出洗膜后于水平摇床上二抗(1∶5 000)孵育1 h,洗膜,ECL显色,采用Image J软件计算各条带灰度值。
2.3 统计学方法
采用SPSS 21.0统计软件对实验数据进行处理,结果以
3 结果
3.1 对大鼠血清中TC,TG,ALT,AST含量的影响
与正常组比较,模型组ALT,AST,TC,TG含量明显升高(P<0.05,P<0.01);与模型组比较,短穗兔耳草高剂量组TC,TG水平明显降低(P<0.05);短穗兔耳草中、高剂量组AST,ALT水平明显降低(P<0.05,P<0.01)。见表1。
| 组别 | 剂量/g·kg-1 | TC/mmol·L-1 | TG/mmol·L-1 | ALT/U·L-1 | AST/U·L-1 |
|---|---|---|---|---|---|
| 正常 | - | 1.57±0.60 | 0.31±0.10 | 7.73±3.28 | 18.58±3.99 |
| 模型 | - | 2.20±0.361) | 1.39±0.512) | 11.31±2.741) | 24.29±6.061) |
| 联苯双酯 | 0.1 | 2.02±0.26 | 0.96±0.60 | 9.88±5.45 | 20.76±1.04 |
| 短穗兔耳草 | 0.5 | 2.04±0.25 | 1.07±0.37 | 7.01±3.36 | 16.73±4.423) |
| 1 | 1.69±0.43 | 1.10±0.17 | 4.54±2.493) | 15.90±3.294) | |
| 2 | 1.63±0.343) | 0.69±0.223) | 3.78±2.784) | 15.22±4.234) |
3.2 对大鼠肝组织中GSH含量的影响
与正常组比较,模型组GSH水平虽无显著性差异,但也显著下降;与模型组比较,短穗兔耳草高剂量组和联苯双酯组GSH水平明显升高(P<0.05,P<0.01),其他各组虽与模型组无显著差异。见表2。
| 组别 | 剂量/g·kg-1 | GSH/μmol·g-1 |
|---|---|---|
| 正常 | - | 1.06±0.21 |
| 模型 | - | 0.81±0.17 |
| 联苯双酯 | 0.1 | 1.41±0.43) |
| 短穗兔耳草 | 0.5 | 0.97±0.34 |
| 1 | 1.11±0.51 | |
| 2 | 1.61±0.154) |
3.3 对大鼠血清中IL-1β含量的影响
与正常组比较,模型组血清中IL-1β水平明显上升(P<0.05);与模型组比较,短穗兔耳草低、中、高剂量组和联苯双酯组血清中IL-1β含量均明显降低(P<0.05,P<0.01)。见表3。
| 组别 | 剂量/g·kg-1 | IL-1β/ng·L-1 |
|---|---|---|
| 正常 | - | 46.22±5.44 |
| 模型 | - | 87.72±6.421) |
| 联苯双酯 | 0.1 | 39.65±6.984) |
| 短穗兔耳草 | 0.5 | 44.57±4.564) |
| 1 | 45.84±5.144) | |
| 2 | 48.92±5.183) |
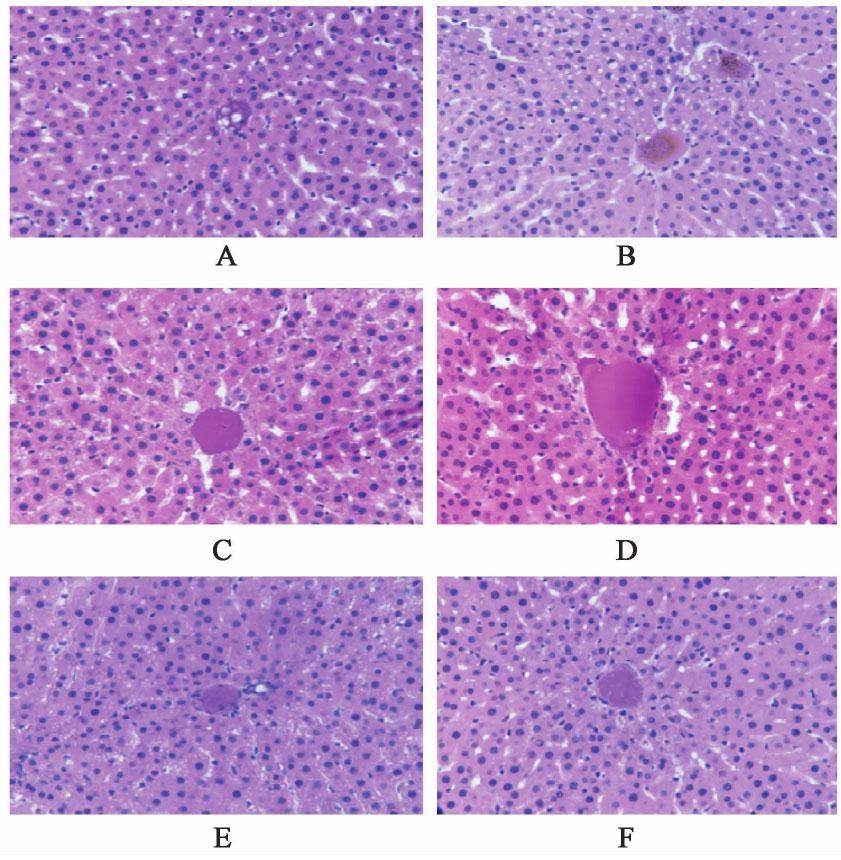
3.4 对大鼠肝组织病理学的影响
正常组大鼠肝组织表面红润细腻而光滑,显微镜下肝细胞形态正常,肝血窦及门管区清晰,肝细胞呈发散状向四周排列。模型组大鼠肝组织表面有大量红黄相间的细颗粒,显微镜下肝细胞排列散乱,体积增大,细胞胞质溶解,其内有大量的脂滴空泡形成,空泡成小泡状或颗粒状;呈现肝细胞灶状坏死,肝血窦扩张,并伴有炎性浸润。联苯双酯组较模型组脂滴空泡减少明显,肝血窦扩张减轻,炎性浸润减少。短穗兔耳草低剂量组显微镜下脂滴空泡仍明显,可见点状坏死,肝血窦扩张并伴有轻微炎性浸润。短穗兔耳草中、高剂量组显微镜下情况有所改善,细胞水肿明显减少,肝血窦扩张减轻,炎性浸润减少。见图1。
3.5 对大鼠TLR2/MyD88/NF-κB和NALP3信号通路蛋白表达的影响
与正常组比较,模型组经8周酒精灌胃造模后TLR2,MyD88,NF-κB蛋白表达水平明显上调(P<0.05,P<0.01);与模型组比较,短穗兔耳草高剂量组肝组织中TLR2,MyD88,NF-κB和NALP3表达水平均显著下调(P<0.01);短穗兔耳草低剂量组NALP3蛋白及短穗兔耳草中剂量组NF-κB,NALP3蛋白表达水平明显下降(P<0.05,P<0.01)。见图2,表4。
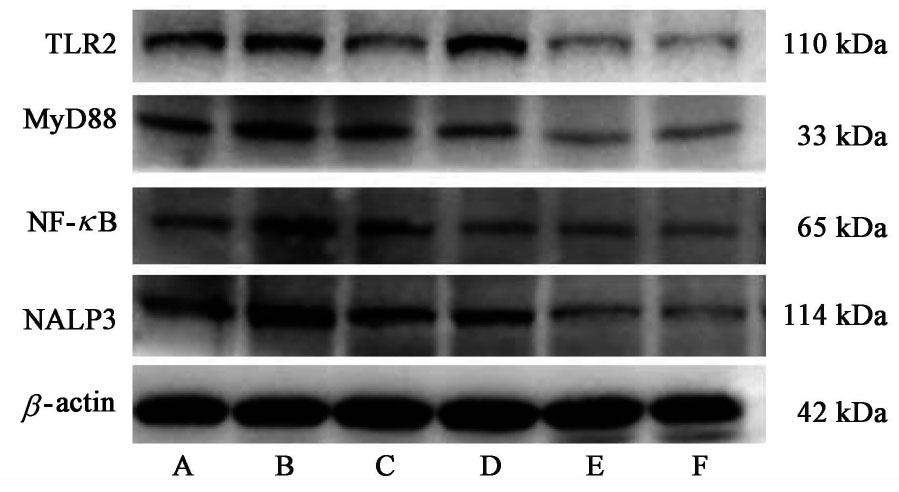
| 组别 | 剂量/g·kg-1 | TLR2/β-actin | MyD88/β-actin | NF-κB/β-actin | NALP3/β-actin |
|---|---|---|---|---|---|
| 正常 | - | 0.85±0.14 | 0.91±0.02 | 1.10±0.12 | 0.76±0.02 |
| 模型 | - | 1.21±1.102) | 1.18±0.301) | 1.42±0.131) | 0.88±0.05 |
| 联苯双酯 | 0.1 | 1.07±0.14 | 0.93±0.14 | 1.15±0.58 | 0.61±0.034) |
| 短穗兔耳草 | 0.5 | 1.35±0.10 | 0.92±0.12 | 1.16±0.18 | 0.56±0.094) |
| 1 | 1.12±0.15 | 0.96±0.16 | 0.97±0.134) | 0.55±0.114) | |
| 2 | 0.84±0.154) | 0.45±0.104) | 0.74±0.244) | 0.42±0.164) |
4 讨论
酒精性肝病是一类由于长期性饮酒导致的慢性进行性肝脏疾病,疾病的初期表现为酒精性指肪肝,之后逐渐发展为酒精性肝炎、肝纤维化、肝硬化等,如果严重酗酒甚至会引起肝细胞坏死导致肝功能衰竭从而引起一系列的并发症[15-16]。近年来随着嗜酒人数的上升,酒精性肝病在国内外均呈现逐年上涨的趋势,根据我国某些地区流行病学调查发现,我国成人的酒精性肝病的发病率在4%左右。嗜酒者中90%以上发展为脂肪肝,10%~35%发展为酒精性肝炎,8%~20%的慢性嗜酒者演变为肝硬化,甚至是肝癌[17]。对人类的健康造成极大的威胁。而目前对于ALD的治疗尚缺乏针对性强、疗效高及副作用小的药物。
课题组前期研究结果表明短穗兔耳草对乙醇所致的急性酒精性肝损伤具有良好的保护作用[13],表示其作用与氧化应激及对炎症因子的调控有关。因此本文在前期研究的基础上基于TLR/MyD88/NF-κB和NALP3信号通路研究短穗兔耳草提取物抗慢性酒精性肝损伤大鼠的作用机制。短穗兔耳草主要含有黄酮类、环烯醚萜苷类、苯丙素苷类等多种化学成分,已有药理研究表明其具有抗各种(ANIT,四氯化碳,急性酒精性)肝损伤、高尿酸血症、抗氧化等多种药理活性[18-20]。长期饮酒使乙醇大量积累在体内,当体内乙醇的摄入量超过人体代谢能力时,经肝脏代谢的80%的乙醇会通过乙醇脱氢酶氧化为乙醛,乙醛对肝脏有直接毒性,能使肝脏组织受损而影响肝细胞膜的通透性,使大量AST,ALT入血,血清中AST,ALT升高[21]。大量乙醇的摄入还会影响线粒体内脂肪酸的代谢,使肝内TG大量聚集。本研究显示不同剂量的短穗兔耳草提取物能够显著降低大鼠血清中AST,ALT,TC,TG的含量,同时,能够显著降低血清中炎症因子IL-1β的含量,其中高剂量组的总体效果尤为显著。此外,乙醛的毒性也能够破坏酶的结构功能,抑制GSH的合成,减弱SOD的抗氧化功能,产生大量的MDA等过氧化物[22]。本研究显示短穗兔耳草高剂量组均能够升高肝组织GSH的含量,而对SOD和MDA无明显影响,说明短穗兔耳草对慢性酒精性大鼠具有保护作用。
TLR2/MyD88/NF-κB信号通路是机体炎症体系中的重要途径,其广泛存在于各种组织细胞中,参与多种疾病的发生与调控。TLR2作为一种跨膜蛋白,能够识别并启动不同的病原相关分子模式(PAMP)从而启动信号转导途径,激活的TLR2能够活化下游的信号因子MyD88最终激活NF-κB,促进炎症因子的释放(如IL-1β,TNF-α等)。有研究显示酒精轻肝纤维化大鼠肝组织中TLR4,MyD88,NF-κB的表达显著升高,药物干预后表达显著下降,说明其作用机制可能与TLR2/MyD88/NF-κB信号通路有关[16]。本研究结果显示,不同剂量的短穗兔耳草提取物均能不同程度地降低蛋白TLR2,MyD88,NF-κB和NALP3的表达,其中高剂量组的总体效果最为明显。说明短穗兔耳草能够通过抑制TLR2/MyD88/NF-κB和NALP3信号通路的表达,从而达到对慢性酒精性肝损伤大鼠的保护作用。
综上所述,藏族药短穗兔耳草对酒精诱导的慢性酒精性肝损伤大鼠具有一定的保护作用,其机制与TLR2/MyD88/NF-κB和NALP3信号通路有关,但目前关于酒精性肝病与TLR2/MyD88/NF-κB和NALP3信号通路的药理研究报道并不多见。因此本研究将进一步研究短穗兔耳草不同提取部位对慢性酒精性肝损伤大鼠的保护作用,为研究短穗兔耳草对慢性酒精性肝损伤的保护作用提供实验依据,有利于对其机制进一步深入研究。

