中药注射剂是在中医理论指导下,采用现代科学技术,将中药饮片提取、纯化后制成的供注入体内的溶液、乳状液及供临用前配制成溶液的粉末或浓溶液的无菌制剂[1]。与丸、散、膏、丹等传统中药剂型相比,具有药效迅速、生物利用度高等优势,尤其在治疗心脑血管疾病、急性感染性疾病、恶性肿瘤等疾病中发挥着不可替代的重要作用[2]。注射用丹参多酚酸由丹参水溶性提取物中分离出的多种酚酸类成分制成的冻干粉针,具有纯度高、毒性小、安全性好、疗效显著等优点[3-4],主要用于中风病中经络(轻中度脑梗死)恢复期瘀血阻络证,症见半身不遂,偏身麻木等[5]。注射用丹参多酚酸是直接入血的注射剂,其主要成分酚酸类含有易被破坏的官能团结构,而现阶段还缺少系统性稳定性的研究。人用药品注册技术要求国际协调会议(ICH)中Q2A和Q3B要求,对于药物的含量测定和降解产物的测定,需要建立并验证一个稳定性指示性的分析方法[6]。系统稳定性和稳定性指示性分析方法(stability-indicating method,S-I)可反映出在稳定性试验条件下药物质量的变化,被广泛应用于药物的质量控制和稳定性研究等领域[7]。
本研究采用UPLC-Q-TOF-MS/MS技术对中药注射剂注射用丹参多酚酸进行定性、定量研究,考察注射用丹参多酚酸中酚酸类成分的降解规律及其降解途径,指导科学合理的设计和保障中药制剂,特别是中药注射剂的质量。此外,在稳定性研究的基础上建立S-I方法,使之能较准确测定其主要成分及其降解产物,为提高中药注射剂质量控制水平和用药安全性提供技术支持。
1 材料
注射用丹参多酚酸(天津天士力之骄药业有限公司,国药准字Z20110011,批号12121102,12123607,12122807)。丹酚酸B,紫草酸,迷迭香酸,丹参素,原儿茶醛,咖啡酸对照品(天津中新药业集团股份有限公司,批号分别为W15-5-7,W14-8-0,W10-5-3,W10-2-6,W06-2-5,W05-5-6,纯度均≥98%)。色谱甲酸、乙腈(美国Sigma公司),所用水为屈臣氏蒸馏水。
Acquity UPLC H-Class超高效液相色谱,Quattro Premier XE MS型质谱仪(美国Waters公司);Mill-QⅡ型超纯水仪(美国Millipore公司);H1650-W型离心机(中国湘仪离心机仪器有限公司);SSW-600-7S型水浴锅(中国博讯实业有限公司);AX205型1/10万电子天平(瑞士Mettler-Toledo公司)。
2 方法
2.1 供试品溶液配制
精密称取注射用丹参多酚酸粉末5.00 mg,置于10 mL棕色量瓶,超纯水定容,配制成质量浓度为0.5 g·L-1的供试品储备液。
2.2 对照品溶液配制
精密称取丹酚酸B,迷迭香酸,紫草酸,丹参素,原儿茶醛,咖啡酸,分别置于10 mL量瓶中,甲醇定容,4 ℃保存,配制成质量浓度均为0.5 g·L-1的对照品储备液。
2.3 色谱及质谱条件
UPLC色谱条件为Waters ACQUITY T3色谱柱(2.1 mm×50 mm,1.7 μm),流动相乙腈(A)-0.1%甲酸水(B)梯度洗脱(0~3 min,5%~10%A;3~8 min,10%~15%A;8~15 min,15%~40%A),检测波长280 nm,流速0.3 mL·min-1,进样量5 μL,温度25 ℃。
质谱条件为电喷雾离子源,负离子检测模式,扫描范围m/z 100~1 700,毛细管电压3.02 kV,去溶剂化温度400 ℃,离子源温度100 ℃,气帘气流量50 L·h-1,脱溶剂气流量600 L·h-1。
2.4 注射用丹参多酚酸多成分定性
取2.1项下注射用丹参多酚酸储备液,超纯水稀释至100 mg·L-1,按照2.3项下色谱及质谱条件进行UPLC-Q-TOF-MS及UPLC-Q-TOF-MS/MS分析。通过与对照品对照及查阅文献参考,对注射剂中各成分进行定性鉴别。
2.5 中药注射剂注射用丹参多酚酸制剂降解机制
采用UPLC-Q-TOF进行分析,紫外响应下以面积归一化法统计超过总峰面积5%的各色谱峰为制剂主要成分,以丹酚酸B降解至初始浓度10%时,终止反应。
精密称取注射用丹参多酚酸5.00 mg,置于10 mL棕色量瓶中,分别按以下方法进行处理,超纯水定容,密封,80 ℃水浴保存;3%双氧水定容,密封保存;分别以0.1 mol·L-1的KCl,CaCl2和AlCl3定容,密封保存;超纯水定容后,分别置于1 023×10 Lux 200白炽灯和18 Lux 200紫外灯下照射,密封。分别于0,1,2,5,10,30,60,80,100,120,150,200 h时取样,离心后进样分析。
2.6 稳定性分析
精密度、重复性试验,注射用丹参多酚酸中各成分保留时间RSD均<2%,峰面积RSD均<3%,符合要求,表明精密度、重复性良好。在注射用丹参多酚酸稳定性压力条件降解产物研究的基础上,针对在高温、氧化、光照、金属离子条件下的稳定性样品进行降解产物初步富集。将初步富集的稳定性样品冻干后,加入甲醇水溶液溶解,涡旋混匀,作为储备液。取储备液适量,加入50%甲醇逐级稀释进样,监测检测限,信噪比S/N>3,在此条件下可同时测定注射用丹参多酚酸原成分及其降解产物。
注射用丹参多酚酸在各降解条件下色谱图见图1,由图可知,注射用丹参多酚酸原成分及其降解产物在此方法下可同时测定。
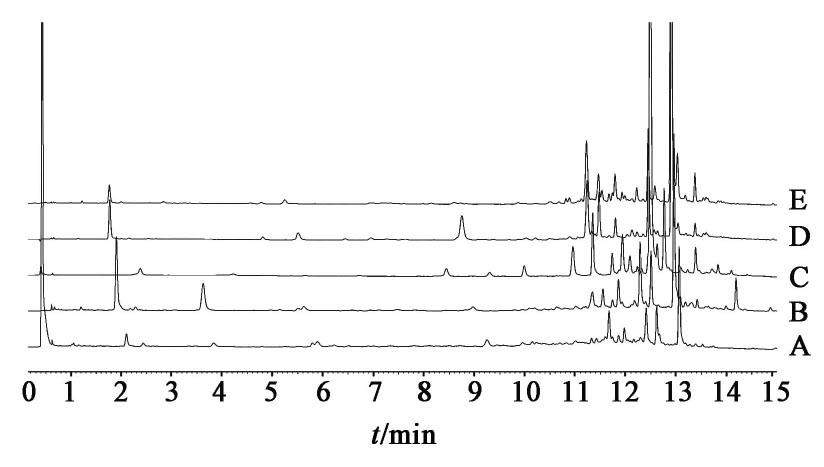
3 结果与分析
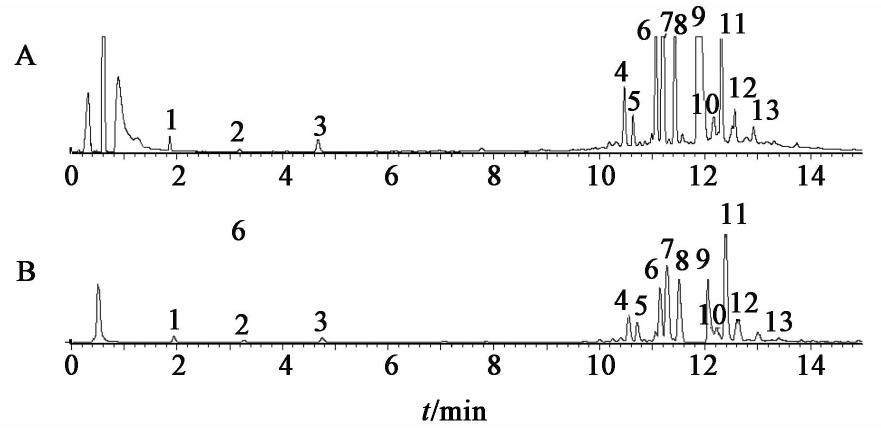
3.1 注射用丹参多酚酸多成分定性、定量分析
注射用丹参多酚酸UPLC-Q-TOF-MS一级质谱全扫描图见图2,共鉴定出13个成分,其中成分1,2,3,7,8,9与对照品保留时间、一级质谱以及二级碎片离子一致,被分别鉴定为丹参素、原儿茶醛、咖啡酸、迷迭香酸、紫草酸、丹酚酸B。成分12准分子离子峰m/z 701[M-H]-和m/z 731[M-H]-,其结构比丹酚酸B及其同分异构体少1个O,在二级碎片中,与丹酚酸B及其同分异构体均含有m/z 519,321,推断可能为丹酚酸B,丹酚酸E,丹酚酸L,其中羧基被醛基取代,还需要红外光谱、核磁共振等技术进一步确认。负离子采集下注射用丹参多酚酸中主要成分的质谱信息见表1。
| No. | tR/min | m/z | 分子式 | δ | MS/MS | 成分 |
|---|---|---|---|---|---|---|
| 1 | 1.87 | 197.045 4 | C9H10O5 | 0.5 | 179.033 7/135.044 1 | 丹酚酸A |
| 2 | 3.19 | 137.023 8 | C7H6O3 | 0 | 119.027 5/108.020 9 | 原儿茶醛 |
| 3 | 4.68 | 179.034 5 | C9H8O4 | 0 | 179.026 4/135.045 2 | 咖啡酸 |
| 4 | 10.47 | 537.103 0 | C27H22O12 | -0.6 | 537.101 5/493.112 0/339.051 0/295.060 8 | 丹酚酸H[8] |
| 5 | 10.66 | 417.082 0 | C20H18O10 | -0.7 | 417.0823/373.0905/197.0453/175.0392 | 丹酚酸D[8] |
| 6 | 11.07 | 717.147 2 | C36H30O16 | 0.6 | 717.143 5/519.093 1/493.114 5/321.034 5 | 丹酚酸E[9] |
| 7 | 11.20 | 359.076 3 | C18H16O8 | -1.1 | 359.080 9/197.044 3/161.023 4 | 迷迭香酸 |
| 8 | 11.44 | 537.103 0 | C27H22O12 | -0.6 | 493.114 4/295.060 2/197.046 1 | 紫草酸 |
| 9 | 11.87 | 717.146 5 | C36H30O16 | -0.1 | 717.132 1/519.095 6/321.045 3 | 丹酚酸B |
| 10 | 12.17 | 717.143 9 | C36H30O16 | -2.2 | 717.132 1/519.092 2/321.041 5 | 丹酚酸B/E异构体[9] |
| 11 | 12.31 | 717.145 3 | C36H30O16 | -0.4 | 717.145 6/519.093 0/321.040 0 | 丹酚酸L [10] |
| 12 | 12.57 | 701.150 5 | C36H30O15 | -0.3 | 701.148 3/519.092 2/503.097 4/321.039 9/295.039 9 | - |
| 13 | 12.57 | 731.161 0 | C37H32O16 | -0.3 | 731.163 7/551.115 9/533.109 3 | 9′″-紫草酸B单甲酯异构体[10] |
3.2 中药注射剂注射用丹参多酚酸制剂降解产物分析
3.2.1 温度的影响
注射用丹参多酚酸在高温条件下,反应终止时刻点色谱见图3,采用峰面积半定量的方式比较降解前后化学成分含量的变化,反应终止时丹酚酸B,丹酚酸E,丹酚酸D,丹酚酸L,m/z 701和9′″-紫草酸B单甲酯isomer的含量呈现持续下降趋势;原儿茶醛,丹参素,咖啡酸,丹酚酸H,丹酚酸B/E异构体,迷迭香酸,紫草酸含量先增大后降低;反应终止时,丹酚酸B/E isomer,咖啡酸已降解完全。而新增的6个成分中,成分Ⅱ,Ⅵ,Ⅷ,Ⅹ,Ⅻ,Ⅷ含量呈现上升趋势。
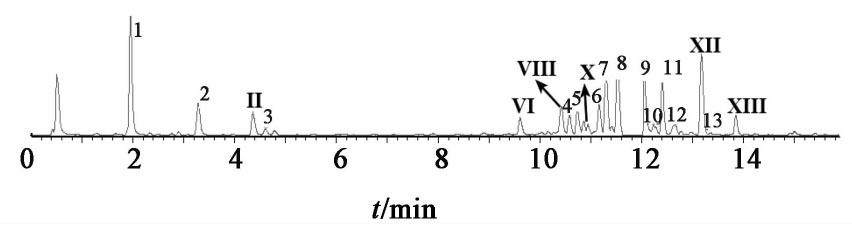
其中,成分Ⅱ准分子离子m/z 539 [M-H]-,二级碎片离子m/z 341推测其为m/z 539脱去1分子丹参素形成,m/z 297为m/z 341继续脱去1分子CO2形成。根据文献[11]推测为丹酚酸S。
成分Ⅵ准分子离子m/z 537[M-H]-,二级碎片离子m/z 493推测其为m/z 537脱去1分子CO2形成,m/z 295为m/z 493继续脱去1分子丹参素形成。根据参考文献[12]推测为紫草酸异构体。
成分Ⅷ和Ⅹ准分子离子m/z 715[M-H]-,二级碎片离子均含有m/z 393,321,其相对分子质量比丹酚酸B,丹酚酸E,丹酚酸L少2,推测其结构中比丹酚酸B及其同分异构体少2个H。要准确确定其分子结构,还需要红外光谱、核磁共振等技术做进一步确认。
成分Ⅻ和Ⅷ准分子离子m/z 491[M-H]-,二级碎片离子m/z 293推测其为m/z 491脱去1分子丹参素形成,m/z 197为m/z 491继续脱去1分子C17H11O5形成。依据保留时间[11,13]推测成分Ⅻ和Ⅷ分别为丹酚酸C和异丹酚酸C。
3.2.2 氧化的影响
注射用丹参多酚酸在氧化条件下,降解反应终止时刻点色谱见图4,至反应终止时丹酚酸B,丹酚酸E,丹酚酸L,迷迭香酸,m/z 701和9′″-紫草酸B单甲酯异构体,丹酚酸B/E异构体,紫草酸含量呈现持续下降趋势;原儿茶醛,丹参素,咖啡酸,丹酚酸H,丹酚酸D含量先上升后下降;其中原儿茶醛、丹酚酸B/E异构体已降解完全。而新增的4个成分含量呈现上升趋势。其中,成分Ⅳ准分子离子m/z 313[M-H]-,二级碎片离子m/z 269推测其为m/z 313脱去1分子CO2形成。根据文献[11]推测为丹酚酸F。
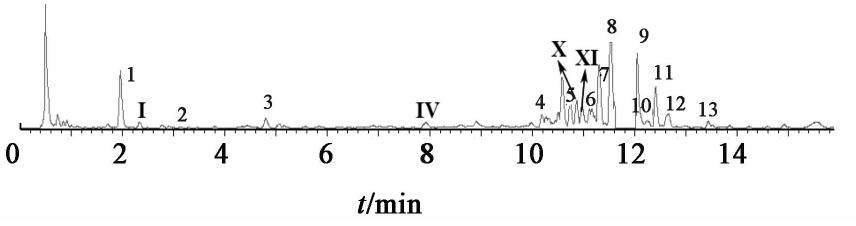
3.2.3 一价、二价、三价金属离子的影响
注射用丹参多酚酸在0.1 mol·L-1的KCl中无明显变化;在二价金属离子条件下,新增成分Ⅷ。0时刻点的13个峰,至反应终止时丹酚酸B,丹酚酸E,丹酚酸L,丹酚酸B/E异构体,丹酚酸D,m/z 701和9′″-紫草酸B单甲酯异构体,迷迭香酸含量呈现持续下降趋势;原儿茶醛、丹参素、咖啡酸、丹酚酸H含量先增大后下降;紫草酸含量呈现持续上升趋势;其中原儿茶醛、迷迭香酸、丹酚酸B/E异构体已降解完全。
注射用丹参多酚酸在三价金属离子条件下,共生成4个降解产物。降解反应终止时刻点色谱见图5,至反应终止时丹酚酸B,丹酚酸L,丹酚酸B/E异构体,丹酚酸D,丹酚酸H,草酸,m/z 701和9′″-紫草酸B单甲酯异构体含量呈现持续下降趋势;丹酚酸E含量呈现持续上升趋势;原儿茶醛、咖啡酸、丹参素、迷迭香酸含量先增大后下降;其中咖啡酸,原儿茶醛,丹酚酸D,丹酚酸B/E异构体,紫草酸,m/z 701和9′″-紫草酸B单甲酯异构体已降解完全。
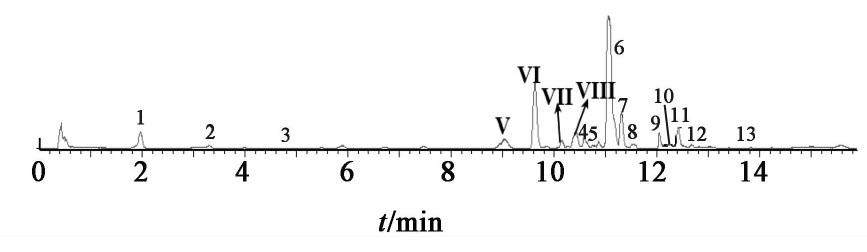
其中,成分Ⅶ和成分Ⅷ准分子离子m/z 715[M-H]-,且具有相同的二级裂解碎片,推测可能为同分异构体。但要确定其分子结构,还需结合红外光谱,核磁共振等技术做进一步确证。
3.2.4 光照的影响
紫外照射条件下,注射用丹参多酚酸无明显降解。模拟日光的白炽灯光照条件下,光照降解条件下反应终止时质谱见图6。至反应终止时丹酚酸B,迷迭香酸,丹酚酸E,丹酚酸L,m/z 701和9′″-紫草酸B单甲酯异构体,丹酚酸D,丹酚酸B/E异构体含量呈现持续下降趋势;原儿茶醛,咖啡酸,丹参素,丹酚酸H,紫草酸含量先上升后下降;其中迷迭香酸、原儿茶醛、丹酚酸B/E异构体已降解完全。而新增的3个成分含量呈现上升趋势。
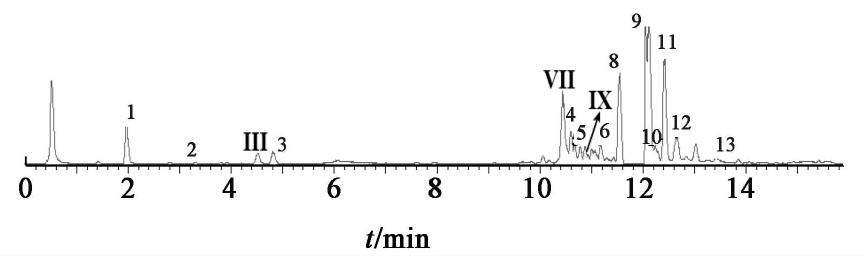
其中,成分Ⅲ准分子离子m/z 177[M-H]-,二级碎片离子m/z 133为分子离子峰m/z 177脱去1分子CO2形成,其相对分子质量比咖啡酸少2。要确定其分子结构,还需结合红外光谱,核磁共振等技术做进一步确证。
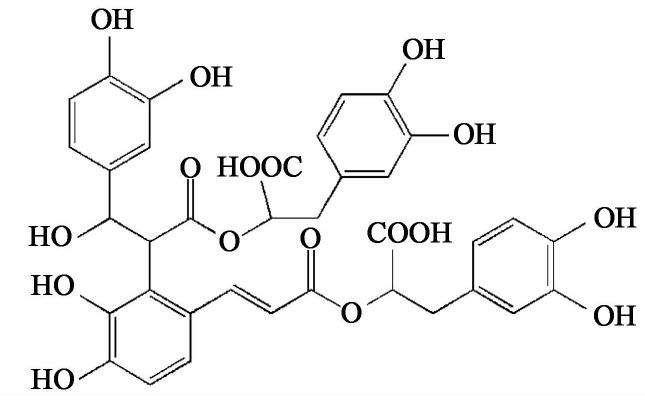
成分Ⅸ准分子离子m/z 735[M-H]-,其相对分子质量比丹酚酸B及其同分异构体多了1分子H2O;二级主要碎片离子m/z 717为分子离子峰m/z 735脱去1分子H2O,m/z 537为m/z 735继续脱去1分子C9H9O4,m/z 357为m/z 717脱去2分子C9H9O4形成。可能的结构式见图7。
注射用丹参多酚酸在高温、氧化、光、二价和三价金属离子中共有13个降解产物,其质谱信息见表2。各种条件下总降解产物见表3,结果显示高温和三价离子条件下具有相同的降解产物紫草酸异构体;高温、光照、二价和三价金属离子条件下具有相同的降解产物m/z 715;高温和氧化条件下具有相同的降解产物m/z 715。
| No. | tR/min | m/z | 分子式 | δ | MS/MS | 降解产物 |
|---|---|---|---|---|---|---|
| Ⅰ | 2.28 | 153.018 9 | C7H5O4 | -2.0 | - | 原儿茶酸 |
| Ⅱ | 4.38 | 539.083 0 | C27H24O2 | 0.6 | 539.082 1/341.027 7/297.043 2 | 丹酚酸S或T |
| Ⅲ | 4.44 | 177.018 7 | C9H6O4 | -1.7 | 177.017 9/133.092 9 | - |
| Ⅳ | 7.83 | 313.071 2 | C17H14O6 | -1.9 | - | 丹酚酸F |
| Ⅴ | 8.94 | 715.129 9 | C36H28O16 | -2.4 | 715.129 9/671.141 4/393.082 2/269.078 6 | - |
| Ⅵ | 9.63 | 537.103 1 | C27H22O12 | 0.2 | 537.101 1/493.111 5/295.060 4 | 紫草酸异构体 |
| Ⅶ | 10.09 | 715.129 9 | C36H28O16 | -1.5 | 715.129 9/671.142 6/393.081 9/295.059 3 | - |
| Ⅷ | 10.45 | 715.128 5 | C36H28O16 | -2.1 | 715.129 5/517.075 0/393.082 2/321.039 4/195.024 9 | - |
| Ⅸ | 10.55 | 735.155 4 | C36H32O17 | 0.3 | 735.158 5/717.150 1/537.104 0/519.088 4/357.061 8 | - |
| Ⅹ | 10.80 | 715.129 0 | C36H28O16 | -1.0 | 715.128 7/671.144 5/393.078 4/321.049 7 | - |
| Ⅺ | 10.90 | 723.118 8 | C34H28O18 | -0.8 | 723.119 3/537.098 0/493.118 3/295.064 8 | - |
| Ⅻ | 13.17 | 491.098 0 | C26H20O10 | -1.4 | 491.097 5/311.054 4/293.044 3/197.044 4 | 丹酚酸C |
| Ⅷ | 13.84 | 491.097 2 | C26H20O10 | 0.2 | 491.098 2/293.045 3/197.048 5 | 丹酚酸C异构体 |
| No. | 降解产物 | 高温 | 氧化 | CaCl2 | AlCl3 | 光照 |
|---|---|---|---|---|---|---|
| Ⅰ | 原儿茶酸 | √ | ||||
| Ⅱ | 丹酚酸S或T | √ | ||||
| Ⅲ | 178 | √ | ||||
| Ⅳ | 丹酚酸F | √ | ||||
| Ⅴ | 716 | √ | ||||
| Ⅵ | 紫草酸异构体 | √ | √ | |||
| Ⅶ | 716 | √ | ||||
| Ⅷ | 716 | √ | √ | √ | √ | |
| Ⅸ | 736 | √ | ||||
| X | 716 | √ | √ | |||
| Ⅺ | 724 | √ | ||||
| Ⅻ | 丹酚酸C | √ | ||||
| Ⅷ | 丹酚酸C异构体 | √ |
4 结论与讨论
注射用丹参多酚酸在高温、氧化、二价金属离子、三价金属离子、光照不同条件下分别新增成分6,4,1,4,3个;结果显示制剂对氧化、高温更为敏感,提示应注意环境温度和与空气接触的控制,金属离子在医疗器械容器及常见模拟体液中使用频率较高,建议严格控制。
在降解机制研究中,丹酚酸B,丹酚酸L,m/z 701,9′″-紫草酸B单甲酯异构体含量呈现持续下降趋势;丹参素、原儿茶醛、咖啡酸含量先增大后降低,可见不适合用于质量控制。从降解产物中推测注射用丹参多酚酸注射剂中大分子丹参多元酚酸通过苯并呋喃的开环、酯键的断裂、脱羧、脱水反应降解为小分子酚酸类成分。
本研究建立了注射用丹参多酚酸及其降解产物的UPLC稳定性指示性分析方法,在现有的色谱条件下,该方法具有足够的灵敏度,且可重复性较强,可用来对注射用丹参多酚酸注射剂进行稳定性角度的质量控制。由于其对各条件降解产物的覆盖能力,可用于制剂在生产、储存等条件下样品的随性检验。为中药注射剂的稳定性及安全性评价提供技术支持。
Identification of multiple components in Guanxinning injection using hydrophilic interaction liquid chromatography/time-of-flight mass spectrometry and reversed-phase liquid chromatography/time-of-flight mass spectrometry
[J].Rapid Commun Mass Sp,2011,25(11): 1661-1674.
