哮喘是一种常见的呼吸系统疾病,临床主要表现为咳嗽、喘息、胸闷和气促,其特点是反复发作性的气道阻塞和支气管痉挛。每年因哮喘而死亡的人数大约有25万,带来了较大的社会和经济负担,哮喘的发病原因较为复杂,主要由遗传和环境因素共同引起[1]。目前,治疗哮喘常采用抗炎、缓解支气管痉挛和舒张平滑肌等方案,虽然可以有效控制哮喘症状,但受禁忌症以及治疗后副作用的限制,大部分哮喘患者治疗后仍有哮喘症状且生活质量较差[2]。随着现代医学的进步,治疗哮喘的方案一直在完善,但哮喘的发病机制仍不明确。因此,寻找哮喘的新治疗靶点和潜在药物具有重要意义。
哮喘的发病与遗传因素相关,特别是与哮喘发病相关的关键基因,其可能在哮喘的发病过程中具有重要作用[3]。有研究表明,CD4+ T细胞亚群失衡是导致哮喘的主要因素,辅助性T细胞(Th)2细胞分化失常,过敏性哮喘患者鼻上皮细胞中的基因表达出现甲基化与哮喘的发病有关[4]。但是差异表达基因与哮喘发病的关系尚未明确阐释,因此,探索正常人与哮喘患者的差异表达基因可能对寻找治疗哮喘的新靶点具有重要作用。微阵列和高通量测序可同时提供人类基因组中数千个基因的表达水平,适用于获取哮喘基因分子水平信息。本研究拟利用生物信息学工具对正常人和哮喘患者的基因表达谱数据进行解析,筛查哮喘相关的差异表达基因,并通过医学本体信息检索平台(Coremine Medical,http://www.coremine.com/medical/)分析具有潜力治疗哮喘的小分子药物,为哮喘的发病机制研究及潜在治疗药物研制提供参考。
1 材料
从基因表达数据库(gene expression omnibus,GEO)下载与哮喘相关的GSE74986的基因表达谱。由Mark McCrear等提交,实验平台基于Agilent的GPL6480平台。GSE74986数据集包含86个样本,样本取自86个参与者的支气管肺泡灌洗液的细胞RNA,包括74个哮喘患者样本和12个正常人样本。
2 方法
2.1 差异表达基因的分析
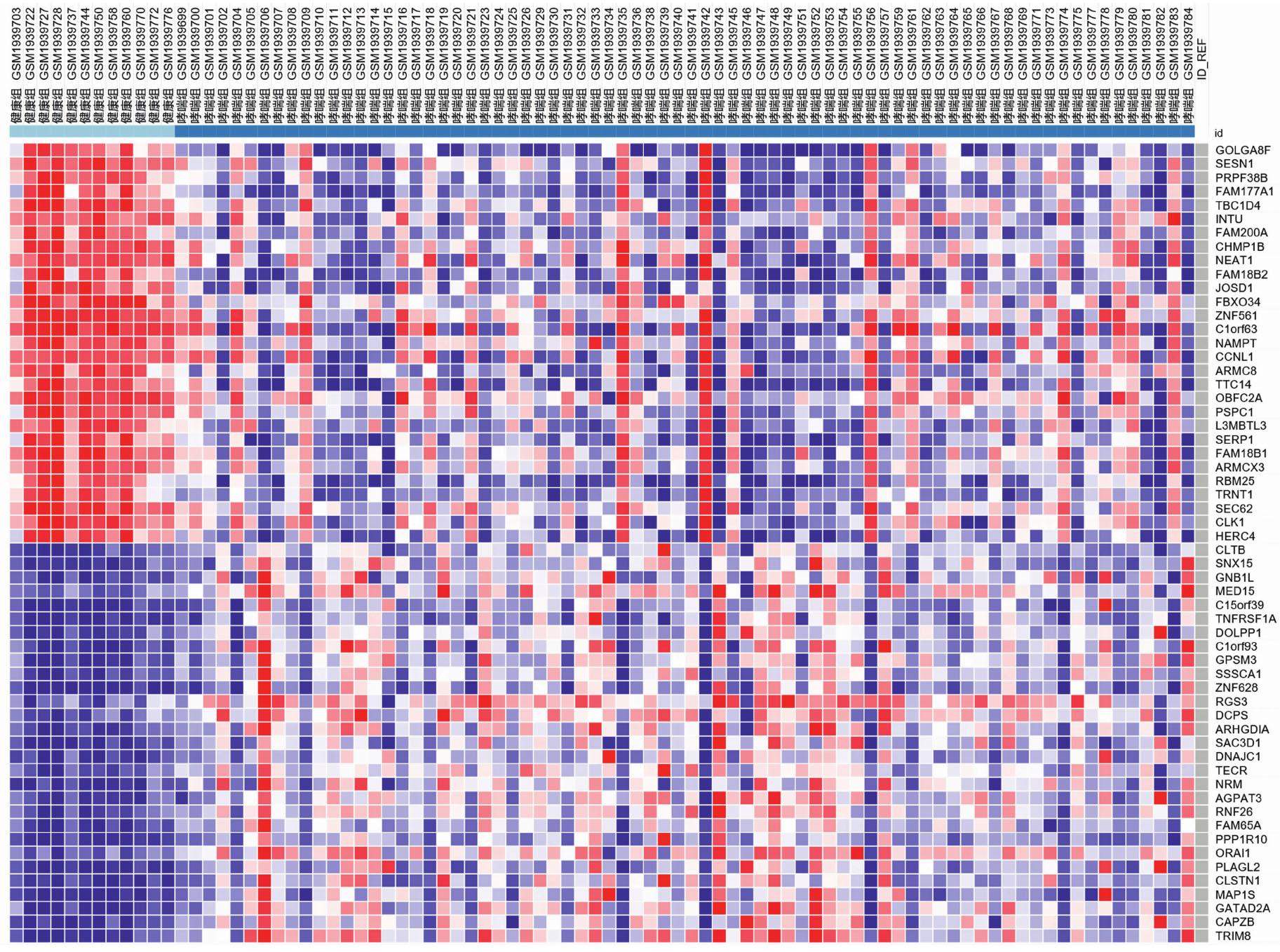
使用GEO在线软件GEO2R进行差异表达基因的分析,将样本分为哮喘组和健康组。使用调整后的P及差异倍数(fold change,FC)进行差异基因的质量控制。当调整后的P<0.01和|log2FC|≥1则认为差异具有统计学意义。使用Morpheus在线工具(https://software.broadinstitute.org/morpheus/)得出差异表达基因热图。
2.2 差异表达基因的基因本体(GO)分析
GO分析是一种用于注释基因和基因产物的常用方法,可用于鉴定高通量基因组或转录组数据的特征生物学属性。GO分析主要含3个方面:细胞组分(cell component,CC),分子功能(molecular function,MF)和生物过程(biological process,BP)[5]。将差异表达基因列表导入DAVID 6.8数据库(https://david.ncifcrf.gov/)进行GO分析,从而得到基因的功能水平分析结果。P<0.05表示具有统计学意义。
2.3 差异表达基因的京都基因与基因组百科全书(KEGG)分析
KEGG是基因功能系统分析的知识库,将基因组信息与高阶功能信息联系起来,用于基因与生物学通路的关系分析,将差异表达基因列表导入DAVID 6.8数据库进行KEGG分析,从而得到基因富集生物学通路的分析结果[5]。P<0.05表示具有统计学意义。
2.4 差异表达基因和核心基因的蛋白质-蛋白质相互作用(PPI)分析
为了进一步探索差异表达基因之间的相互作用关系和进一步筛选出核心基因,将差异表达基因和筛选出的核心基因列表导入String 10.5数据库进行分析,以综合分数(combined score)>0.4为筛查标准[6]。
2.5 差异表达基因的模块分析
使用Cytoscape 3.6.1自带的插件MCODE筛选差异表达基因中PPI网络的模块。筛选标准为degree cutoff=2,node score cutoff=0.2,K-score=2,max deapth=100。此外,对模块中的差异表达基因进行GO和KEGG分析,P<0.05表示具有统计学意义[7]。
2.6 治疗哮喘的相关药物筛选
Coremine Medical可用于发掘治疗某种疾病的潜在药物,将核心基因输入Coremine Medical搜索框,根据P大小筛选出前十的小分子药物,P<0.05表示具有统计学意义[8]。
3 结果
3.1 差异表达基因
根据筛选条件,发现哮喘组和健康组之间的510个差异基因,其中上调基因共有29个,下调基因共有481个。图1中只展现了前29个上调基因及前29个下调基因。
3.2 差异表达基因的GO分析
上调的差异表达基因在细胞组分中显著富集,包括核小体、核染色质等;生物过程主要富集在染色质沉默、调节RNA聚合酶Ⅱ启动子响应缺氧的转录,髓样分化因子88(MyD88)依赖性Toll样受体信号通路等;分子功能主要富集在蛋白质异二聚化活性和DNA结合等。下调的差异表达基因也在细胞组分中显著富集,包括细胞溶质、细胞外外泌体、细胞核等;生物学过程主要富集在蛋白质转运、细胞-细胞黏附等;分子功能主要富集在蛋白质结合、三磷酸腺苷(ATP)结合、三磷酸鸟苷(GTP)酶活性等。见表1。
| 差异表达基因 | 分类 | 生物功能 | P |
|---|---|---|---|
| 上调 | BP | 染色质沉默(chromatin silencing) | 3.97×10-5 |
| BP | 调节RNA聚合酶Ⅱ启动子响应缺氧的转录(regulation of transcription from RNA polymerase Ⅱ promoter in response to hypoxia) | 4.09×10-2 | |
| BP | MyD88依赖性Toll样受体信号通路(MyD88-dependent toll-like receptor signaling pathway) | 4.80×10-2 | |
| CC | 核小体(nucleosome) | 2.93×10-7 | |
| CC | 核染色质(nuclear chromatin) | 2.05×10-4 | |
| CC | 细胞外外泌体(extracellular exosome) | 6.81×10-4 | |
| CC | 肌动蛋白细胞骨架(actin cytoskeleton) | 4.39×10-2 | |
| MF | 蛋白质异二聚化活性(protein heterodimerization activity) | 4.54×10-3 | |
| MF | DNA结合(DNA binding) | 9.01×10-3 | |
| 下调 | BP | 蛋白质转运(protein transport) | 1.64×10-6 |
| BP | 细胞-细胞黏附(cell-cell adhesion) | 8.66×10-6 | |
| BP | mRNA加工(mRNA processing) | 2.47×10-4 | |
| BP | 小GTP酶介导的信号转导(small GTPase mediated signal transduction) | 2.48×10-4 | |
| BP | RNA剪接(RNA splicing) | 1.34×10-3 | |
| BP | 应激反应(response to stress) | 9.87×10-4 | |
| CC | 细胞溶质(cytosol) | 1.85×10-17 | |
| CC | extracellular exosome | 2.61×10-11 | |
| CC | 膜(membrane) | 3.99×10-8 | |
| CC | 核质(nucleoplasm) | 8.25×10-7 | |
| CC | 细胞核(nucleus) | 5.35×10-3 | |
| CC | 细胞-细胞黏附连接(cell-cell adherens junction) | 1.70×10-5 | |
| CC | 细胞内核糖核蛋白复合物(intracellular ribonucleoprotein complex) | 3.06×10-5 | |
| CC | 高尔基膜(Golgi membrane) | 6.42×10-5 | |
| CC | 高尔基体(Golgi apparatus) | 8.89×10-5 | |
| CC | 线粒体(mitochondrion) | 3.20×10-4 | |
| MF | 蛋白质结合(protein binding) | 6.90×10-14 | |
| MF | 聚(A)RNA结合(poly(A) RNA binding) | 2.11×10-6 | |
| MF | ATP结合(ATP binding) | 2.73×10-6 | |
| MF | 未折叠的蛋白质结合(unfolded protein binding) | 4.14×10-6 | |
| MF | 钙黏蛋白结合参与细胞-细胞黏附(cadherin binding involved in cell-cell adhesion) | 4.94×10-6 | |
| MF | 二磷酸鸟苷(GDP)结合(GDP binding) | 7.56×10-6 | |
| MF | GTP酶活性(GTPase activity) | 2.97×10-5 |
3.3 差异表达基因的KEGG分析
分析差异表达基因的上调基因后,未得到有效的涉及哮喘的通路。下调基因被保留的信号通路主要富集在MyD88依赖性Toll样受体信号通路、血小板激活等,见表2。
| 通路 | P | 富集基因 |
|---|---|---|
| MyD88-dependent Toll-like receptor signaling pathway | 1.67×10-2 | HSP90AB1,CARD8,HSP90AA1,MAPK9,BIRC2,CHUK,PLD1,RAB8A,USP8,CAPZA2,VPS45,CHMP1B,TFRC,ZFYVE16,IST1,RAB11A,PDCD6IP,HSPA8 |
| 血小板激活(platelet activation) | 2.19×10-2 | ROCK1,PPP1R12A,RAP1A,PIK3CA,SNAP23,PPP1CC,ITGB1,PPP1CB,BTK,ITPR2 |
| 核苷酸结合寡聚化结构域样受体信号通路(NOD-like receptor signaling pathway) | 2.94×10-2 | HSP90AB1,CARD8,HSP90AA1,MAPK9,BIRC2,CHUK |
| 泛素介导的蛋白水解(ubiquitin mediated proteolysis) | 2.96×10-2 | UBE2D3,UBR5,MAP3K1,ANAPC4,UBE2W,HERC4,RCHY1,UBE2Q2,BIRC2,TRIP12 |
| 内质网中的蛋白质加工(protein processing in endoplasmic reticulum) | 4.19×10-2 | HSP90AB1,SEC23A,UBE2D3,HSP90AA1,XBP1,EIF2S1,MAPK9,HSPA5,SEC62,HSPA8,ERLEC1 |
| RNA transport | 4.63×10-2 | EIF4G2,XPO1,EEF1A1,EIF4E,RAN,PAIP1,EIF2S1,EIF4A2,NUP93,THOC1,NMD3 |
| 转化生长因子-β信号通路(TGF-β signaling pathway) | 4.97×10-2 | ROCK1,ZFYVE16,PPP2CA,PPP2CB,BMPR2,SMAD4,THBS1 |
3.4 差异表达基因和核心基因的PPI分析
PPI网络分析共含有495个节点和1 781条具有相互作用关系的边,见图2。结果T-复合蛋白1θ亚基(CCT8),T复合物蛋白1α亚单位(TCP1),26S蛋白酶调节亚单位S10B(PSMC6),热休克蛋白90α(HSP90A)A1,细胞周期蛋白C(CCNC),HSP90AB1,26S蛋白酶体非ATP酶调节亚基6(PSMD6),泛素特异性蛋白酶14(USP14),真核细胞翻译起始因子4E(EIF4E)蛋白的互作数分别为71,69,52,43,39,39,39,38,35次,互作数均≥35次,为核心基因。

3.5 差异表达基因的网络模块
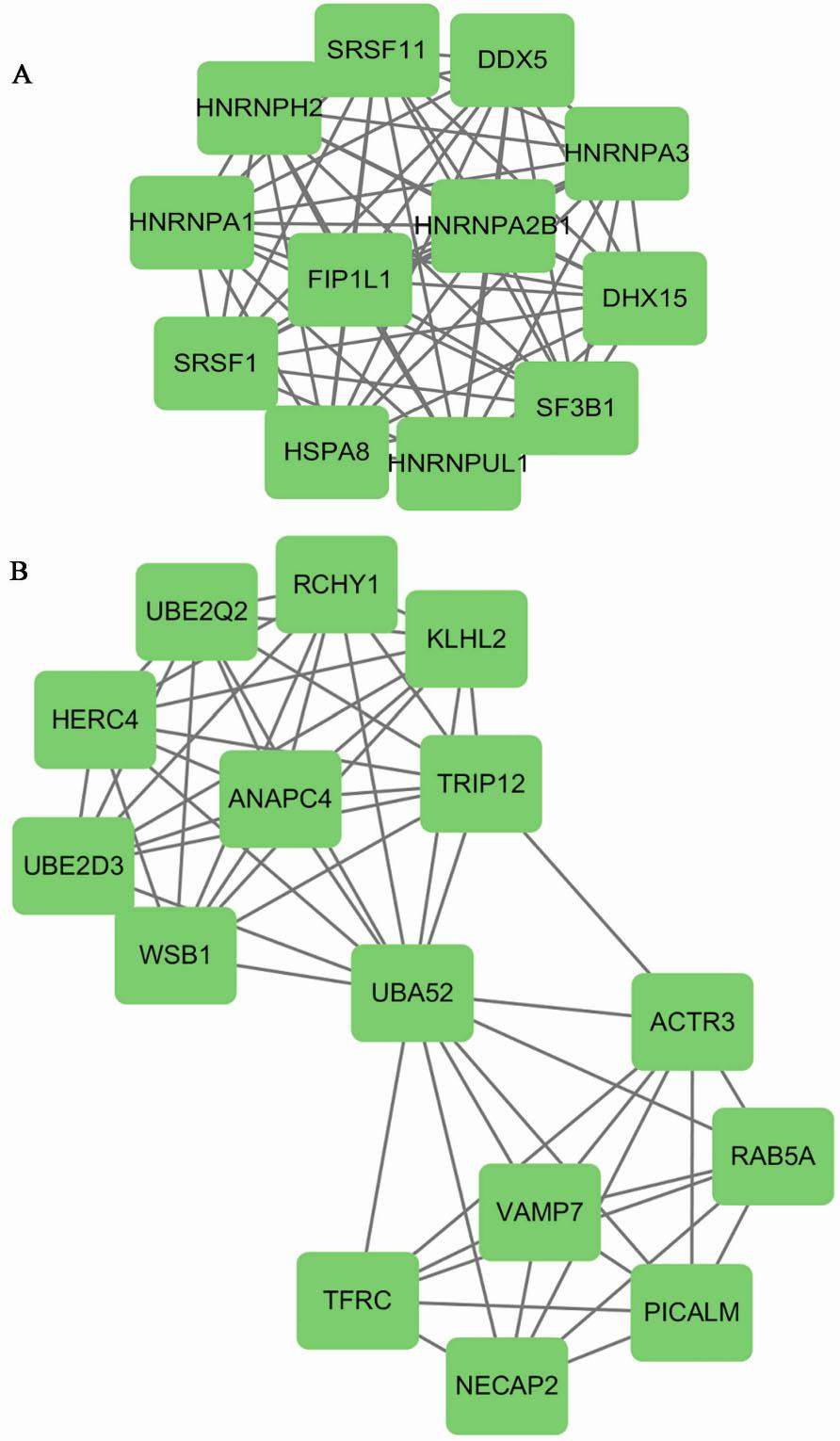
Cytoscape 3.6.1的插件MCODE分析出了2个重要模块,见图3。对模块中基因的功能进行分析,结果发现模块1的基因主要与剪接体信号通路相关,GO主要富集在通过剪接体进行mRNA剪接,mRNA加工,RNA从细胞核输出,细胞内核糖核蛋白复合物,剪接体催化步骤2,聚(A)RNA结合,核苷酸结合等。模块2的基因主要与泛素介导的蛋白水解信号通路相关,GO主要富集蛋白质多泛素化、蛋白质泛素化、蛋白质K11连接的泛素化、网格蛋白涂层坑、细胞质、遍在蛋白-蛋白质转移酶活性、蛋白质结合等。
3.6 治疗哮喘相关的药物筛选
使用Coremine Medical进行治疗哮喘潜在药物的筛选,P越小表示基因与药物之间的关联程度越大。将核心基因映射到Coremine Medical数据库筛选出P最小的前10个分子化合物,其中格尔德霉素(P=4.470×10-7),坦螺旋霉素(P=6.430×10-7),根赤壳菌素(P=1.620×10-6),阿螺旋霉素(P=1.820×10-6)与HSP90AA1关系密切;金雀异黄素(P=3.100×10-4),L-苏氨酸(P=1.050×10-6),茴香霉素(P=1.060×10-3),L-丝氨酸(P=1.260×10-3)是通过PSMC6映射得出;金合欢醇(P=1.220×10-2)通过TCP1映射得出;头孢噻肟(P=1.350×10-2)与CCT8具有密切联系。
4 讨论
4.1 哮喘患者和健康人之间存在差异表达基因
哮喘的发病因素复杂,受遗传和环境因素之间相互作用的影响,虽然大多数哮喘患者可以通过长时间吸入皮质类固醇实现疾病控制,但仍有一部分有严重哮喘的患者可能会对长期的激素维持治疗产生耐药性[9]。微阵列和高通量测序已被广泛用于预测哮喘的潜在治疗靶点。在本研究中,所提取数据来自GSE74986,并使用生物信息学分析了哮喘患者和健康人之间的差异表达基因,结果表明哮喘患者和健康人之间存在差异表达基因,其中含有29个上调和481个下调的基因。而这些差异表达的基因有可能跟哮喘的发病有关系,为了更好地理解差异表达基因的功能,进一步进行了GO和KEGG分析。
4.2 差异表达基因富集在表观遗传调控与炎性、血小板激活信号通路
哮喘的发病与遗传因素有着密切的关系,环境暴露会诱发与哮喘相关的表观遗传的改变,表观遗传与哮喘严重程度和肺功能具有独特的模块,不同哮喘患者的表观遗传调控具有变异性,说明表观遗传调控在哮喘发病中可能是一个重要的潜在调控机制[10]。表观遗传调控包括染色质沉默,DNA甲基化,蛋白质泛素化,通过RNA聚合酶Ⅱ启动子的转录调节等。表观遗传修饰可以调节参与气道发育的基因,还可调节免疫介导的炎症途径,现已有许多研究证实,表观遗传变异对哮喘相关表型起着重要的影响[11]。乙酰化,磷酸化,DNA甲基化,RNA修饰,蛋白质泛素化和组蛋白的翻译后修饰都是在不改变编码序列的情况下改变基因表达的所有调节机制,在暴露于过敏原、空气污染和各种饮食成分后,会出现基因特异性表观遗传改变,这些表观遗传改变会影响哮喘相关基因的转录和哮喘的生物标志物的表型表达[10]。与本研究一致的是差异表达基因与重要模块中基因的生物过程主要富集在染色质沉默,在RNA聚合酶Ⅱ启动子的转录调节,蛋白质异二聚化活性,蛋白质结合,DNA结合,蛋白质转运,mRNA加工,RNA剪接等表观遗传调控过程;而且差异表达基因信号通路主要富集在基因表达的修饰。这说明差异表达基因富集的生物学过程与表观遗传调控相关,通过干预差异表达基因,有可能会引起表观遗传调控的变化,从而可能起到治疗哮喘的潜在作用。
GO与KEGG分析表明,差异表达基因与血小板激活,NOD样受体信号通路,TGF-β信号通路,MyD88依赖性Toll样受体信号通路等有关。有研究表明血小板激活因子可引起支气管明显的收缩,且哮喘患者的血小板激活因子的浓度明显增加[12]。NOD样受体是细胞内模式识别受体家族,包含核苷酸结合富含亮氨酸重复序列和含pyrin结构域蛋白(NLRP),NLRP可形成炎性体的复合物,激活白细胞介素(IL)-1β和IL-18等炎性细胞因子,和多类急性或者慢性肺部疾病相关,例如哮喘[13]。TGF-β水平高低与哮喘发病的严重程度呈正相关,且哮喘患者的气道上皮细胞、支气管黏膜下及聚集的炎性细胞中的TGF-β水平明显升高,研究证明TGF-β通过诱导支气管上皮细胞凋亡促进哮喘的发展[14]。大多数Toll样受体(TLRs)已被证明可触发依赖于MyD88的信号级联反应,活化的TLRs随后调节炎症相关的核转录因子-κB(NF-κB),从而招募一组衔接蛋白,说明TLRs可促进炎性疾病,并且MyD88依赖性Toll样受体信号通路在哮喘发病机制和导致急性、慢性炎症的机制中起重要作用[15]。哮喘是一种复杂的炎症性疾病,其特征在于气道炎症和重塑,哮喘患者的气道处于慢性炎症状态,慢性炎症刺激引起气道重塑,形成恶性循环[15]。与本研究结果相一致的是差异表达基因主要涉及的信号通路集中于炎症反应,其次为血小板激活。说明检测这些信号传导途径可以帮助预测哮喘的进展,并可能成为治疗哮喘的重要途径。
4.3 核心基因可能成为治疗哮喘的潜在靶点
为了进一步研究差异表达基因与哮喘间的关系,笔者还通过PPI网络进一步得出了核心基因,其中CCT8被确定为具有最高连接程度的核心基因。据报道,CCT8是CCT复合物伴侣蛋白的亚基,参与了微管蛋白、肌动蛋白等参与细胞生长和生存的蛋白质的折叠,说明CCT8在基因表达修饰方面有一定的作用,可能与哮喘的表观遗传调控途径相关[16]。研究证明PSMC6在男性哮喘患者中的表达显著高于对照组的男性患者,PSMC6蛋白酶体基因多态性会引起炎症的水平升高,与哮喘的发病具有密切关系,调节PSMC6可改善哮喘气道的慢性炎症状态[17]。气道上皮细胞释放损伤相关分子模式在哮喘的发生和发展中起着至关重要作用,细胞外HSP90AA1通过Toll样受体2和/或Toll样受体4进行组织重塑效应,从而介导免疫调节反应,参与气道上皮细胞释放损伤相关分子模式,提示HSP90AA1基因与哮喘的发病密切相关[18]。
研究证明抑制EIF4E可以下调趋化因子的分泌以及抑制平滑肌细胞的增殖,说明EIF4E可作为哮喘治疗的新潜在靶点[19]。含有伴侣蛋白的TCP1是一种进化上保守的大分子复合物,参与约10%细胞蛋白质组的折叠[20]。CCNC主要参与细胞周期的调控,并与RNA聚合酶全酶结合以调节转录[21]。HSP90AB1是一大类伴侣蛋白,在暴露于各种细胞应激后,有助于蛋白质折叠,稳定蛋白质并帮助重新折叠变性蛋白质[22]。PSMD6负责蛋白质识别和降解,涉及许多生物过程,例如蛋白质质量控制、细胞周期调节、基因表达和寿命调节等[23]。USP14可控制细胞内蛋白质降解,包括底物识别、泛素缀合和蛋白酶体降解的泛素化底物,是对蛋白质组稳态至关重要的主要蛋白酶体相关的去泛素化酶之一[24]。综上所述,核心基因主要与哮喘的表观遗传调控、免疫反应、炎症反应、平滑肌细胞的增殖相关,通过调控或者监控核心基因,可能是治疗哮喘的潜在靶点或可能成为哮喘的新生物标志物。
4.4 小分子药物可能成为治疗哮喘的潜在药物
本研究通过Coremine Medical分析了治疗哮喘的潜在小分子药物,金雀异黄素是射干的主要成分之一,具有抗癌效果、神经保护作用,并可预防动脉粥样硬化,更重要的是具有抑制IL-1β和肿瘤坏死因子-α(TNF-α)等炎性因子表达的作用,可抑制丝裂原活化蛋白激酶通路激活,从而减少气道的炎性损伤,还可通过维持Th1/Th2的平衡发挥调节免疫的作用,从而明显改善哮喘模型小鼠的气道炎症[25]。茴香霉素是从链霉菌中获取的细菌组分,常用于诱导癌细胞凋亡,或抑制调节蛋白激酶和IL-2,IL-4的表达,还具有免疫调节作用[26]。L-苏氨酸是必须氨基酸,L-丝氨酸是非必需氨基酸,但二者都是半夏主要的成分之一,具有促进生长发育和调节免疫反应的作用[27]。研究表明PSMC6是调控免疫和炎性反应的重要因素,说明金雀异黄素,茴香霉素,L-苏氨酸以及L-丝氨酸可能通过调控PSMC6发挥其药理作用[17]。金合欢醇是麻黄、桂枝的主要成分之一,具有抑制TNF-α,IL-1β和诱导型一氧化氮合酶的分泌和减少氧化应激反应的作用,TCP1是CCT伴侣蛋白的成员,可通过调节NF-κB的活性来调控TNF-α,IL-1β等炎性因子的分泌和氧化应激反应,说明金合欢醇的抗炎、抗氧化作用可能与调控TCP1有关[20,28]。格尔德霉素、阿螺旋霉素都具有抑制热休克蛋白表达的作用,HSP90AA1是热休克蛋白的其中一种类型,可抑制参与气道上皮细胞释放损伤相关分子模式,与哮喘的发病密切相关,说明格尔德霉素、阿螺旋霉素具有通过调节HSP90AA1干预哮喘的潜在作用[29-30]。上述小分子药物均有可能成为通过干预核心基因发挥治疗哮喘的潜在药物。
本研究提示差异表达基因主要参与表观遗传调控和炎症反应等生物学过程;主要与血小板激活,NOD样受体信号通路,MyD88依赖性Toll样受体信号通路等有关;其中核心基因CCT8,TCP1,PSMC6等可能是与哮喘发病相关的关键因素。金雀异黄素、茴香霉素等可能成为治疗哮喘的新药物,为后续哮喘分子机制及其治疗药物的研究提供了一系列潜在目标,但仍需进一步的实验来证实差异表达基因和小分子药物的功能。
A variant of PSMD6 is associated with the therapeutic efficacy of oral antidiabetic drugs in Chinese type 2 diabetes patients
[J].Sci Rep,2015,doi:10.1038/srep10701.
