帕金森病(Parkinson's disease,PD)是第二常见的神经退行性疾病[1]。一项2015年的调查研究显示,我国60岁以上人群PD的患病率约为1.37%,据此估计我国PD患病总人数可能高达362万[2]。目前西医针对PD以对症治疗策略为主,基本上依赖于多巴胺替代疗法,对于缓解临床症状有一定作用,但却无法阻止多巴胺能神经元变性的进展,且存在较多副作用[3]。研究显示,中医药在改善临床症状的同时可干预PD进展[4]。补肾益髓方(又名滋肾益髓方)为北京中医药大学东方医院脑病科用于治疗PD的协定处方,前期研究证实其可显著改善PD患者的运动症状[5]。目前认为PD的发展可能与氧化应激、线粒体功能障碍、α-突触核蛋白(α-syn)的错误折叠和慢性神经炎症等因素密切相关[6],而NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体介导的细胞焦亡在上述过程中起着重要作用[7-8]。本研究从脑组织炎症因子及NLRP3炎症小体方面探究补肾益髓方对PD模型小鼠运动症状的影响及其可能的作用机制。本研究通过北京中医药大学东方医院医学与实验动物伦理委员会审查(伦理审批号:202018)。
1 材料与方法
1.1 动物
SPF级雄性C57BL/6J小鼠34只,8周龄,体质量20~22 g,购自北京华阜康生物科技股份有限公司,实验动物使用许可证号:SCXK(京)2020-0004。饲养条件:小鼠自由进食、饮水,平均温度24 ℃,相对湿度40%,噪音<60分贝,光照12 h昼夜交替。
1.2 药物
补肾益髓方药物组成:楮实子15 g、沙苑子15 g、枸杞子15 g、黄精15 g、熟地黄15 g、肉苁蓉30 g、龟甲6 g等,各药物免煎颗粒剂(北京康仁堂药业有限公司生产)加入蒸馏水配制成浓度0.22 g/ml补肾益髓方灌胃液。
1.3 主要试剂与仪器
1-甲基-4-苯基-1,2,4,6-四氢吡啶(MPTP,货号:HY-15608-300mg),美国MCE公司;PBS磷酸盐缓冲液(货号:ZLI-9061)、DAB试剂盒(货号:ZLI-9017)、苏木素染液(货号:ZLI-9609),北京中杉金桥生物技术有限公司;水合氯醛(货号:TCI-C0073-500G),上海吉至生化科技有限公司;多聚甲醛(货号:G1101),武汉赛维尔生物科技有限公司;甲苯胺蓝染色液(货号:DK0023),北京雷根生物技术有限公司;重组抗酪氨酸羟化酶(TH)抗体(货号:ab137869)、NLRP3抗体(货号:ab263899)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)抗体(货号:ab138483)、白细胞介素1β(IL-1β)抗体(货号:ab234437)、肿瘤坏死因子α(TNF-α)抗体(货号:ab215188),英国Abcam公司;信号转接凋亡相关斑点样蛋白(ASC)抗体(货号:67824S),美国CST公司;β-actin(货号:orb84841),英国Biorbyt公司;β-actin抗体(货号:A01010),美国Abbkine公司;RIPA裂解液(货号:MD913056)、BCA蛋白浓度测定试剂盒(货号:MD913053)、SDS-PAGE凝胶试剂盒(货号:MD911919)、二抗(货号:MD932477),英国MDL公司;PVDF膜(货号:ISEQ00010),美国Millipore公司。
Rotarod转棒仪(型号ZH-600B),安徽正华生物仪器设备公司;石蜡切片机(型号:RM2235)、显微镜(型号:DM3000),德国Leica公司;SDS-PAG电泳仪(型号:PowerPac Universal Power Supply)、ChemiDoc MP化学发光成像系统(型号:170-8280),美国Bio-Rad公司;凝胶成像系统(型号:GelDoc-It310),美国UVP公司;高速冷冻离心机(型号:3-30k),德国Sigma公司。
1.4 模型的建立
34只C57BL/6J小鼠适应性饲养1周后,按照体质量采用随机数字表法选取10只作为正常组,其余24只予3 mg/ml 的MPTP 溶液30 mg/(kg·d)腹腔注射进行造模,连续5天[9]。每次注射MPTP后小鼠出现震颤及竖毛等急性损伤症状但能逐渐恢复,随着给药天数的增加,小鼠运动功能逐渐损害,出现运动迟缓及动作笨拙等异常表现表明造模成功[10]。正常组小鼠予10 ml/kg生理盐水腹腔注射,每天1次,连续5天。
1.5 分组及干预
24只小鼠均造模成功,按照体质量采用随机数字表法分为模型组、补肾益髓方组各12只。参考人和小鼠间体表面积比率换算等效剂量法[11],依据临床等效剂量换算小鼠每日给药剂量为0.022 g/ 10 g,则补肾益髓方组每日予补肾益髓方配方颗粒水溶液0.1 ml/10 g灌胃,正常组及模型组小鼠予等体积生理盐水,各组小鼠均每日灌胃1次,连续14天。
1.6 观测指标及方法
干预结束后观察小鼠一般情况;干预结束后第2天采用转棒疲劳实验[9]进行行为学评价以观察小鼠运动功能;行为学测试结束后,所有小鼠予10%水合氯醛(10 mg/kg)腹腔注射深度麻醉,每组采用随机数字表法选取3只,迅速取新鲜脑组织-80 ℃冻存用于Western Blot法检测,其余小鼠予4%多聚甲醛进行心脏灌注固定,留取脑组织并定位,制作石蜡切片用于病理形态观察及免疫组化法检测。
1.6.1 一般情况
观察小鼠的外观、饮食、活动、精神状态等情况并作记录。
1.6.2 行为学评价
实验前将小鼠在转棒上以5~ 10 r/min的速度训练5 min,训练3轮以上,使小鼠能够在转棒仪转轴上爬行。休息30 min后正式开始测试,根据预实验结果将转棒仪设置为启动速度5 r/min、最高速度50 r/min,均匀加速模式,测试时间为5 min,传感器自动记录小鼠在转棒上的停留时间。每只小鼠测试3次,每两次测试之间间隔1 h,取3次结果平均值记为本次实验结果。
1.6.3 脑组织黑质纹状体病理学观察
脑组织固定过夜后梯度脱水,切片机连续切取中脑组织,漂洗后甲苯胺蓝染色10 min,PBS漂洗,风干后置于无水酒精中分色,待至淡紫色时,脱水封片,光镜下观察黑质纹状体病理形态并拍片。
1.6.4 免疫组化法检测脑组织黑质纹状体酪氨酸羟化酶(TH)表达
脑组织切片常规脱蜡、脱水,微波进行抗原修复。一抗(抗TH抗体1∶200)4 ℃孵育过夜,生物素二抗(1∶200)室温孵育20 min。DAB显色,苏木素复染,脱水封片。使用Image J 1.53软件对免疫组化图像进行半定量分析,计算图像平均光密度(AOD)值,以反映单位面积内TH阳性细胞表达情况。
1.6.5 Western Blot法检测脑组织NLRP3炎症小体相关蛋白表达
取出小鼠脑组织,分离出黑质部分加液氮匀浆至无块状,加入裂解液裂解,4 ℃、12 000 r/min(离心半径9 cm)离心15 min,取上清,BCA法测定提取的蛋白浓度。按SDS-PAGE凝胶试剂盒说明配制10%分离胶,再配制浓缩胶,完全凝固后上样,电泳。内参选用β-actin,将蛋白条带转移至PVDF膜上,65V转膜2 h,室温、摇床缓慢摇动封闭膜1 h。一抗[NLRP3抗体、Caspase-1抗体、IL-1β抗体、TNF-α抗体、ASC抗体、β-actin抗体(稀释比均为1∶1000)]4 ℃孵育过夜,二抗TBST稀释300倍,室温、避光缓慢摇动1 h。等比混合超敏显影的两种液体,化学发光系统成像,使用Image J 1.53软件对所获条带灰度值进行半定量分析,目的蛋白相对表达量以目的条带灰度值与内参灰度值的比值表示。
1.7 统计学方法
采用SPSS 26.0软件进行统计学分析,计量数据均符合正态分布,以均数±标准差(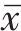
2 结果
2.1 各组小鼠一般情况比较
正常组小鼠毛发整齐有光泽,食量如常,活动性良好,反应灵敏。模型组小鼠可见背部部分或全部竖毛,毛发无光泽,食量明显减少,活动减少、动作迟缓,或见静止不动、后肢颤抖,对声音或触碰反应变慢或无反应。补肾益髓方组小鼠部分毛发黑亮光泽,食量、活动性较好,无肢体震颤,对声音或触碰反应较灵敏。
2.2 各组小鼠转棒疲劳实验结果比较
表1示,与正常组比较,模型组小鼠转棒上停留时间显著缩短(P<0.01);与模型组比较,补肾益髓方组小鼠转棒上停留时间延长(P<0.05)。
| 组别 | 鼠数 | 转棒上停留时间 |
|---|---|---|
| 正常组 | 10 | 148.887±60.533 |
| 模型组 | 12 | 96.303±67.610a) |
| 补肾益髓方组 | 12 | 128.621±63.917b) |
2.3 各组小鼠中脑黑质纹状体TH表达比较
表2示,与正常组比较,模型组小鼠黑质纹状体TH阳性细胞表达降低(P<0.01);与模型组比较,补肾益髓方组小鼠TH阳性细胞表达升高(P<0.05)。
| 组别 | 鼠数 | TH |
|---|---|---|
| 正常组 | 7 | 0.185±0.029 |
| 模型组 | 9 | 0.131±0.024a) |
| 补肾益髓方组 | 9 | 0.165±0.023b) |
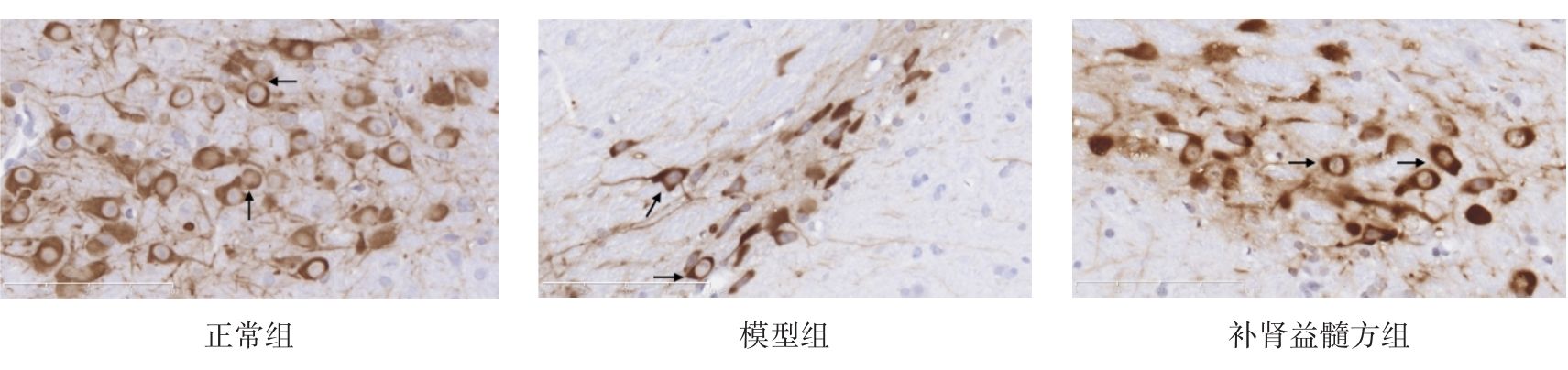
图1示,正常组小鼠在中脑黑质纹状体区可见大量密集的TH阳性神经元和纤维,细胞轮廓清晰;与正常组比较,模型组小鼠的TH阳性神经元胞体和纤维稀疏;与模型组比较,补肾益髓方组小鼠的TH阳性神经元及纤维相对增多。
grid ="1,2,3;" source = "paralayout"图1各组小鼠中脑黑质纹状体酪氨酸羟化酶免疫组化染色结果(× 400)
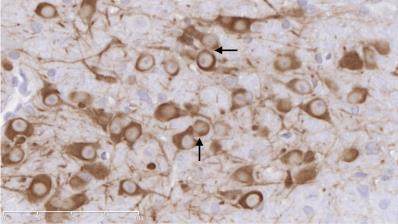
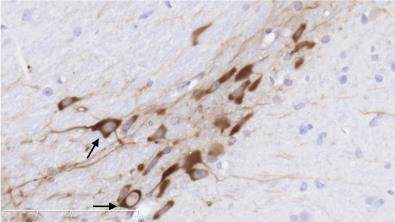
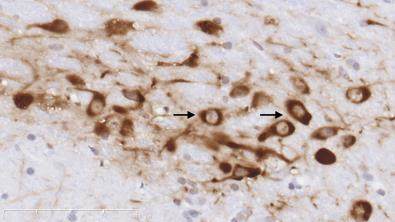
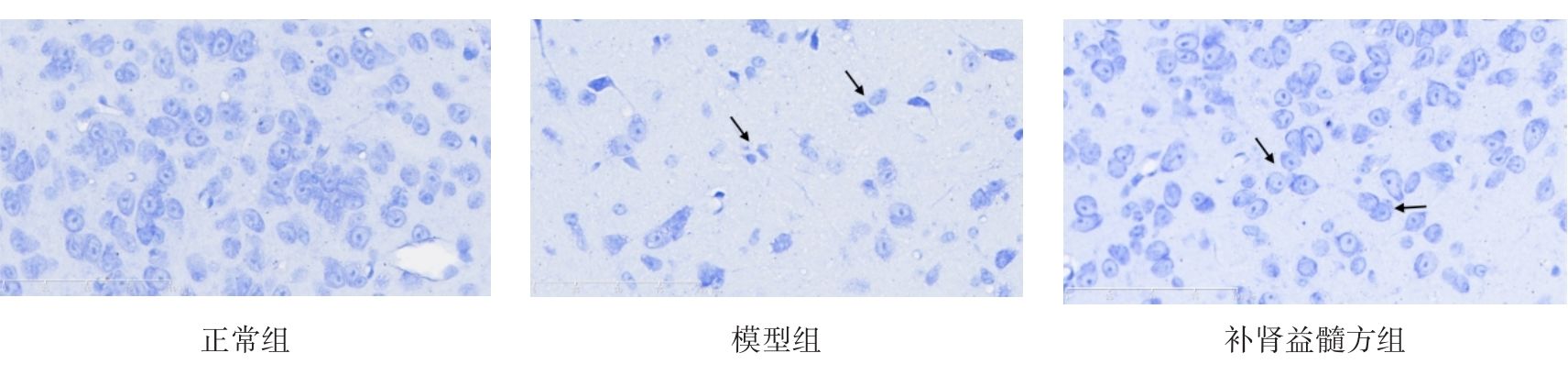
2.4 各组小鼠中脑黑质纹状体尼氏染色结果
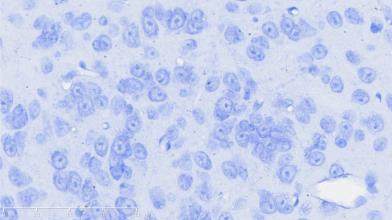
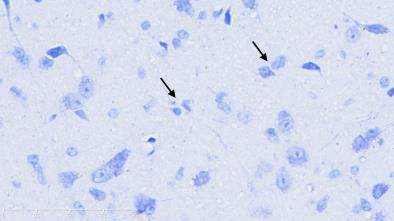
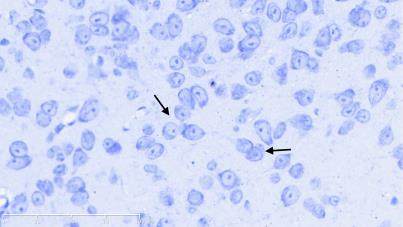
图2示,正常组小鼠黑质纹状体区神经元结构完整,细胞排列整齐,高倍镜下可见神经细胞排列整齐,细胞质蓝染、细胞核呈现空泡状,尼氏小体丰富。模型组小鼠黑质纹状体区神经元减少、萎缩、紊乱,胞体变小,尼氏小体减少,细胞质染色变浅或浓缩,细胞核出现固缩、破裂或溶解等。补肾益髓方组小鼠黑质纹状体大部分神经元细胞结构完备,细胞排列稍紊乱,细胞核核固缩、破裂现象少于模型组,尼氏小体数量较模型组相对增多。
grid ="1,2,3;" source = "paralayout"图2各组小鼠中脑黑质纹状体尼氏染色结果(× 400)
2.5 各组小鼠脑组织NLRP3炎症小体相关蛋白表达比较
表3示,与正常组比较,模型组小鼠脑组织中IL-1β、TNF-α、NLRP3、ASC、Caspase-1蛋白表达升高(P<0.01);与模型组比较,补肾益髓方组小鼠脑组织中IL-1β、TNF-α、NLRP3、ASC、Caspase-1蛋白表达降低(P<0.05)。各组小鼠脑组织IL-1β、TNF-α、NLRP3、ASC、Caspase-1蛋白电泳图见图3。
| 组别 | 鼠数 | IL-1β | TNF-α | NLRP3 | ASC | Caspase-1 |
|---|---|---|---|---|---|---|
| 正常组 | 3 | 0.321±0.074 | 0.261±0.125 | 0.346±0.039 | 0.218±0.082 | 0.250±0.094 |
| 模型组 | 3 | 0.864±0.078a) | 0.737±0.154a) | 0.861±0.257a) | 0.864±0.151a) | 0.877±0.115a) |
| 补肾益髓方组 | 3 | 0.675±0.089b) | 0.496±0.038b) | 0.512±0.091b) | 0.604±0.131b) | 0.568±0.144b) |

3 讨论
PD是由于中脑黑质纹状体多巴胺能神经元变性、死亡及路易小体形成而导致的一种进行性神经退行性疾病[12]。细胞焦亡是一种程序性细胞死亡,是机体重要的先天免疫反应[13]。NLRP3炎症小体是存在于小胶质细胞中的一种炎性复合物,由NLRP3接收器、ASC衔接蛋白、Caspase-1效应蛋白组成[14]。在刺激物长时间存在的情况下,NLRP3会导致小胶质细胞的持续激活[8],进而导致小胶质细胞释放IL-1β、TNF-α等炎性细胞因子,触发细胞焦亡[15-16]。研究表明,PD患者的中脑黑质纹状体组织中存在激活的小胶质细胞,且富含NLRP3的炎症小体大量增加[6],NLRP3激活相关蛋白ACS、Caspase-1显著上调,下游炎症体激活标志物IL-1β、TNF-α也显著升高[17-18],提示NLRP3炎症小体激活参与PD发病机制;而利用强效的小分子NLRP3抑制剂MCC950可阻断NLRP3炎症小体激活,减少α-syn聚集,减轻黑质纹状体多巴胺能神经元变性,从而有效地缓解PD小鼠运动症状[17]。以上结果表明NLRP3炎症小体可能是促进渐进性多巴胺能神经元变性的神经炎症的持续来源,而调节NLRP3炎症小体可能是治疗PD的重要潜在靶点。
PD属中医学“颤振”范畴,病位主要在肝、肾、脾、胃,病性属本虚标实,治疗以标本兼治为原则,总体以滋阴温阳、益气养血为主要治法[19]。有研究[20]显示,PD核心病机为肾虚髓减。脑为髓海、元神之府,肾藏精,精生髓,肾又为作强之官,肾精充沛则髓海满盈,精力充沛、筋骨隆盛、活动自如;肾精不足致脑髓空虚,则可见PD之头摇肢颤、伎巧不能、形坏神呆等症状,故治疗当以补肾益髓为总则。本研究所用补肾益髓方中楮实子滋肾益阴,《日华子本草》言其可“壮筋骨,助阳气,补虚劳,助腰膝,益颜色”;熟地黄滋补肾阴、助肾封藏;龟甲滋阴潜阳、补阴中之至阴,《本草蒙筌》言其“专补阴衰,善滋肾损”;枸杞子滋补肝肾、益精明目;黄精补气养阴、益肾健脾。五药相配滋补肾阴,益气力、缓拘紧、止震颤。肉苁蓉补肾阳、益精血,沙苑子温肾助阳、固精缩尿,二者合用补益肾阳、填精益髓,强筋骨、壮腰膝。诸药合用阴中寓阳、阴阳双补,共奏补肾益髓之功。前期研究[21]证实,补肾益髓方可有效提高患者的生存质量。
MPTP是一种高度亲脂性的化合物,能够自由通过血脑屏障进入中枢神经系统,全身给药后能够对黑质纹状体多巴胺能通路产生可靠而稳定的损伤,因此MPTP诱导的小鼠损伤模型是最为常用的PD动物模型[22]。转棒疲劳试验是专用于评价小鼠运动协调和平衡能力的测试,目前被广泛用于评价PD模型小鼠的运动症状[9]。尼氏小体是神经细胞所特有的结构,被视为神经细胞存活的标志,尼氏染色能够反映神经细胞的代谢情况,标记存活的神经细胞[23]。TH是多巴胺合成的限速酶,其功能和表达能够反映多巴胺能神经元的正常与否,是多巴胺能神经元的重要标志酶[24]。本研究中,经MPTP造模的PD小鼠在转棒上停留时间明显下降,小鼠中脑黑质纹状体区神经元减少、萎缩、紊乱,胞体变小,尼氏小体减少,TH阳性神经元胞体和纤维稀疏,NLRP3炎症小体相关蛋白表达水平增加,提示细胞焦亡显著,多巴胺能神经元损伤明显。而应用补肾益髓方治疗后,PD小鼠在转棒上停留时间增加,提示其运动症状得到改善;同时小鼠中脑黑质纹状体区大部分神经元细胞结构完备,细胞核固缩、破裂现象少于模型组,尼氏小体数量、TH阳性神经元及纤维相对增多,NLRP3炎症小体相关蛋白表达水平明显下降,表明治疗后细胞焦亡减少,多巴胺能神经元损害减轻。以上研究结果提示,补肾益髓方可改善PD模型小鼠的运动症状,其机制可能是通过调节NLRP3炎症小体介导的细胞焦亡,从而起到神经保护的作用。然而PD病理机制复杂,补肾益髓方对PD的治疗作用可能还涉及其他通路和靶点,故确切机制还有待今后进一步深入研究。
Parkinson's disease: a systemic inflammatory disease accompanied by bacterial inflammagens
[J]. Front Aging Neurosci,2019,11:210.doi: 10.3389/fnagi.2019.00210.Andrographolide suppresses NLRP3 inflammasome activation in microglia through induction of parkin-mediated mitophagy in in-vitro and in-vivo models of Parkinson disease
[J]. Brain Behav Immun,2021,91:142-158.doi: 10.1016/j.bbi. 2020.09.017.The mechanisms of NLRP3 inflammasome/pyroptosis activation and their role in Parkinson's disease
[J]. Int Immunopharmacol, 2019,67: 458-464.doi: 10.1016/j.intimp. 2018. 12.019.Parkinson's disease
[J]. Nat Rev Dis Primers, 2017,3: 17013.doi: 10.1038/nrdp.2017.13.Triggering of inflammasome by aggregated alpha-synuclein, an inflammatory response in synucleinopathies
[J]. PLoS One, 2013,8(1):Inflammasome inhibition prevents alpha-synuclein patho-logy and dopaminergic neurodegeneration in mice
[J]. Sci Transl Med, 2018,10(465):Quantitative whole-brain 3D imaging of tyrosine hydroxylase-labeled neuron architecture in the mouse MPTP model of Parkinson's disease
[J]. Dis Model Mech, 2019,12(11):张新宁,陈志刚,陈路等.补肾益髓方对帕金森病模型小鼠脑组织NLRP3炎症小体激活相关蛋白表达的影响[J].中医杂志,2023,64(01):71-76.
ZHANG Xinning,CHEN Zhigang,CHEN Lu,et al.Effect of Bushen Yisui Formula (补肾益髓方) on the Expression of NLRP3 Inflammasome Activation-related Protein in the Brain Tissue in Parkinson's Disease Model Mice[J].Journal of Traditional Chinese Medicine,2023,64(01):71-76.

