肠易激综合征(IBS)是一种以反复腹痛,并伴有排便异常或排便习惯改变为临床特征的功能性肠病,该病缺乏可解释症状的形态学改变和生化检查异常,为消化科的常见病和多发病[1]。近年来,随着人们生活水平的普遍提高,饮食结构和生活习惯等改变,本病就诊人数呈逐年增多趋势。根据罗马Ⅳ标准[2],IBS可分为便秘型、腹泻型、混合型、不定型4种亚型。有报道腹泻型IBS是我国临床分布最为多见的一种亚型,中医肝脾功能失调是其发病关键[3-4]。IBS患者存在着血液中自由基清除剂的缺乏和肠道低度炎症,而自由基的过氧化及肠道黏膜炎症又可使胃肠神经受到损害,导致神经细胞的功能障碍、细胞变性、坏死,以致出现胃肠动力和内脏感觉异常[5-6]。同时亦有研究表明p38丝裂原活化蛋白激酶(p38 MAPK)信号通路在机体疼痛感知、胃肠动力功能紊乱和免疫性炎症异常激活中均有重要的作用[7-8]。痛泻要方首载于元·朱震亨《丹溪心法》,为主治肝脾不和之“痛泻”的常用方,亦是中医临床治疗腹泻型IBS的有效基础方。前期临床发现痛泻要方加味治疗肝旺脾虚腹泻型IBS患者,疗效显著[9]。故本研究拟通过番泻叶灌胃联合慢性束缚建立肝郁脾虚腹泻型IBS大鼠模型,观察痛泻要方对模型大鼠氧化应激及p38 MAPK信号关键因子p38 MAPK,丝裂原和应激蛋白激酶1(MSK1),环磷腺苷效应元件结合蛋白(CREB)和下游相关细胞因子的调节作用,以探讨痛泻要方治疗肝郁脾虚型腹泻型IBS可能的作用机制。
1 材料
1.1 动物
健康SPF级Wistar大鼠60只,体质量(180±20) g,雌雄各半,由甘肃中医药大学科研实验中心提供,动物合格证号SCXK(甘)2015-0002,喂饲灭菌标准饲料和纯净水。实验动物所有操作取得了甘肃中医药大学实验动物伦理委员会批准(批号2016-025)。
1.2 药物及试剂
痛泻要方水煎剂(参照《丹溪心法》中痛泻要方药物组成及剂量的比例确定,方中饮片炒白术-炒白芍-炒陈皮-炒防风6∶4∶3∶2称取)将上述药物洗净,浸泡约40 min,加水煎煮2次,合并煎液,过滤,将其分别浓缩成痛泻要方高剂量(含生药为1.8 g·mL-1)、中剂量(含生药为0.9 g·mL-1)以及低剂量(含生药为0.45 g·mL-1)的水煎溶液。以上药液制成后高压灭菌消毒,4 ℃冰箱保存备用。番泻叶水煎剂:将番泻叶水浸泡5 h,煎煮8 min,纱布过滤取上清液,浓缩至含生药0.4 g·mL-1药液,4 ℃冰箱保存备用,以上中药饮片均购于兰州惠仁堂药店。匹维溴铵片(法国Abbott Products公司,批号644465,进口药品注册证号H20120127);总超氧化物歧化酶(T-SOD),丙二醛(MDA)测定试剂盒(南京建成生物工程研究所,批号分别为20181220,20181225);大鼠白细胞介素-1β(IL-1β),白细胞介素-6(IL-6),肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒(江苏酶免实业有限公司,货号分别为MM-0047R1,MM-0190R1,MM-0180R1);p38 MAPK抗体,MSK1抗体,CREB抗体(美国GeneTex公司,批号分别为40100,821801334,42480);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Immuno Way公司);苏木素-伊红(HE)染色试剂盒(北京Solarbio公司,批号G1120);trizol(美国Ambion公司,批号152104);PCR扩增试剂盒(大连TaKaRa公司,批号为AI61180A);0.2 mL PCR strips with 8 wel(上海Kirgen公司,批号180666);兔SP试剂盒,山羊抗小鼠免疫球蛋白(Ig)G(北京中杉金桥生物技术有限公司,批号均为K186613C);大鼠β-肌动蛋白(β-actin),p38 MAPK,MSK1,CREB引物由大连TaKaRa公司合成并经质量检测,引物序列见表1。
| 引物 | 序列(5′-3′) | 长度/bp |
|---|---|---|
| β-actin | 上游5′-GGAGATTACTGCCCTGGCTCCTA-3′ | 171 |
| 下游5′-GACTCATCGTACTCCTGCTTGCTG-3′ | ||
| p38 MAPK | 上游5′-TTACCGATGACCACGTTCAGTTTC-3′ | 279 |
| 下游5′-AGCGAGGTTGCTGGGCTTTA-3′ | ||
| MSK1 | 上游5′-GAGCGTTTCACAGAGCACGAAG-3′ | 119 |
| 下游5′-CACCACATGGCCATTAGAATCAA-3′ | ||
| CREB | 上游5′-ACAGTTCAAGCCCAGCCACAG-3′ | 160 |
| 下游5′-GCACTAAGGTTACAGTGGGAGCAGA-3′ |
1.3 仪器
S1000型实时荧光定量聚合酶链式反应(Real-time PCR)仪,iMark型酶标仪,PowerPoc Basic型凝胶电泳仪,ChemiDoc™ XRS+型凝胶成像分析仪,JY-SPAT型电泳槽,PowerPac™ Universal Power Supply型电泳及转印电源(美国Bio-Rad公司);VELOCITY 18R型台式冷冻离心机(澳大利亚Dynamica公司);FA2004型电子天平(上海舜宇恒平科学仪器有限公司);HH-4型数显恒温水浴箱(江苏省金坛市友联仪器研究所);DYCZ-40D型转膜仪(北京六一生物科技有限公司);P100/P100+型微体积分光光度计(美国Pultton公司);N2/N2S型紫外可见分光光度计(上海仪电分析仪器有限公司);BX43型显微镜(日本Olympus公司);RM2125型切片机,ASP200S型自动真空组织脱水机(德国Leica公司)。
2 方法
2.1 模型制备及给药
将60只大鼠按随机数字表法分为空白组、模型组、匹维溴铵组和痛泻要方低、中、高剂量组,每组10只。除空白组外其余各组大鼠采用番泻叶灌胃联合慢性束缚法复建肝郁脾虚腹泻型IBS模型[10-11],造模大鼠实验前10 h禁食不禁水,予以番泻叶水煎剂4 g·kg-1灌服,每日1次,连续灌胃14 d。番泻叶水煎剂灌服后用宽透明胶带束缚大鼠肩部及前肢和胸腹部,使大鼠无法用前肢抓搔头面,每天定时约1 h。连续造模14 d后开始给药治疗,痛泻要方低剂量组2.25 g·kg-1,中剂量组4.5 g·kg-1,高剂量组9 g·kg-1灌胃,相当于人体日用体质量剂量的3,6,12倍[12];匹维溴铵组给予匹维溴铵片混悬液0.02 g·kg-1,相当于人日用剂量的6倍;灌胃空白组和模型组给予2 mL生理盐水灌胃。每日给药1次,连续灌胃治疗21 d。每7 d大鼠称体质量1次以调整药量。
2.2 标本采集
末次治疗给药后,各组大鼠禁食不禁水18 h,使用2%戊巴比妥钠(2 mL·kg-1)剂量腹腔麻醉大鼠,心脏采血约5 mL,血样放置于4 ℃ 1 h,3 500 r·min-1离心10 min,取上清,-80 ℃冷冻备用。采血后剖腹截取距肛门5~8 cm处结肠组织,选取生理盐水洗净肠管内容物,一部分4%多聚甲醛固定,一部分-80 ℃分装冷冻备用。
2.3 HE染色观察结肠组织病理学变化
选取大鼠新鲜结肠管组织,迅速置于4%多聚甲醛均匀固定后,冲洗,并依次通过不同浓度的乙醇脱水及二甲苯脱蜡透明,放入石蜡中浸渍,包埋,行石蜡切片,二甲苯脱蜡水化,苏木素染色,盐酸乙醇分化、伊红染色、行脱水透明、中性树胶封固等步骤,在显微镜下观察拍照。
2.4 羟胺法检测血清T-SOD含量
取出冻存于-80 ℃的血清,置于室温下融解。活性测定方法经预实验和给定的参考值,确定本实验血清取样量为50 μL。设置测定管和对照管,分别加入试剂一应用液1 mL,测定管加入血清50 μL,对照管加入蒸馏水50 μL,再分别加入试剂二、三、四应用液各100 μL,用旋涡混悬器混匀,置37 ℃恒温水浴40 min,加入显色剂2 mL混匀,室温放置10 min,于波长550 nm处,1 cm光径比色皿比色,计算活性。
2.5 TBA法检测血清MDA含量
取2.4项血清,设置空白管、标准管、测定管。空白管加入无水乙醇100 μL,标准管加入10 mmol·L-1标准品100 μL,测定管加入血清100 μL。以上各管均加入试剂一100 μL,混匀,再加入试剂二3 mL,试剂三1 mL,摇匀,旋涡混悬器混匀,95 ℃水浴40 min后,流水冷却,3 500 r·min-1离心10 min,取上清液,于波长532 nm处,1 cm光径比色皿比色,计算MDA含量。
2.6 Real-time PCR检测结肠组织p38 MAPK,MSK1,CREB mRNA的表达
取结肠组织50~100 mg,加入trizol裂解液1 mL,研磨混匀,室温静置5 min,预冷离心机后4 ℃ 1 1000 r·min-1离心5 min,取上清液,加入三氯甲烷200 μL,混匀静置,4 ℃ 12 000 r·min-1离心15 min,吸取上清液,加入异丙醇,混匀静置,1 2000 r·min-1离心15 min,弃上清,加75%乙醇1 mL,混匀,12 000 r·min-1离心5 min,弃上液后,测mRNA浓度,计算加样量。逆转录cDNA,退火25 ℃,5 min,延伸42 ℃,1 h,孵育70 ℃,15 min。将逆转录后的cDNA,按95 ℃ 2 min,1循环。95 ℃ 45 s,53 ℃ 45 s,72 ℃ 30 s,40循环。以β-actin内参,用2-ΔΔCt法计算目的mRNA相对表达量。
2.7 蛋白免疫印迹法(Western blot)检测结肠组织p38 MAPK,MSK1,CREB的表达
取少量大鼠结肠组织,加入预冷的含PMSF的RIPA裂解液500 μL,置于冰面研碎至匀浆后,预冷离心机后12 000 r·min-1离心10 min,取部分上清,行BCA试剂盒检测蛋白浓度,部分上清加入4×上样缓冲液,100 ℃水浴10 min,置于4%电泳浓缩胶浓缩,10%蛋白电泳分离胶分离,再经转膜、封闭、加入p38 MAPK一抗(1∶1 000),MSK1一抗(1∶1 000),CREB一抗(1∶1 000),4 ℃孵育、摇床洗膜,室温孵育二抗(1∶1万),ECL法显色,X医用胶片显影,定影,Bio-Rad Quantity one图像分析软件扫描分析。
2.8 ELISA检测结肠组织IL-1β,IL-6和TNF-α的含量
取大鼠结肠组织约1 g研碎后加入9倍组织质量的预冷0.01 mol·L-1磷酸盐缓冲液(PBS)后于冰上研碎匀浆,取上清液,测定蛋白浓度。并于抗体包被的96孔板中,分别将不同浓度标准品和待测样本各50 μL加入检测孔,除空白孔外,每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,封膜,37 ℃温育30 min,洗板5次,加入酶标试剂,37 ℃温育30 min,洗板5次,加入显色液,37 ℃显色10 min,加入终止液,15 min内测定吸光度A,计算各指标含量。
2.9 统计学方法
采用SPSS 21.0软件进行统计分析,计量数据用
3 结果
3.1 对各组大鼠结肠组织病理形态学的影响
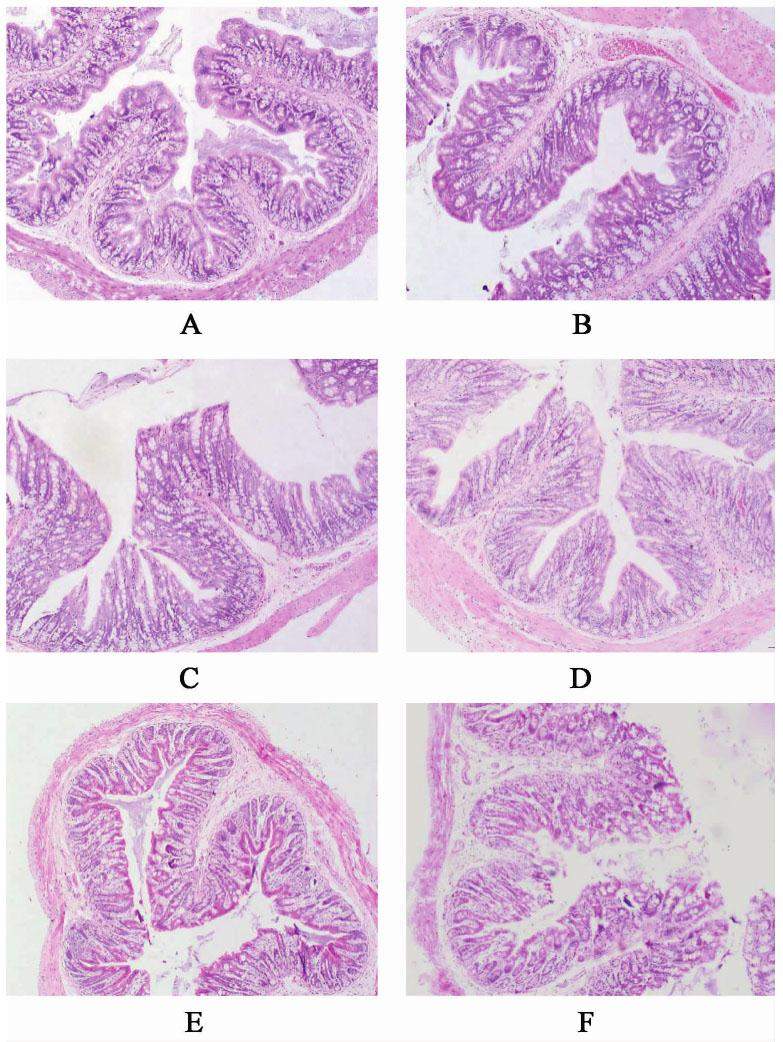
空白组大鼠结肠切片显微镜下观察可以看到结肠黏膜上皮形态较完好,细胞排列规整,黏膜下未见充血、水肿和炎性细胞浸润;模型组大鼠结肠黏膜上皮细胞部分坏死脱落,固有层腺体萎缩,可见血管充血,间质水肿,有少量炎性细胞浸润,结肠组织结构完整,形态结构未见明显异常,符合IBS的形态学特点。痛泻要方低、中、高剂量组及匹维溴铵组大鼠结肠形态完好,组织结构完整,形态结构未见明显病变。见图1。
3.2 对各组大鼠血清中相关氧化应激指标SOD,MDA的影响
与空白组比较,模型组大鼠血清SOD水平明显降低(P<0.05),MDA水平明显升高(P<0.05);与模型组比较,痛泻要方中、高剂量组和匹维溴铵组大鼠血清SOD水平升高,MDA水平明显降低(P<0.05);痛泻要方中、高剂量组和匹维溴铵组大鼠血清SOD水平明显高于痛泻要方低剂量组(P<0.05)。见表2。
| 组别 | 剂量/g·kg-1 | T-SOD/U·mL-1 | MDA/mmol·L-1 |
|---|---|---|---|
| 空白 | - | 216.51±19.80 | 4.69±1.57 |
| 模型 | - | 164.53±15.981) | 7.64±1.981) |
| 痛泻要方 | 2.25 | 174.18±15.48 | 6.16±1.88 |
| 4.50 | 194.63±14.412,3) | 5.76±1.642) | |
| 9.00 | 197.72±13.442,3) | 5.31±1.482) | |
| 匹维溴铵 | 0.02 | 199.21±14.902,3) | 5.48±1.362) |
3.3 对各组大鼠结肠相关细胞因子IL-1β,IL-6,TNF-α的影响
与空白组比较,模型组大鼠结肠组织IL-1β,IL-6,TNF-α水平明显升高(P<0.05);与模型组比较,痛泻要方中、高剂量组和匹维溴铵组大鼠结肠IL-1β,IL-6,TNF-α水平明显降低(P<0.05),痛泻要方低剂量组降低不明显;且痛泻要方各剂量组两两比较,以痛泻要方高剂量组IL-1β,TNF-α水平均明显低于低剂量组(P<0.05),匹维溴铵组IL-1β,IL-6,TNF-α水平均明显低于痛泻要方低剂量组(P<0.05)。见表3。
| 组别 | 剂量/g·kg-1 | IL-1β | IL-6 | TNF-α |
|---|---|---|---|---|
| 空白 | - | 180.48±19.79 | 341.40±36.02 | 407.65±48.28 |
| 模型 | - | 253.80±30.751) | 407.28±42.441) | 522.88±64.921) |
| 痛泻要方 | 2.25 | 230.55±27.77 | 390.76±41.05 | 485.67±58.76 |
| 4.50 | 205.70±26.952) | 364.95±36.892) | 457.73±50.322) | |
| 9.00 | 184.04±22.052,3) | 357.99±33.242) | 424.36±45.092,3) | |
| 匹维溴铵 | 0.02 | 196.70±23.472,3) | 351.07±35.692,3) | 431.55±48.862,3) |
3.4 对各组大鼠结肠组织p38 MAPK信号相关基因p38 MAPK,MSK1,CREB mRNA表达的影响
与空白组比较,模型组大鼠结肠组织p38 MAPK,MSK1,CREB mRNA表达均明显上调(P<0.05);与模型组比较,痛泻要方高剂量组和匹维溴铵组p38 MAPK,MSK1,CREB mRNA表达均明显下调(P<0.05),痛泻要方中剂量组p38 MAPK mRNA表达明显下调(P<0.05)。痛泻要方高剂量组与匹维溴铵组p38 MAPK,MSK1,CREB mRNA明显低于痛泻要方中、低剂量组(P<0.05)。痛泻要方中剂量组p38 MAPK mRNA低于痛泻要方低剂量组(P<0.05)。见表4。
| 组别 | 剂量/g·kg-1 | p38 MAPK | MSK1 | CREB |
|---|---|---|---|---|
| 模型 | - | 1.577±0.076 | 1.600±0.073 | 1.555±0.023 |
| 痛泻要方 | 2.25 | 1.527±0.0521) | 1.523±0.0721) | 1.513±0.0961) |
| 4.50 | 1.350±0.0312,3) | 1.478±0.022 | 1.492±0.034 | |
| 9.00 | 1.130±0.0412,3,4) | 1.197±0.0292,3,4) | 1.200±0.0622,3,4) | |
| 匹维溴铵 | 0.02 | 1.107±0.0362,3,4) | 1.150±0.0182,3,4) | 1.167±0.0462,3,4) |
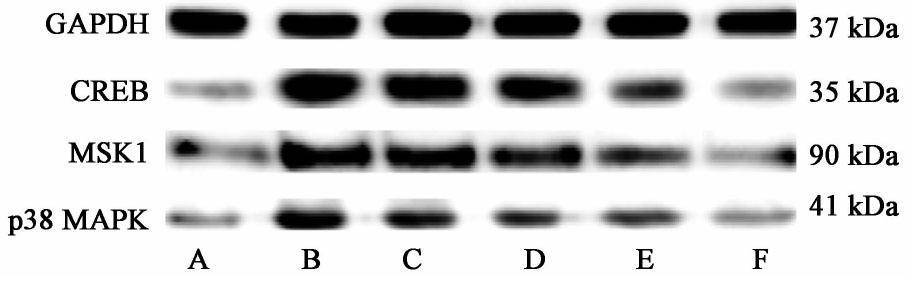
3.5 对各组大鼠结肠组织p38 MAPK,MSK1,CREB蛋白表达的影响
与空白组比较,模型组大鼠结肠组织p38 MAPK,MSK1,CREB蛋白表达均明显升高(P<0.05);与模型组比较,痛泻要方高剂量组和匹维溴铵组p38 MAPK,MSK1,CREB蛋白表达均明显降低(P<0.05),痛泻要方中剂量组p38 MAPK和CREB蛋白表达明显降低(P<0.05);痛泻要方各剂量组p38 MAPK和CREB组间比较差异均有统计学意义(P<0.05),且痛泻要方高剂量组结肠组织MSK1与痛泻要方低、中剂量组比较差异均有统计学意义(P<0.05)。见图2,表5。
| 组别 | 剂量/g·kg-1 | p38 MAPK/GAPDH | MSK1/GAPDH | CREB/GAPDH |
|---|---|---|---|---|
| 空白 | - | 0.443±0.362 | 0.493±0.055 | 0.430±0.036 |
| 模型 | - | 0.677±0.0141) | 0.790±0.0711) | 1.223±0.0721) |
| 痛泻要方 | 2.25 | 0.643±0.019 | 0.737±0.096 | 1.127±0.086 |
| 4.50 | 0.563±0.0362,3) | 0.647±0.090 | 0.897±0.1122,3) | |
| 9.00 | 0.497±0.0372,3,4) | 0.487±0.0542,3) | 0.517±0.0402,3,4) | |
| 匹维溴铵 | 0.02 | 0.457±0.0292,3,4,5) | 0.463±0.0402,3,4) | 0.450±0.0322,3,4) |
4 讨论
腹泻型IBS究其病因病机以及临床表现,常以情志不遂为诱因,以“痛”“泻”为其临床特征,可归属于中医学“泄泻”“腹痛”“郁病”等范畴。中医认为该病多由外邪侵袭、情志失调、饮食失宜等导致肝气不疏,脾虚失运,木郁伤土,升降失常,清浊不分而发,肝气横逆则腹痛,脾气虚弱则泄泻,故肝失疏泄和脾气虚弱常是本病发作的主要病机[13]。本实验“痛泻要方”中炒白术苦甘而温,补脾燥湿以治脾虚,同时炒用燥湿之力大增,为君药;白芍酸苦微凉,柔肝缓急而止痛,与白术相配,土中泻木以治肝旺,为臣药;陈皮辛苦而温,理气燥湿而醒脾和胃,为佐药;方中防风辛散香润,疏肝达木,兼有佐制之用,又香能舒脾,且为脾经引药,其性升浮,祛风胜湿止泻,兼俱佐使之用;四药合用,共奏敛肝健脾、燥湿理气、缓痛止泻,使脾健肝和,痛泻自止。临床以痛泻要方为基础衍生的中医复方对腹泻型IBS的治疗获得较好的效果。匹维溴铵作为治疗IBS最为常用的解痉剂,可直接作用于平滑肌细胞,抑制钙离子内流,缓解胃肠平滑肌痉挛,缓解腹痛的药理学作用,但长期疗效证据不足,常选其作为阳性药。IBS是一种缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病。本研究各组大鼠结肠组织病理形态学观察,大鼠结肠形态完好,组织结构完整,形态结构未见明显的器质性病变。
近年来SOD,MDA在很多系统的疾病研究中得到了重视,而且在探寻疾病病因和治疗方面起到了重大作用。肠道作为人体最大的内分泌和免疫器官,肠管内含有丰富的微生物群,对氧化应激较为敏感。一旦细胞内活性氧的产生超过了细胞内抗氧化系统的防御能力则产生氧化应激反应,产生大量的自由基,促使大量的氧化产物产生,损伤机体组织,因此,氧化应激反应是机体内炎症发生、发展的重要病理环节。SOD是机体内的抗氧化物酶,对机体的氧化/抗氧化平衡起着重要作用,其活性被认为是一种评估抗氧化能力直接的指标。MDA是在组织细胞氧化应激反应过程中产生的氧化应激产物,可反映机体的脂质过氧化及组织损伤的程度[14-15]。本研究中,番泻叶灌胃联合慢性束缚法复建的腹泻型IBS模型大鼠血清中氧化应激水平明显低于正常组,经药物干预后,痛泻要方中、高剂量可升高大鼠血清中SOD的活性,降低MDA的含量,且效果等同于匹维溴铵片。推测痛泻要方可提高机体抗氧化应激效应,维持细胞内环境的稳定和机体的功能状态,达到对腹泻型IBS的治疗作用。
有研究亦表明,社会心理和肠道生理改变相互作用的生理—心理—社会模式,在腹泻型IBS发病中起到重要作用[16]。而免疫系统作为腹泻型IBS精神-肠道因素互动的关键纽带,其平衡对腹泻型IBS内脏敏感性有重要影响[17]。MAPK级联激活是多种信号通路的中心,广泛存在于人体细胞内,其作为主要的炎性信号蛋白,可将细胞产生的具有广泛生物活性的低分子量可溶性蛋白质、激素、神经递质、细胞黏附及物理应激等细胞外刺激转化为增殖、分化、迁移、调亡等不同的细胞进程[18-19]。p38 MAPK信号通路是MAPK家族中重要的成员之一,其与炎症和应激反应的调控密切相关,目前p38 MAPK已成为抗炎疗法中重要的潜在靶点[20]。研究表明,p38 MAPK主要位于细胞浆内,其活性在生理情况下是很低的,可被特定细胞因子TNF-α,IL-6,IL-1β等刺激而活化,活化后的p38 MAPK通过级联磷酸化激活丝裂原和应激激活的蛋白激酶(MSK)蛋白,活化的MSK介导转录因子磷酸化活化和组蛋白H3的10位丝氨酸磷酸化修饰。MSK表达极其广泛,家族有MSK1和MSK2,MSK1还有多个位点可被磷酸化修饰,如Ser647,657,695,但对MSK1的活性影响不大;据推测,MSK2的激活方式与MSK1类似,但研究程度远不如MSK1清楚。MSK可直接磷酸化下游底物CREB的Ser133,磷酸化的CREB其转录活性会增加10~20倍[21]。p38 MAPK信号通路被活化后,可通过调控机体下游一系列靶基因的转录与表达,来介导IBS或腹泻型IBS的发生、发展及变化。细胞因子参与机体免疫及炎症反应的调节。白细胞介素类细胞因子在炎症过程中起着关键作用,其通常由协同刺激T淋巴细胞以及诱导抗体分泌和急性期蛋白质产生(在清除病原菌时发挥重要作用)等引起,已证实,肠黏膜屏障的损伤贯穿了整个肠道炎症反应的过程[22]。本课题组前期研究发现,番泻叶灌胃联合慢性束缚法复建的腹泻型IBS大鼠Th1促炎因子IL-12的含量升高,Th2抑炎因子IL-10的含量降低,可能存在Th1/Th2平衡漂移[11]。IL-1β首先在细胞质内合成无活性的前体pro-IL-1β,经半胱氨酸蛋白酶(Caspase)-1酶切后产生成熟有活性的IL-1β,协同引发一系列的肠道炎症和黏膜损伤[23]。IL-6是一种被认为具有促炎和抑炎双重生物学效应的多功能复杂细胞因子,IL-6可促进中性粒细胞和单核细胞在炎症及感染部位的聚集,防止局部的过度损伤,又可通过神经内分泌调节肠道神经元和平滑肌细胞,引发胃肠道动力系统的变化。TNF-α被认为是肠黏膜屏障损伤的重要启动因子,可通过激活NF-κB,诱导产生多种炎性因子如IL-1β,IL-6等,进而加重对肠黏膜屏障的损伤。同时,p38 MAPK信号通路活化后可显著上调下游细胞因子TNF-α,IL-1,IL-6等的表达,越来越多的证据支持IBS患者存在免疫激活和IL-1,IL-6和TNF-α水平等炎症因子增加[24]。
本次实验中,番泻叶灌胃联合慢性束缚法复建的腹泻型IBS模型大鼠结肠中p38 MAPK信号通路的关键因子和下游细胞因子明显高于正常组,而经痛泻要方中、高剂量干预后其结肠组织中p38 MAPK mRNA表达及p38 MAPK,CREB蛋白含量降低,高剂量组MSK1,CREB mRNA表达及MSK1蛋白含量降低,炎症因子IL-1β,IL-6和TNF-α的含量也随之降低。提示痛泻要方在一定范围内呈明显的剂量——效应关系,能抑制p38 MAPK的活化,减少MSK1的磷酸化,降解CREB的分泌水平,并能有效降低腹泻型IBS大鼠结肠的炎症反应,且痛泻要方高剂量组效果等同于匹维溴铵片。推测痛泻要方可能通过抑制p38 MAPK信号通路的活化,减少相关炎性因子的表达,降低炎症反应,来达到对腹泻型IBS的治疗作用。
