款冬花为菊科款冬属植物款冬的干燥花蕾,始载于《神农本草经》,是止咳平喘方剂中的传统用药,临床上多用于治疗哮喘、慢性支气管炎等疾病[1]。款冬植物主要分布于欧亚温带地区,在我国分布十分广泛。款冬花主要含有三萜皂苷、倍半萜、黄酮、生物碱、色原酮、绿原酸、挥发油等化学成分,具有一定的抗氧化、抗炎、抑制α-葡萄糖苷酶、神经保护等作用[2-4]。亦有部分东欧国家用款冬花或叶治疗感冒咳嗽、气管炎、支气管哮喘等症状[5-6]。
研究发现,已从款冬花中检出或分离得到吡咯里西啶生物碱(PAs)[7-9]。其中,部分具有显著的肝脏毒性,可导致肝小静脉闭塞症,肝巨细胞症和肝纤维化坏死等[10-11]。同时,PAs类成分可经机体代谢活化形成毒性代谢物质,造成肝细胞功能紊乱、坏死,最终导致组织损伤[12]。此外,其吡咯代谢物还能破坏DNA结构或形成DNA交联和DNA蛋白复合物,进而诱导基因突变乃至癌变[13]。近年来,国内外均有报道,因服用含有吡咯里西啶类生物碱的食品(如蜂蜜、牛奶、茶叶)或间接食物污染,从而导致人畜中毒的事件发生[14]。目前有关款冬花等传统中草药中该类成分的检测分析的相关研究报道较少,针对其中该毒性成分的检测不仅能在一定程度上预防中毒事件的发生,也可以为药材安全使用的限量标准及合理使用的规范提供实验基础与参考。
PAs类化合物紫外吸收弱,传统的HPLC-UV检测灵敏度较低,难以满足微量乃至痕量成分的检测分析,例如款冬花中千里光宁碱的质量分数约为0.000 1%[15]。报道发现,利用液质联用技术达到的灵敏度水平更高,可实现药材中PAs类的检测分析研究。例如濮社班等[16]采用HPLC-ESI-MSn对不同来源款冬药材的PAs类成分进行定性检测,并在缺乏对照品的情况下分析相关PAs的结构与种类。目前有关款冬花中吡咯里西啶生物碱的研究仍存在不足之处;例如采用杂质干扰大、准确度低的比色法检测总生物碱的含有量,结果准确性存疑[17],或所建立的定量分析方法灵敏度不高等[18]。由此可见,针对款冬花中的吡咯里西啶生物碱的检测,需要建立一种准确的定量分析方法,进一步研究其中可能含有的PAs含量与种类。且不同来源的款冬药材含有的PAs不同,其中的含量与种类均存在一定差别,需要进行具体分析与测定研究。故本实验对15批不同来源的款冬花样品进行UPLC-MS/MS测定,分析其中PAs及其相应氮氧化物的含量差异与分布现状,通过比较不同来源的样品中该类生物碱的含量与分布,为款冬花的毒性研究、安全用药和合理开发提供科学依据。
1 材料
1290-6470 QQQ型超高效液相色谱-三重四级杆质谱联用仪(美国安捷伦Agilent公司);Agilent Eclipse Plus C18色谱柱(3.0 mm × 150 mm,1.8 μm);HC-800型高速多功能粉碎机(永康市天祺盛世工贸有限公司);Q50型TGA热重分析仪(美国TA仪器公司);ME104E型1/1万电子分析天平[梅特勒-托利多仪器(上海)有限公司];SC-3610型低速离心机(安徽中科中佳科协仪器有限公司);KQ-500E型超声仪(昆山市超声仪器有限公司,超声功率500 W,频率40 kHz);SPE-M08正压型多功能固相萃取装置(天津博纳艾杰尔科技有限公司);Cleanert PCX固相萃取柱(500 mg/6 mL 30/pkg,天津博纳艾杰尔科技有限公司);液相微量进样针(瑞士Hamilton公司);移液枪(德国Eppendorf公司)。
甲醇、乙醇(北京化工厂,分析纯);乙腈、甲醇(美国Fisher chemical,色谱纯);甲酸(美国MREDA Technology Inc,色谱纯),甲酸铵(阿达玛斯试剂有限公司,RG级,纯度98%);浓硫酸(纯度98%);浓氨水(纯度28%);娃哈哈纯净水。
吡咯里西啶生物碱对照品分别为蓝蓟定,N-氧化蓝蓟定,欧天芥菜碱,N-氧化天芥菜碱,印美定碱,N-氧化印美定碱,石松胺,N-氧化石松胺,千里光宁碱,N-氧化千里光宁碱,千里光菲灵碱,N-氧化千里光菲灵碱,春千里光碱,倒千里光裂碱,克氏千里光碱(德国中草药PhytoLab公司,纯度均≥98%,批号分别为12430,12431,12456,11612,10940,12405,12183,12291,11782,11610,11783,11722,10957,12185,11964)。
收集来自河北、内蒙古、甘肃、四川、山西5个省共15份不同产地、批次的款冬花药材,经中国医学科学院药用植物研究所林余霖研究员鉴定为菊科款冬属植物款冬Tussilago farfara的干燥花蕾或蜜炙品,样本保存于中国医学科学院药用植物研究所天然药物化学中心。采集地点包括各地药材市场、中药饮片药业有限公司以及日常药店等多种不同渠道,每份药材收集100~500 g,充分干燥后除去多余花梗、叶片,使用高速粉碎机粉碎药材,过60目筛,得到0.25~0.35 mm的样品粉末。款冬花样品来源情况见表1。
| 样品编号 | 产地 | 采集地点 | 采集时间/年月 | 样品编号 | 产地 | 采集地点 | 采集时间/年月 |
|---|---|---|---|---|---|---|---|
| 1 | - | 北京同仁堂 | 2017-10 | 9 | 甘肃 | 成都药材市场 | 2018-12 |
| 2 | 四川 | 安徽亳州药材市场 | 2017-10 | 10 | - | 安徽亳州药材市场 | 2018-12 |
| 3 | 河北 | 百草康神药业 | 2017-10 | 11 | 甘肃 | 荷花池药材市场 | 2019-01 |
| 4 | 河北张家口 | 安国中药材市场 | 2017-11 | 12 | 河北 | 荷花池药材市场 | 2019-01 |
| 5 | 内蒙古通辽 | 安国中药材市场 | 2017-11 | 13 | 河北 | 百草康神药业 | 2019-02 |
| 6 | 甘肃陇西 | 安国中药材市场 | 2017-11 | 14 | - | 北京同仁堂 | 2019-02 |
| 7(野生) | 山西吕梁 | 安国中药材市场 | 2017-11 | 15(蜜炙) | - | 北京同仁堂 | 2019-02 |
| 8 | 河北 | 大同老药工药店 | 2018-09 |
2 方法
2.1 溶液的制备
2.1.1 对照品溶液
精密称取各对照品约1 mg,加乙腈溶解并定容至10 mL量瓶,得100 mg·L-1对照品储备母液,-20 ℃保存。用微量进样针取对照品储备母液各100 μL于10 mL量瓶中,甲醇定容,制得约1 mg·L-1 PAs混合溶液,-20 ℃保存。对照品详细质量浓度见表2。取1 mg·L-1PAs混合溶液适量稀释,配制成浓度梯度为0.1,0.2,0.5,1,2,5,10,20,50,100,200,500 μg·L-1的混合对照溶液,4 ℃保存。
| No. | 对照品 | 分子式 | 称样量/mg | 储备液质量浓度/mg·L-1 | 工作液质量浓度/mg·L-1 |
|---|---|---|---|---|---|
| 1 | N-氧化蓝蓟定 | C20H31NO8 | 1.499 6 | 149.96 | 1.499 6 |
| 2 | N-氧化天芥菜碱 | C16H27NO6 | 1.585 9 | 158.59 | 1.585 9 |
| 3 | 印美定碱 | C15H25NO5 | 1.083 9 | 108.39 | 1.083 9 |
| 4 | N-氧化印美定碱 | C15H25NO6 | 0.924 0 | 92.40 | 0.924 0 |
| 5 | 石松胺 | C15H25NO5 | 1.334 4 | 133.44 | 1.334 4 |
| 6 | N-氧化石松胺 | C15H25NO6 | 0.994 6 | 99.46 | 0.994 6 |
| 7 | 千里光宁碱 | C18H25NO5 | 1.005 3 | 100.53 | 1.005 3 |
| 8 | N-氧化千里光宁碱 | C18H25NO6 | 1.059 2 | 105.92 | 1.059 2 |
| 9 | 千里光菲灵碱 | C18H23NO5 | 1.184 1 | 118.41 | 1.184 1 |
| 10 | 春千里光碱 | C18H25NO5 | 1.317 7 | 131.77 | 1.317 7 |
| 11 | 克氏千里光碱 | C19H27NO6 | 0.897 0 | 89.70 | 0.897 0 |
| 12 | 倒千里光裂碱 | C8H13NO2 | 0.896 1 | 89.61 | 0.896 1 |
| 13 | 欧天芥菜碱 | C16H27NO6 | 1.125 1 | 112.51 | 1.125 1 |
| 14 | N-氧化千里光菲灵碱 | C18H23NO6 | 1.090 0 | 109.00 | 1.090 0 |
| 15 | 蓝蓟定 | C20H31NO7 | 10.980 0 | 1 098.00 | 1.098 0 |
2.1.2 供试品溶液
称取药材样品粉末约2.0 g,置于50 mL锥形瓶中,加入甲醇40 mL润湿,密封后,振荡摇匀,室温下超声提取30 min; 5 000 r·min-1离心10 min,取上清液并浓缩至1 mL左右。加入0.05 mol·L-1硫酸溶液稀释样品溶液至10~15 mL,进行SPE-PCX的富集纯化。具体流程为甲醇5 mL活化SPE-PCX小柱,0.05 mol·L-1硫酸溶液5 mL平衡小柱,将硫酸样品溶液10~15 mL上柱,甲醇8~10 mL淋洗除杂,8%氨水-甲醇溶液10 mL洗脱,收集洗脱液并浓缩至1 mL左右。用50%甲醇-水稀释样品,定容至2 mL量瓶中,过0.22 μm微孔滤膜,取供试样品溶液1~1.5 mL,稀释200倍后,取适量至液相小瓶中,供UPLC-MS/MS分析测定。
2.2 液相色谱与质谱条件
2.2.1 色谱条件
Agilent Eclipse Plus C18色谱柱(3.0 mm×150 mm,1.8 μm);流动相A相为含0.05%甲酸和2.5 mmol·L-1甲酸铵的水溶液,B相为含0.05%甲酸和2.5 mmol·L-1甲酸铵的甲醇;梯度洗脱(0.5~1.0 min,5%~20%B;1.0~8.5 min,20%~37%B;8.5~10.0 min,37%~80%B;10.0~11.0 min,80%~95%B;11.0~12.5 min,95%B;12.5~13.0 min,95%~5%B;13.0~16.0 min,5%B);流速0.4 mL·min-1,柱温40 ℃,进样量2 μL。
2.2.2 质谱条件
带鞘流气的电喷雾离子源(AJS-ESI),离子化模式ESI+;雾化气压力275.79 kPa;雾化干燥气温度300 ℃;气体流量7 L·min-1;鞘流气温度325 ℃;鞘流气流量11 L·min-1;毛细管电压3 500 V;质量扫描范围m/z 0~500;质谱扫描方式多反应监测模式(MRM)。优化后PAs对照品的质谱参数见表3。
| No. | 对照品 | 扫描离子对(m/z ) | 碎裂电压/V | 碰撞能量/V | |
|---|---|---|---|---|---|
| 母离子[M+H]+ | 子离子 | ||||
| 1 | N-氧化蓝蓟定 | 414.2 | 254.11) | 152 | 33 |
| 352.1 | 152 | 33 | |||
| 2 | N-氧化天芥菜碱 | 330.2 | 138.01) | 149 | 29 |
| 172.0 | 149 | 29 | |||
| 3 | 印美定碱 | 300.2 | 138.01) | 144 | 21 |
| 156.0 | 144 | 33 | |||
| 4 | N-氧化印美定碱 | 316.2 | 172.01) | 152 | 33 |
| 138.0 | 152 | 33 | |||
| 5 | 石松胺 | 300.2 | 138.01) | 149 | 21 |
| 156.0 | 149 | 33 | |||
| 6 | N-氧化石松胺 | 316.2 | 172.01) | 149 | 29 |
| 138.0 | 149 | 29 | |||
| 7 | 千里光宁碱 | 336.2 | 120.11) | 185 | 33 |
| 138.0 | 185 | 33 | |||
| 8 | N-氧化千里光宁碱 | 352.2 | 118.01) | 167 | 45 |
| 136.0 | 167 | 37 | |||
| 9 | 千里光菲灵碱 | 334.2 | 120.01) | 162 | 29 |
| 138.0 | 162 | 29 | |||
| 10 | 春千里光碱 | 336.2 | 120.01) | 177 | 33 |
| 138.1 | 177 | 33 | |||
| 11 | 克氏千里光碱 | 366.2 | 168.01) | 157 | 33 |
| 150.0 | 157 | 29 | |||
| 12 | 倒千里光裂碱 | 156.2 | 112.01) | 106 | 21 |
| 108.1 | 106 | 21 | |||
| 13 | 欧天芥菜碱 | 330.2 | 138.01) | 131 | 21 |
| 156.0 | 131 | 33 | |||
| 14 | N-氧化千里光菲灵碱 | 350.2 | 120.11) | 154 | 37 |
| 136.0 | 154 | 37 | |||
| 15 | 蓝蓟定 | 398.2 | 120.01) | 151 | 17 |
| 220.0 | 151 | 17 | |||
2.3 方法学考察
2.3.1 方法专属性
取混合对照品溶液、供试样品溶液各1 mL,在2.2色谱-质谱条件下检测,PAs混合对照品与供试样品的TIC见图1,混合对照品与样品溶液中各成分分离良好,在目标物对应色谱峰处均无干扰,且空白样品无干扰,表明该方法专属性较强。

2.3.2 线性关系与灵敏度
按2.1.1项下方法配制混合对照品溶液并稀释成标准曲线,在2.2项优化后的条件下进样检测;以峰面积积分值为纵坐标(Y),相应对照品质量浓度为横坐标(X),进行线性回归分析,得到线性回归方程;结果表明各PAs对照品在相应线性范围内的线性关系良好,其线性关系与相关系数见表4。以定量离子对的色谱峰信噪比S/N≥3对应的最低浓度为检测限(LOD),以定量离子对的色谱峰信噪比S/N≥10对应的最低浓度为定量限(LOQ),考察各PAs对照品的检测灵敏度,其具体结果见表4。
| No. | 对照品 | 线性方程 | R2 | 线性范围/μg·L-1 | 检测限/μg·L-1 | 定量限/μg·L-1 |
|---|---|---|---|---|---|---|
| 1 | N-氧化蓝蓟定 | Y=395.608 8X-151.346 4 | 0.997 8 | 0.749 8~749.800 0 | 0.150 0 | 0.299 9 |
| 2 | N-氧化天芥菜碱 | Y=9 483.693 7X-1 214.320 9 | 0.998 6 | 0.317 2~317.180 0 | 0.158 6 | 0.317 2 |
| 3 | 印美定碱 | Y=21 061.524 1X-1 893.720 3 | 0.998 2 | 0.216 8~541.950 0 | 0.010 8 | 0.108 4 |
| 4 | N-氧化印美定碱 | Y=17 709.571 2X-2 023.628 6 | 0.998 2 | 0.184 8~462.000 0 | 0.046 2 | 0.184 8 |
| 5 | 石松胺 | Y=12 943.116 7X-1 566.116 8 | 0.998 6 | 0.266 9~667.200 0 | 0.013 3 | 0.133 4 |
| 6 | N-氧化石松胺 | Y=14 126.866 2X-1 267.593 2 | 0.997 9 | 0.198 9~497.300 0 | 0.049 7 | 0.198 9 |
| 7 | 千里光宁碱 | Y=635.186 5X-145.670 9 | 0.995 9 | 0.502 7~201.060 0 | 0.100 5 | 0.502 7 |
| 8 | N-氧化千里光宁碱 | Y=1 079.041 5X-140.255 6 | 0.998 9 | 0.529 6~211.840 0 | 0.105 9 | 0.529 6 |
| 9 | 千里光菲灵碱 | Y=2 674.309 7X-243.627 0 | 0.996 5 | 0.592 1~592.050 0 | 0.118 4 | 0.592 1 |
| 10 | 春千里光碱 | Y=2 734.056 6X-364.343 8 | 0.997 9 | 0.263 5~263.540 0 | 0.065 9 | 0.263 5 |
| 11 | 克氏千里光碱 | Y=1 132.238 2X+332.834 2 | 0.997 5 | 0.448 5~448.500 0 | 0.017 9 | 0.089 7 |
| 12 | 倒千里光裂碱 | Y=2 996.727 2X-780.726 9 | 0.998 7 | 0.448 1~448.050 0 | 0.089 6 | 0.448 1 |
| 13 | 欧天芥菜碱 | Y=2 2471.953 8X-300.384 7 | 0.997 3 | 0.112 5~562.550 0 | 0.011 3 | 0.112 5 |
| 14 | N-氧化千里光菲灵碱 | Y=1 363.913 9X-230.079 0 | 0.998 3 | 0.545 0~218.000 0 | 0.218 0 | 0.545 0 |
| 15 | 蓝蓟定 | Y=4 260.843 3X-81.397 8 | 0.996 0 | 0.219 6~549.000 0 | 0.054 9 | 0.219 6 |
2.3.3 精密度试验
取3个质量浓度水平(10,50,100 μg·kg-1)的混合对照品溶液各1 mL,在2.2项条件下检测,同一浓度重复进样6次,分别计算各对照品峰面积RSD在0.6%~5.5%,表明仪器的精密度良好。
2.3.4 准确度试验
称取9份已知含量的空白样品粉末1.0 g,分别精密加入一定量的各对照品溶液,按2.1.2项下方法制备加样回收率的供试品溶液,3个质量浓度水平(10,50,100 μg·kg-1)各制备3份,在2.2项条件下进样分析,分别计算各对照品的平均回收率。
结果显示,其中12号对照品倒千里光裂碱在10 μg·kg-1水平的平均回收率为68.10%,RSD为0.4%,9号对照品千里光菲灵碱在10 μg·kg-1水平的平均回收率69.65%,RSD为1.3%,略低于2015年版《中国药典》药品质量标准分析方法验证指导原则中的数据要求(待测成分质量分数10 μg·kg-1回收率在70%~125%)。其余PAs对照品的平均回收率在71.52%~105.96%,RSD在5.7%以下,表明方法的回收率良好。
试验发现12号对照品倒千里光裂碱的平均回收率相较于其他对照品普遍偏低,可能原因为该对照品的出峰时间较早,保留效果欠佳。9号对照品千里光菲灵碱仅在10 μg·kg-1水平的回收效果欠佳,可能原因为该浓度水平较低,检测过程中受到仪器状态与环境因素的一定影响。
2.3.5 重复性试验
称取6份13号款冬花样品粉末2.0 g,按2.1.2项下方法平行制备6份供试样品溶液,按2.2项下条件进样分析,分别计算样品中各PAs峰面积RSD在2.8%~9.0%,表明方法的重复性良好。
2.3.6 基质效应考察
基质效应根据对检测信号影响不同分为基质增强效应和减弱效应。选取3种空白基质,制备3个质量浓度水平(50,100,200 μg·kg-1)的混合对照品基质溶液,以其目标化合物的响应值与相应浓度标准曲线的响应值作比值;结果显示倒千里光裂碱的响应比在28.92%~52.96%,具有明显的基质减弱效应;N-氧化印美定碱的响应比在120.85%~143.50%,具有明显的基质增强效应;其余对照品响应比在71.16%~117.25%,表明无明显的基质效应影响,方法的纯化效果较好。
2.4 供试样品的测定
按照2.1.2项下方法制备供试样品溶液,按照2.2项下条件进行测定,采用外标法计算各样品中PAs含量结果。
3 结果与分析
3.1 不同来源款冬花样品中PAs的含量与种类
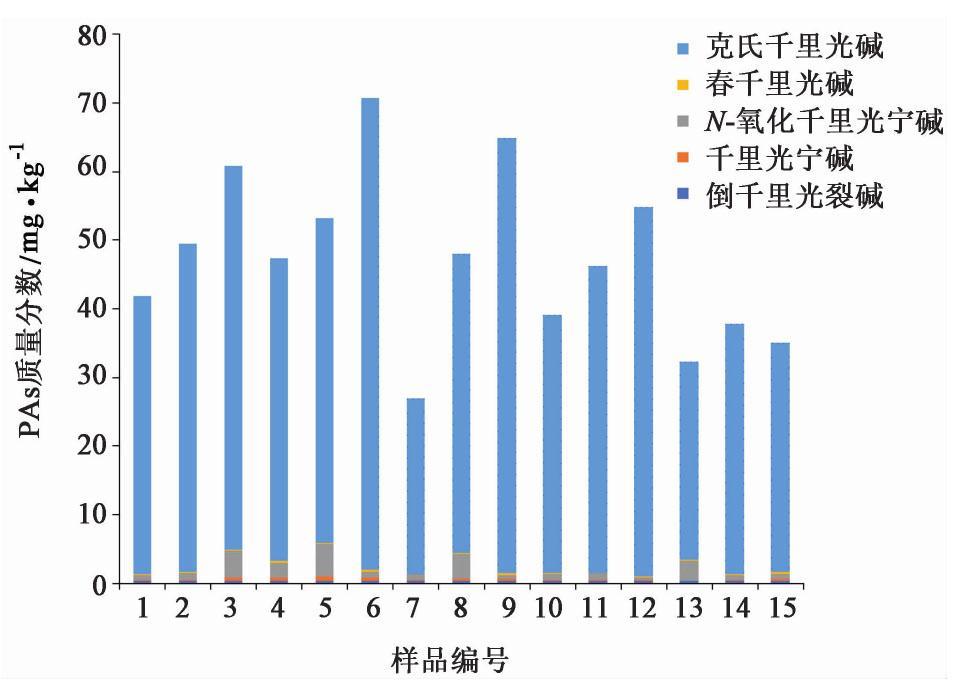
共收集15个不同产地、批次的款冬花样品,对其中的PAs成分进行定量测定,结果表明,所有样品均含有PAs,其中7号样品(山西吕梁野生)中PAs总检出量最低(26.93 mg·kg-1),6号样品(甘肃陇西)中PAs总检出量最高(70.78 mg·kg-1),详细结果见表5。实验发现为不同来源的样品中含有的PAs种类基本相同,均为克氏千里光碱,千里光宁碱及N-氧化千里光宁碱,倒千里光裂碱以及春千里光碱。此外,样品5号(内蒙古通辽),7号(山西吕梁野生),1号(北京同仁堂)中检测到N-氧化千里光菲灵碱,但由于含量低于其定量限,且不在相应线性范围内,无法进行定量分析。其余对照品在本实验中未被检测到。
| 样品编号 | 克氏千里光碱 | N-氧化千里光宁碱 | 千里光宁碱 | 春千里光碱 | 倒千里光裂碱 | 总检出量 |
|---|---|---|---|---|---|---|
| 1 | 40.59±0.30 | 0.53±0.05 | 0.23±0.07 | 0.15±0.02 | 0.31±0.03 | 41.81±0.29 |
| 2 | 47.92±0.90 | 0.97±0.15 | 0.18±0.13 | 0.14±0.04 | 0.30±0.18 | 49.52±1.14 |
| 3 | 56.00±25.65 | 3.92±0.98 | 0.40±0.34 | 0.18±0.13 | 0.34±0.01 | 60.83±27.09 |
| 4 | 44.16±15.49 | 2.16±0.50 | 0.43±0.56 | 0.28±0.22 | 0.32±0.14 | 47.36±16.90 |
| 5 | 47.33±12.17 | 4.65±1.82 | 0.67±0.00 | 0.31±0.06 | 0.28±0.00 | 53.23±13.93 |
| 6 | 68.77±14.64 | 0.87±0.39 | 0.39±0.01 | 0.36±0.11 | 0.39±0.01 | 70.78±15.12 |
| 7 | 25.65±0.98 | 0.80±0.10 | 0.09±0.10 | 0.06±0.03 | 0.34±0.00 | 26.93±1.15 |
| 8 | 43.59±3.35 | 3.71±0.53 | 0.29±0.02 | 0.15±0.03 | 0.30±0.09 | 48.03±4.03 |
| 9 | 63.43±6.89 | 0.61±0.67 | 0.22±0.01 | 0.19±0.05 | 0.38±0.01 | 64.82±7.49 |
| 10 | 37.62±8.93 | 0.88±0.18 | 0.15±0.02 | 0.11±0.10 | 0.28±0.00 | 39.03±8.64 |
| 11 | 44.76±13.24 | 0.97±0.30 | 0.14±0.03 | 0.12±0.07 | 0.30±0.00 | 46.29±13.64 |
| 12 | 53.93±1.18 | 0.22±0.34 | 0.21±0.07 | 0.24±0.02 | 0.30±0.07 | 54.90±1.49 |
| 13 | 28.97±4.58 | 2.89±0.47 | 0.11±0.05 | 0.06±0.03 | 0.29±0.07 | 32.33±4.55 |
| 14 | 36.49±9.04 | 0.63±0.08 | 0.19±0.06 | 0.13±0.03 | 0.31±0.12 | 37.75±9.06 |
| 15 | 33.50±12.28 | 0.68±0.41 | 0.35±0.04 | 0.23±0.07 | 0.31±0.10 | 35.07±12.67 |
3.2 不同PAs在款冬花样品中的含量与差异
本实验以15个PAs对照品,采用MRM模式进行同时测定,检测到中药款冬花中含有克氏千里光碱,千里光宁碱及N-氧化千里光宁碱,春千里光碱,倒千里光裂碱以及N-氧化千里光菲灵碱。其余9个PAs对照品在本实验中未被检测到。结果表明药材款冬花中PAs的含量与分布有较大差异。其中检出质量分数最高的PAs成分为克氏千里光碱,25.65~68.77 mg·kg-1,占其样品PAs总检出量的88.90%~98.23%;其次质量分数较高的N-氧化千里光宁碱,0.22~4.65 mg·kg-1,占其总检出量的0.40%~8.94%。这2种成分的含量占其样品中所测定成分总检出量的97.48%~98.80%。此外,千里光宁碱0.09~0.67 mg·kg-1;春千里光碱0.06~0.36 mg·kg-1;倒千里光裂碱0.28~0.39 mg·kg-1;N-氧化千里光菲灵碱含量低于其定量限,无法准确定量。具体结果见图2。
4 讨论
本实验运用UPLC-MS/MS技术同时测定不同来源的款冬花中PAs及其氮氧化物的含量,实验方法参考文献[19]标准。实验过程中对提取溶剂、提取方式、富集纯化方法、稀释溶剂分别进行考察,从而优化了制备方法。其中,样品提取过程中考察甲醇、甲醇-硫酸溶液和硫酸溶液的提取效果,最终选择对样品提取效果较好的甲醇作为溶剂,采用超声提取的方式可节省时间且方便操作;固相萃取中考察3种不同类型的固相萃取小柱,最终选择SPE-PCX类型的小柱进行富集纯化,并相应更改上样溶液与洗脱剂为硫酸溶液与氨水-甲醇溶液;样品稀释溶解中考察甲醇和50%甲醇-水的检测效果,最终选择后者为供试品检测的稀释溶液。与已有研究相比,实验过程增加对PAs氮氧化物的检测分析,并将测定时间缩短为16 min,检测到目标化合物的分离度与灵敏度良好,方法学考察结果良好。故采用该方法对15批不同产地、批次的款冬花药材进行PAs含量测定,结果表明15批款冬花药材中均含有PAs及其氮氧化物,平均质量分数47.25 mg·kg-1。其中,含量最高PAs为克氏千里光碱,平均质量分数44.85 mg·kg-1,占所测成分平均总量的94.92%,是款冬药材中最主要的PAs类成分;其次为N-氧化千里光宁碱,平均质量分数1.63 mg·kg-1,占所测成分平均总量的3.45%。此2种成分的平均含量占所测PAs总量的98%以上。已有文献报道,检测到中药款冬含有千里光宁碱、千里光菲灵碱、克氏千里光碱[20];其中,克氏千里光碱质量分数在19.5~46.6 mg·kg-1,千里光宁碱质量分数<1 mg·kg-1 [21]。本次实验测得克氏千里光碱质量分数25.65~68.77 mg·kg-1;千里光宁碱质量分数较低,为0.09~0.67 mg·kg-1,但其氮氧化物(N-氧化千里光宁碱)的质量分数相比其他PAs成分较高,为0.22~4.65 mg·kg-1。此外,实验中未检测到千里光菲灵碱,仅在部分样品中检测出其氮氧化物(N-氧化千里光菲灵碱),推测PAs与其氮氧化物之间可能存在相互转化的现象。
从15批款冬花含量测定结果可以看出,不同样品间PAs成分含量差异较大,RSD在10.5%~ 88.8%,PAs成分的总量也具有一定差异,RSD为26.0%。虽然各批次款冬药材中所含PAs种类基本相同,但同一PAs成分在不同产地、批次的款冬花药材间存在明显差异。不同来源的药材由于生长环境与栽培方式而导致其含量存在客观差异,实验收集的款冬花药材大多来自各地药材市场,部分购自药店与药业公司,在具体采集与加工处理过程中存在极大不确定性。因此,有关不同来源药材中PAs含量差异大的原因仍需要深入研究。
目前,大量研究证实,克氏千里光碱、千里光宁碱、千里光菲灵碱等大环双酯的不饱和类PAs具有较强的肝脏毒性,过量或长期摄入会导致急性或慢性肝损伤症状[10-11]。已有实验表明,款冬花的水煎液及总生物碱具有一定的肝脏毒性[22]。而款冬花作为常用中药材,特别在止咳化痰平喘的中成药制剂中使用十分频繁。临床观察发现,加用款冬花散能够明显改善支气管扩张症急性加重期患者的症状,值得临床推广使用[23]。因此,对其中PAs类毒性成分的有效检测与快速筛查显得尤为重要,其安全用量与合理使用也是接下来研究与讨论的重点。本实验中建立的UPLC-MS/MS同时测定款冬花中PAs及其氮氧化物含量的方法灵敏准确、操作方便,可用于不同来源款冬药材中PAs的检测分析及使用风险评估。另外,本实验亦可为其他菊科药材中生物碱的分析检测研究提供参考依据。
Determination of pyrrolizidine alkaloids (PA) in plant material by SPE-LC-MS/MS
[EB/OL].https://www.bfr.bund.de/en/pyrrolizidine_alkaloids_pa_-192924.html ,
