非酒精性脂肪肝病(NAFLD)是一种无过量饮酒史,以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征。病理学上表现为以肝细胞脂肪变性为主要特征的系列性病变谱[1],其病变是从单纯的肝脏脂质沉积到脂肪变性继发为脂肪性肝炎,最后导致肝纤维化和肝硬化[2]。NAFLD对人体的危害性不仅限于肝脏病变,NAFLD本身是2型糖尿病和心血管疾病等的独立危险因素,大部分患者的死因来源于心脑血管疾病,而不是肝病[3]。随着生活水平的提高,该病在全球呈流行趋势,分布广泛,截至2018年,全球NAFLD的患病率为25.24%,而我国NAFLD的患病率为20.09%[4]。我国的NAFLD已成为继病毒性肝炎后第2位常见肝病,严重威胁人类的健康,但NAFLD的治疗却不容乐观,目前,临床上治疗NAFLD的常用药物为他汀类降脂药物,但这类药物具有加重肝脏负担的危害,由于NAFLD和非酒精性脂肪性肝炎(NASH)的病理学机制尚不清楚,因此,市场缺乏治疗该病的特异性药物,研发有效安全治疗该病的药物迫在眉睫。
大黄素是中药大黄中主要提取物,也属于何首乌、虎杖、番泻叶等中药的主要单体成分。大黄素属游离蒽醌类化合物,化学名称为1,3,8-三羟基-6-甲基蒽醌,分子式为C15H10O5,大黄素在临床中常见的药理作用有抑菌、抗炎、保护肝肾、抑制血小板聚集、改善微循环、抗癌等[5]。近年来,越来越多的研究表示,大黄素具有降脂、抗氧化应激和修复线粒体功能等作用,并且不少研究已经证实大黄素可作为治疗NAFLD的有效物质基础,但是,由于研究不足,大黄素对NAFLD治疗机制的阐述仍未明了。
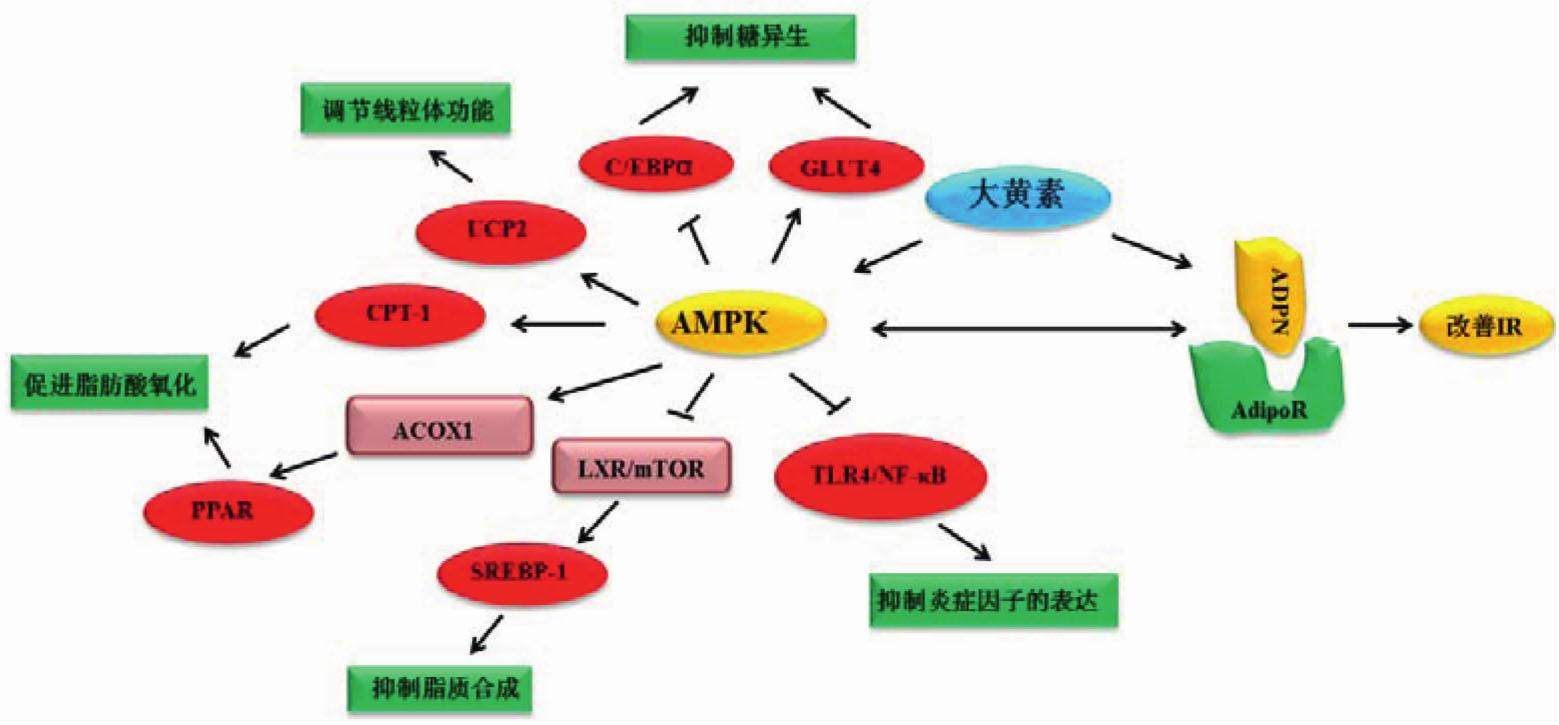
腺苷酸活化蛋白激酶(AMPK)是体内不可缺少的蛋白激酶,参与多种代谢过程,尤其是糖脂代谢[6]。AMPK广泛分布于能量代谢旺盛的组织,如肝、脂肪、骨骼肌等,被称为“细胞能量平衡的感受器”,是细胞内调节脂肪代谢的关键分子[7]。有研究表示,AMPK参与NAFLD的发生过程,AMPK活化减轻NAFLD主要通过3种途径,抑制肝脏中的脂肪生成、增加肝脏中脂肪酸氧化和促进脂肪组织中线粒体功能完整性[8]。基于AMPK在代谢疾病中发挥的相关作用,临床上一直致力于寻找有效的AMPK激活剂。目前市场上某些治疗NAFLD的药物均为AMPK激活剂,如胰岛素增敏剂二甲双胍,降低血脂的贝特类、他汀类药物[9],但二甲双胍会引起维生素缺乏、肠胃问题、乳酸中毒等副作用[10],贝特类、他汀类有引起肌病和加重肝损伤等副作用[11]。因此,寻找新型AMPK激活剂具有重要意义。根据所查资料,大黄素可作为AMPK信号分子的激动剂使用[12],在一定程度上可对AMPK下游相关转录因子进行调节,并经以上3种途径减轻NAFLD及NASH。笔者认为AMPK信号传导分子可能作为主要靶点蛋白参与大黄素对NAFLD的治疗,而大黄素可作为非酒精性脂肪肝、肝脏炎症、肝脏纤维化的潜在开发治疗药物。综述就近年来大黄素通过激活AMPK信号分子发挥肝脏保护作用方面研究进展进行系统的归纳整理,以期为NAFLD的研究治疗及大黄素的开发利用提供一定的参考价值。
1 大黄素通过AMPK减少肝脏脂质蓄积
1.1 减少脂质的合成
固醇调节元件结合蛋白1c(SREBP1c)作为AMPK信号分子的下游蛋白[13],直接参与调控有关脂肪酸、甘油三酯(TG)合成和葡萄糖代谢相关酶基因的表达[14]。SREBP1c过表达会导致肝脏脂质蓄积,进而发展为脂肪肝。AMPK通过磷酸化SREBP-1c丝氨酸(Ser)372位点而调节其活性,活化的AMPK可抑制SREBP-1c的入核[15],因此,AMPK/SREBP1通路可改善肝脏脂质紊乱,发挥其降低肝脂的作用。AMPK调节SREBP-1c治疗NAFLD主要经过2条途径:一是通过AMPK-肝X受体α(LXR)-SREBP1途径,AMPK激活可抑制LXR配体的产生并阻断机体对SREBP-1c的加工,从而抑制肝脏TG的合成[16]。二是通过AMPK-哺乳动物雷帕霉素靶蛋白(mTOR)-SREBP1自噬途径,当肝脏中有脂质沉积时,自噬作用受到抑制,降脂能力减弱,导致肝脏脂质沉积进一步加重,诱发NAFLD[17]。研究发现细胞可以通过AMPK/mTOR信号通路对生长因子、营养素水平、应激以及胞内能量状态等信息进行整合,参与细胞自噬活性的调节[18],从而调节SREBP1的表达。有研究称,mTOR抑制剂雷帕霉素能够阻止肝细胞中胰岛素对SREBPl-c表达的诱导[19]。
大黄素可上调AMPK抑制SREBP-1c及其下游脂肪酸合成相关蛋白的表达,减少肝脏脂质生成和蓄积,并产生抗氧化应激损伤的作用,从而对肝细胞具有一定的保护作用,发挥对NAFLD早期病变的作用[20]。大黄素作为磷脂酰肌醇3-激酶/蛋白激酶B/mTOR(PI3K/Akt/mTOR)信号转导通路活化分子,是磷酸化(p)-Akt和p-mTOR的抑制剂[21],抑制作用可能由AMPK介导。据文献报道,大黄素是通过钙离子/钙调蛋白依赖性蛋白激酶激酶(CaMKK)激活AMPK并抑制mTOR介导的SREBP1活化,从而阻止HepG2细胞脂肪变性[22]。而激活AMPK/mTOR信号通路还可抑制白细胞介素-17/白细胞介素-23(IL-17/IL-23)调控轴介导的炎症反应,防止NAFLD往NASH方向发展[23]。大黄素通过AMPK/mTOR/SREBP-1c减少肝脏脂质合成这种途径多发生在已有肝脏脂质沉积的状态。
糖异生会导致血糖升高,高血糖可刺激胰岛素分泌增加,促进肝脏合成大量的TG和极低密度脂蛋白,引起血中TG升高,使其在肝内聚积,形成脂肪肝[24]。因此糖异生也是引起肝脏脂质蓄积的重要因素之一。已有报道证实大黄素通过抑制肝细胞中关键的糖异生基因表达来抑制葡萄糖的产生[25]。如CAAT/增强子结合蛋白α(C/EBPα)和葡萄糖转运蛋白4(GLUT4)。C/EBPα是脂肪细胞中调控脂肪细胞分化的关键转录分子,与肝脏脂质合成密切相关,AMPK可通过磷酸烯醇式丙酮酸羧激酶(PEPCK)抑制C/EBP转录因子表达,参与由内质网应激引起的肝脏糖异生[26]。GLUT4是葡萄糖转运至细胞内的重要膜蛋白,AMPK的激活同样能增强葡萄糖的转运,并使GLUT4从细胞内转移至膜上,从而增加葡萄糖的摄取能力,并调节细胞因子GLUT4表达水平,可作为其对糖代谢调节的重要依据[27]。
大黄素可通过抑制C/EBPα的表达调节前体脂肪的分化[28]。有研究分析得出,大黄素激活AMPK直接影响GLUT4的转位,从而促进细胞对葡萄糖的吸收[29],影响糖异生过程[30],减少TG的产生和肝脏脂肪的合成。
1.2 促进脂肪酸氧化
当脂肪组织中的TG水解为游离脂肪酸,过多的脂肪酸进入肝脏尤其伴有肝内脂肪酸氧化代谢障碍时,会造成脂质以TG的形式沉积于肝细胞内,容易发生或加重脂肪肝[31],因此,加强脂肪酸的氧化对NAFLD的治疗有很大的意义。AMPK作为体内一种重要的代谢蛋白激酶,已被证实可通过脂肪酸氧化调节能量代谢。AMPK调控脂肪酸氧化可通过AMPK-过氧化物酶体增殖物激活受体α(PPARα)/限速酶肉碱棕榈酰转移酶(CPT-1α)途径,PPARα是与肝脏脂质氧化相关的核转录因子,上调的PPARα可调控肝脏细胞内脂肪酸氧化过程中的CPT-1α及过氧化物酶酰基辅酶A氧化酶1(ACOX1)的蛋白及基因表达,而上调的CPT-1α可控制进入线粒体进行β-氧化的长链脂肪酸的转运[32],从而调控肝脏脂肪酸的氧化。
有文献表示大黄素可以促进AMPK激活增加脂肪酸氧化代谢来改善胰岛素抵抗的脂质沉积[33],大黄素通过AMPK调控的脂肪酸代谢途径主要是通过AMPK的激活上调脂联素受体2及PPARα蛋白及基因的表达。
2 大黄素通过AMPK对线粒体功能的改善
氧化应激与脂质过氧化是NAFLD受到第2次打击进一步发展的重要因素,线粒体功能的损伤是导致氧化应激的主要因素。线粒体发生功能障碍时,细胞活力下降、线粒体细胞色素C释放及细胞凋亡率增加、细胞内活性氧产生和游离钙离子浓度增加[34],导致氧化应激的产生。而氧化应激又会进一步损伤线粒体功能[35]。脂肪酸氧化可减少活性氧(ROS)的产生,PPARα和CPT-1α作为脂肪酸氧化的主要受体,在调节线粒体的氧化应激方面起着重要作用;解偶联蛋白2(UCP2)位于线粒体内膜上,具有消散线粒体内模的质子梯度调节线粒体功能,现代研究表明UCP2与代谢类疾病相关[36]。AMPK与线粒体功能的调节息息相关,激活AMPK不仅可以刺激线粒体的再生,还可促进衰老线粒体进入自噬状态,维持细胞内线粒体数量的平衡[37]。AMPK可增加降糖引起的细胞内钙离子升高幅度[38],还可通过AMPK-PPARα/CPT-1α途径改善线粒体β-氧化和AMPK-UCP2途径调整线粒体内膜电位,ATP合成,呼吸链ROS产生、线粒体钙库的存储和释放等[39]。
大黄素可使细胞内钙增高后促进琥珀酸脱氢酶、单氨氧化酶等酶促反应,使线粒体等肝细胞微观结构功能得以改善,恢复其功能[40]。大黄素还可上调PPARα,CPT-1α和UCP2的表达[41],促进线粒体呼吸,改善线粒体β-氧化,增加脂质氧化,抑制ROS和过氧化脂质(LPO)的生成,从而影响脂质代谢,对肝脏产生一定的保护作用。
3 大黄素通过AMPK改善IR
目前认为,胰岛素抵抗(IR)为NAFLD的首次打击,IR在NAFLD的发病过程中扮演着重要的角色。但是IR与NAFLD的关系,尚不完全清楚。IR几乎贯穿了NAFLD的整个过程,AMPK可通过上述的肝脏脂质合成,脂肪酸氧化,GLUT4转运[42],线粒体功能修复等改善IR。但是,很多研究表明,脂肪细胞因子分泌或脂肪细胞特异基因表达的调节,被认为是改善胰岛素敏感性最重要的方法之一,而脂联素作为脂肪细胞分泌的细胞因子,可刺激脂肪酸氧化并抑制脂质的合成,具有调节肝脏细胞脂质代谢的作用,被认为是脂肪细胞因子中与胰岛素抵抗关系最紧密的一个特异性细胞因子,在IR相关疾病的发病过程中,脂联素所起的重要作用已得到证实[43]。因此,脂联素作为主要因素参与了IR的发生。当脂联素与脂联素受体结合后,可增强胰岛素的敏感性。脂联素可通过激活AMPK作用PI3K,从而增强脂肪细胞的胰岛素信号转导[44],还可激活肝脏AMPK抑制PEPCK的表达,从而抑制肝糖生成[45],而激活AMPK又可促进脂联素高聚体的组装[46]。因此,脂联素与AMPK的调控具有双向性,在NAFLD的治疗中有着重大意义和研究价值。
大黄素有降低餐后血糖、改善糖耐量的作用,作用近似二甲双胍,其机制可能与大黄素具有提高胰岛素敏感性有关[47],大黄素作为AMPK活化剂和过氧物酶体增殖体激活受体γ(PPARγ)激动剂,具有增加胰岛素受体2的表达的功能,对脂联素的调控主要由AMPK和PPARγ的激活影响[48]。有报道称,大黄素还可通过脂联素受体(AdipoR),PPARγ和PEPCK在一定程度上治疗肝脏IR,AdipoR2,PPARγ,PEPCK是IR重要的致病因素[49],三者与脂联素有关,Adipor2是脂联素信号级联中的关键组分[50];PPARγ是脂联素的配体[51],且PPARγ激动剂噻唑烷二酮类已被临床上用作胰岛素增敏剂;PEPCK是脂联素下游调控基因[52]。由此可见,脂联素与AMPK的相互调节参与了大黄素对IR的改善,这种改善作用影响着NAFLD的发生发展。
4 其他
NAFLD包括单纯性脂肪肝以及由其演变的NASH和肝硬化[53]。单纯性脂肪肝在体内经IR,氧化应激等造成的“二次打击”后,会发展为NASH这一必要阶段。基于AMPK信号分子研究大黄素对NAFLD炎性反应病理的治疗机制还未见报道。目前,与NASH发展最主要的相关通路有核转录因子-κB(NF-κB)信号转导通路,NF-κB作为一种重要的前炎症基因的转录调控子,NF-κB活化后,启动炎症因子的基因转录,通过调控炎症因子和抗炎因子表达增加或减少来影响肝脏炎症反应的损伤修复,参与肝脏炎症等病理生理过程,在肝组织的炎性反应、氧化应激、肝细胞凋亡和再生中发挥着重要作用。NF-κB亚基不是AMPK的直接磷酸化靶标,但其信号传导的抑制由AMPK的下游靶标介导[54]。Toll样受体4(TLR4)可抑制下游髓样分化因子88(MyD88),分裂原激活的蛋白激酶(MAPK)及NF-κB的合成及活化,从而抑制炎症的产生、缓解肝脏的损伤[55],是肝脏脂肪沉积和NASH进展的必要条件[56]。有研究表示,AMPK活化可通过下调TLR4/MAPK/NF-κB信号传导途径发挥抗炎作用[57]。
大黄素在很多研究中被报道可以通过NF-κB途径和TLR4途径治疗NAFLD炎性反应。大黄素可能通过治疗肠道菌群失衡和抑制免疫和炎症反应的主要调节因子NF-κB的激活,下调肝脏白细胞介素-1(IL-1),肿瘤坏死因子-α(TNF-α)的表达,从而改善NASH的炎症病变程度[58]。现代研究显示肠道菌群失调在NAFLD发病机制中起着重要作用[59],大黄素抑制TLR4信号有效抑制肝脏脂质沉积与平衡肠道菌群[60],降低肠源性内毒素血症作用有关[61]。此外,大黄素还可通过抑制细胞外信号调节激酶(ERK)1/2和p38信号通路抑制细菌脂多糖(LPS)诱导的巨噬细胞中促炎细胞因子的表达[62]。
虽然AMPK信号分子对上述的NF-κB和TLR4有调控作用(图1),但是关于大黄素介导AMPK发挥对肝脏炎症相关信号通路的研究并未见报道,值得深入探讨。
5 讨论
从上述研究结果中可以看出,NAFLD发病机制错综复杂,众多的致病因素产生的生物效应又互为因果关系,形成恶性循环,一步步加重NAFLD的发展,而激活AMPK对大部分的致病因素均有一定的影响,可见AMPK信号分子对NAFLD的治疗意义重大。大黄素作为AMPK的激活剂,实验室前期用计算机分子模拟方法研究了大黄素与AMPK通路潜在相关靶点蛋白的对接,发现AMPK,CPT-1,SREBP-1,ADPN等靶蛋白与大黄素均有较好的结合,从分子层面阐述了大黄素作用AMPK及其相关蛋白治疗NAFLD的物质基础。
AMPK与体内多种代谢途径密切相关,参与许多代谢紊乱引起的疾病,如NAFLD,糖尿病,高血脂。大黄素治疗肝脏脂质沉积及脂质变性主要通过AMPK信号通路激活作用相关因子发挥降低脂质沉积、减少脂肪酸氧化、恢复线粒体功能、改善IR和抑制炎症通路的活化,防止NAFLD往NASH方向发展。且鉴于大黄素对代谢性疾病有着较好的调节作用,因此,可将大黄素作为一种新型的AMPK激动剂投入相关临床药物的研发。
目前普遍认为IR是NAFLD的主要发病机制,NAFLD患者脂联素的表达减少。通过很多研究结果发现脂联素是AMPK通路中一个很重要的角色,脂联素是脂肪组织产生的抗炎细胞因子,可以增强胰岛素的敏感性,脂联素降低与胰岛素敏感性下降相平行,与IR呈负相关[63]。脂联素或通过与脂联素受体结合介导脂联素发挥对胰岛素增敏的作用。大黄素不仅可以激活AMPK增加脂联素的表达[64],还可以增加脂联素受体的表达,脂联素表达的增加又会激活AMPK[65],从而提高胰岛素的敏感性[66]。脂联素发挥生物学调节功能的主要途径就是AMPK信号传导通路[67]。大黄素激活AMPK后,激活的AMPK调控的脂联素可使AMPKα的磷酸化和酶活性表现出上升趋势,从而激活AMPKα下游的PPARα,SREBP-1c和ChREBP和他们靶基因,增强肝细胞脂氧化作用,抑制脂肪酸合成和转运,降低TG和极低密度脂蛋白(VLDL)水平,减少肝脂聚积[68],并改善线粒体β氧化,修复线粒体功能,减少活性氧及自由基的产生,从而发挥一系列对IR的改善及对NAFLD往NASH发展的抑制的作用。由此可见,脂联素参与了以大黄素为物质基础通过AMPK信号通路治疗NAFLD的以上所有途径。根据前期分子对接得出的结论,大黄素很有可能是通过两种途径改善IR,一是直接作用于脂联素引起其增强胰岛素的敏感性,这与洪海棉等[69]的实验结果一致;二是大黄素可能通过激活AMPK影响糖脂代谢,产生的生物效应间接增加胰岛素敏感性,脂联素的表达的增加又可促进糖脂代谢。有研究表示脂联素受体的表达与生长激素,胰岛素,PPARα,PPARγ和肝X受体激动剂有关[70]。大黄素对脂联素受体表达促进的机制可能与AMPK和PPARγ有关,但是,关于脂联素受体的存在只是协助脂联素发挥治疗NAFLD的作用,还是像脂联素一样与AMPK信号分子有着复杂的相互关联还未见报道,具体机制可待进一步的研究。
综上所述,大黄素治疗NAFLD主要是通过激活AMPK信号分子和增强脂联素及其受体的表达,并协同增强调节一系列相关因子的转录,达到保肝的作用。

