非酒精性脂肪性肝病(NAFLD)是指明确排除了酒精和其他可能导致肝细胞损伤因素,主要以弥漫性的肝细胞大泡样脂肪变性为主要病理特征的一组遗传-环境-代谢相关性临床综合征。主要包括单纯性脂肪性肝病、非酒精性脂肪性肝炎和非酒精性脂肪肝性肝硬化。随着成人和儿童肥胖流行的上升,NAFLD已经成为肝病的主要病种(患病率约20%~34%)[1-2],目前NAFLD发病机制尚未明确,一直以来缺乏有效的药物治疗。现代循证医学证实,通过传统中医药治疗能有效地延缓NAFLD进展[3]。中药可能通过多靶点、多途径的整合作用发挥终末防治效应[4]。参苓白术散出自北宋《太平惠民和剂局方》,具有健脾益气,渗湿止泄的功效,是临床常用的古代经典健脾名方。中医认为脾虚失运,津液输布失常,水湿内停,肥甘厚腻、食积膏脂不化,肝气郁滞,湿浊痰积瘀血互结,痹阻肝络而成本病[5],可见,脾虚失运是NAFLD发病的关键病机之一。Meta分析表明[6],参苓白术散治疗NAFLD存在其独有的优势。前期研究发现参苓白术散具有显著的降低血脂,缓解肝脏炎症,防治脂肪肝疗效确切[7-8]。哺乳动物雷帕霉素靶蛋白(mTOR)可以调节细胞内的蛋白质合成并影响细胞凋亡细胞的生长和增殖[9-10]。细胞信号转导因子及转录激活因子3(STAT3)是双功能蛋白,主要存在于细胞质中,其再偶联酪氨酸磷酸化信号通道方面起重要作用,与调节多种蛋白质的表达、细胞增殖和凋亡有关[11]。本实验旨在前期研究的基础上,运用方药参苓白术散干预mTORC1/STAT3信号通路介导的炎症通路,从细胞水平探讨参苓白术散防治NAFLD的有效作用靶点,为中医药防治NAFLD提供实验依据。
1 材料
1.1 动物
健康成年雄性SPF级SD大鼠80只,体质量(200±20) g,周龄8周,由山东省济南市朋悦实验动物繁育有限公司提供,实验动物合格证号SCXK(鲁)2014-0007,合格证编号37009200012268。饲养于广东暨南大学动物实验管理中心,实验动物使用许可证号SYXK(粤)2017-0174。
1.2 药物
参苓白术散方药(人参15 g,白术15 g,山药15 g,白扁豆12 g,薏苡仁9 g,茯苓15 g,桔梗6 g,砂仁6 g,莲子9 g,炙甘草9 g)。中药均为配方颗粒剂,由深圳华润三九医药股份有限公司生产,批号20180125,购自广州暨南大学附属华侨医院,方药组成、剂量均参照第6版《方剂学》[12]教材。按免煎中药包装说明(山药1袋相当于山药饮片10 g),换算成1剂参苓白术散饮片的实际剂量,溶于水,调匀制成混悬液备用。
1.3 试剂
大鼠白细胞介素(IL)-1β,IL-5,IL-6和肿瘤坏死因子(TNF)-α酶联免疫吸附测定(ELISA)试剂盒(上海依科赛生物制品有限公司,批号分别为ER008-96,ER005-96,ER003-96,ER006-96);甘油醛-3-磷酸脱氢酶(GAPDH)抗体,辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白(Ig)G(美国Abbkine公司,批号分别为A21020,A01020);苏木素-伊红(HE)染色剂,油红O染液(苏州泽科生物科技有限公司,批号ZKP-E151004-1,ZKP-E150043);实时荧光定量聚合酶链式反应(Real-time PCR)试剂盒(日本Takara公司,批号RR047A);兔抗大鼠Lysozyme,Ⅳ型胶原酶,mTORC1,STAT3抗体(美国Thermo Fisher公司,批号分别为MA5-32154,17104-019,PA1-188,44-384G);血脂、肝功试剂盒(北京索莱宝科技有限公司,批号均为SA9697)。
1.4 仪器
Chemray240型全自动生化分析仪(深圳雷杜生命科技公司);Multiskan FC型酶标仪(美国Thermo Fisher公司);ELITE ESP型流式细胞检测仪(美国Beckman-Coulter公司);IQ5型Real-time PCR仪,Mini-PROTEAN型电泳仪,Trans-Blot Turbo型转膜仪(美国Bio-Rad公司)。
2 方法
2.1 动物分组及处理
大鼠随机分成正常组,模型组,参苓白术散低、高剂量组(10,30 g·kg-1),每组各20只。大鼠NAFLD模型的建立参照张玉佩等[5]的方法。正常组大鼠喂饲基础饲料,模型组、参苓白术散低、高剂量组喂饲高脂饲料。高脂饲料由基础饲料-胆固醇-精制猪油-Ⅲ号胆盐按照88∶1.5∶10∶0.5比例制成。各组动物自由饮水进食,给药剂量按人和动物体表面积折算[13]。按10 mL·kg-1标准,各组大鼠灌服相应剂量的中药制剂或实验动物饮用水,每日1次,分笼饲养于18~22 ℃明暗各12 h的SPF级动物实验室内,连续8周。前期研究中确立了疏肝方(柴胡疏肝散),健脾方(参苓白术散),疏肝健脾方(柴胡疏肝散合参苓白术散)的灌服剂量[5,11]。低剂量药物组为人临床等效剂量,高剂量药物组为的3倍人临床等效剂量。实验的第8周结束后,各组随机选出大鼠10只取血及肝组织备用,余下每组10只用以提取原代肝细胞。
2.2 肝细胞的分离及鉴定
采用Ⅳ型胶原酶离体循环灌注法分离肝细胞。在前期已经掌握了肝细胞的分离提取、鉴定方法,提取的肝细胞纯度达到90%以上,完全满足相关实验要求[7-8]。
2.3 检测方法
2.3.1 肝组织病理学观察
随机选取10只大鼠,肝组织经冰冻切片,厚约6~8 μm,行油红O染色,甘油封片,光镜下观察肝细胞内脂滴分布。另经甲醛固定、常规石蜡包埋,作4~6 μm切片,行HE染色,树脂封固,光镜下观察大鼠肝组织脂肪变性程度。
2.3.2 血脂、肝功及炎症因子检测
全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT),天门冬氨酸氨基转移酶(AST),总胆固醇(TC),甘油三酯(TG),高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)含量变化。ELISA试剂盒检测肝细胞TNF-α,IL-1β,IL-5,IL-6含量变化。
2.3.3 Real-time PCR检测肝细胞mTORC1,STAT3 mRNA相对表达量
取培养的贴壁肝细胞经4 ℃,5 000 r·min-1离心10 min。弃去上清后,加入trizol裂解液1 mL待其充分裂解,经分相、沉淀、洗涤、溶解,吸取RNA样品0.1 μL经微量核酸分光光度计测定RNA浓度值。然后经逆转录反应。引物序列由上海捷瑞生物工程有限公司设计及合成,选用GAPDH为内参基因。mTORC1上游5′-CAGAGG GCAGCAACAGTGAAAG-3′,下游5′-GACAAGGAG ATAGAACGGAAGAAGC-3′,片段长度134 bp;STAT3上游5′-ACCAGCAGTATAGCCGCT TC-3′,下游5′-GCCACAATCCGGGCAATCT-3′,片段长度97 bp;GAPDH上游5′-GATCCCGCTAACATC AAATG-3′,下游5′-GAGGGAGTTGTCATATTTCTC-3′,片段长度96 bp。依照说明书在冰台上配置20 μL反应液,反应条件为95 ℃持续30 s预变性;95 ℃持续5 s变性;mTORC1,STAT3,GAPDH 60 ℃退火20 s;60 ℃延伸45 s,扩增40个循环;再于72~95 ℃,持续10 s,分析溶解曲线。用Opticon Monitor 3.1软件整理和分析。设定正常组mRNA表达水平为1。
2.3.4 蛋白免疫印迹法(Western blot)检测肝细胞mTORC1,STAT3蛋白的表达
按细胞计数板计数5×106个细胞含1 mmol·L-1 PMSF的RIPA裂解液,待充分裂解后,4 ℃,12 000 r·min-1离心5 min,收集细胞上清液,BCA测定样品蛋白浓度,调整上样量终质量至40~60 μg。100 ℃沸水浴加热5 min,使蛋白充分变性,冷却到室温,进行电泳及转膜。将蛋白条带转移至PVDF膜上,用含5%脱脂奶粉封闭PVDF膜,室温下摇床封闭60 min。洗涤3次,每次5 min,加入配制好的一抗稀释液(GAPDH 1∶2 000;mTORC1 1∶5 000,STAT3 1∶1 000),充分覆盖膜后孵育过夜,洗膜后,加二抗稀释液(1∶6 000)室温孵育60 min。再洗膜后加入适量的发光工作液,暗箱中曝光、显色成像,测定灰度值,准备统计分析。
2.4 统计学处理
采用SPSS 20.0进行统计学处理,计量资料以
3 结果
3.1 对NAFLD大鼠基本情况的影响
正常组大鼠性格温顺,皮毛润泽,饮食、饮水、大小便正常,笼内垫料较干燥,对外界刺激反应迅捷。模型组大鼠易激惹咬噬,皮毛枯黄发暗,形体臃肿,饮水量大,大便油腻稀软,垫料潮湿,对外界刺激反应较迟钝。各药物干预组大鼠基本情况介于正常组和模型组大鼠之间。
3.2 对NAFLD大鼠肝组织病理学的影响
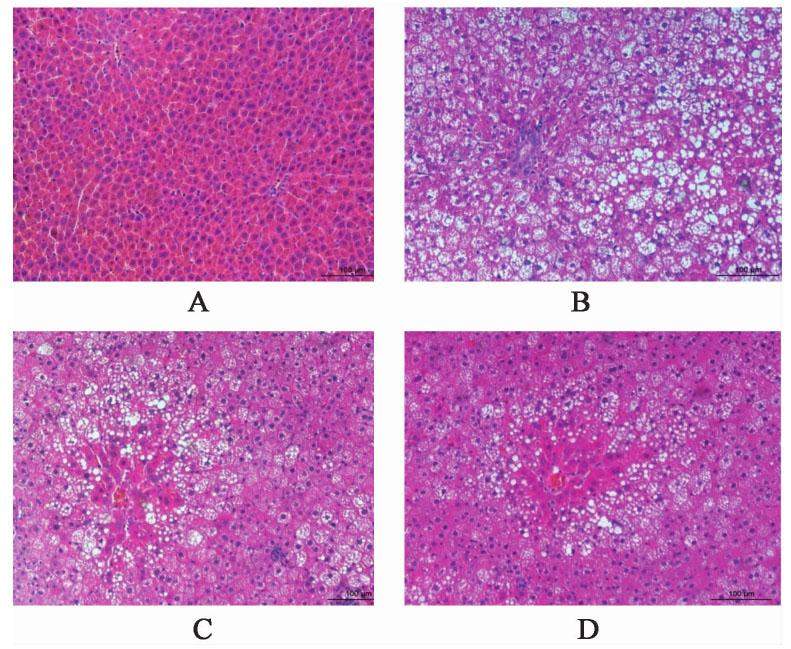
3.2.1 HE染色
正常组大鼠肝小叶界限清晰,肝窦形态正常,肝索呈放射状排列(以中央静脉为轴心),肝细胞质均匀红染,无空泡。模型组大鼠肝小叶边界欠清,肝索结构紊乱,汇管区炎症细胞浸润,肝细胞胞内可见大小不等的空泡,部分细胞呈气球样变。各药物干预组大鼠肝组织病理学改变较模型组有不同程度的改善,其中参苓白术散高剂量组大鼠肝组织结构最接近于正常组。见图1。
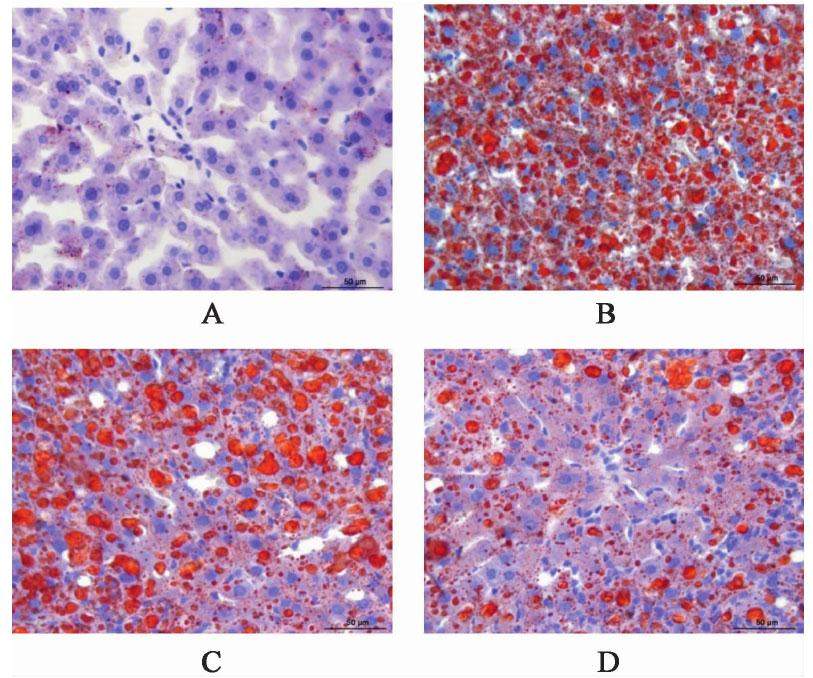
3.2.2 油红O染色
正常组大鼠肝细胞核均为淡蓝色,仅少许胞浆内分布散在的较小的红染脂滴。模型组大鼠肝细胞形态肿胀肥大,细胞核多居于胞内边缘,胞浆内可见大团状的红色脂滴,甚至有部分胞内脂滴融合成大脂滴。各药物干预组大鼠肝细胞脂滴红染面积及程度较模型组明显缩小和减轻,其中参苓白术散高剂量组大鼠肝组织脂滴含量最接近于正常组。见图2。
3.2.3 对NAFLD大鼠血清TC,TG,HDL-C,LDL-C,AST,ALT水平的影响
与正常组比较,模型组血脂TC,TG,HDL-C,DL-C水平显著升高,肝功能AST,ALT水平显著升高(P<0.01)。与模型组比较,各药物干预组血脂、肝功能均有不同程度降低(P<0.05,P<0.01),其中高剂量组较为明显,与低剂量组比较有统计学差异(P<0.05,P<0.01)。见表1,表2。
| 组别 | 剂量/g·kg-1 | ALT | AST |
|---|---|---|---|
| 正常 | - | 27.55±6.90 | 80.91±13.05 |
| 模型 | - | 90.44±15.931) | 233.81±29.801) |
| 参苓白术散 | 10 | 68.33±13.582) | 153.14±23.812) |
| 30 | 50.36±11.182,3) | 102.14±13.862,3) |
| 组别 | 剂量/g·kg-1 | TC | TG | HDL-C | LDL-C |
|---|---|---|---|---|---|
| 正常 | - | 2.06±0.30 | 0.73±0.11 | 1.21±0.21 | 1.14±0.13 |
| 模型 | - | 4.50±0.601) | 1.21±0.161) | 0.68±0.261) | 1.80±0.251) |
| 参苓白术散 | 10 | 3.53±0.942) | 1.07±0.102) | 0.95±0.192) | 1.41±0.222) |
| 30 | 2.48±0.842,4) | 0.96±0.132,4) | 1.13±0.184) | 1.27±0.183) |
3.2.4 对NAFLD大鼠肝细胞TNF-α,IL-1β,IL-5,IL-6含量影响
与正常组比较,模型组大鼠肝细胞TNF-α,IL-1β,IL-5及IL-6含量显著升高(P<0.01);与模型组比较,参苓白术散高、低剂量组大鼠肝细胞TNF-α,IL-1β,IL-5及IL-6含量明显下降(P<0.05,P<0.01);与参苓白术散低剂量组比较,高剂量组大鼠肝细胞TNF-α,IL-1β,IL-5及IL-6含量明显下降(P<0.05)。见表3。
| 组别 | 剂量/g·kg-1 | TNF-α | IL-1β | IL-5 | IL-6 |
|---|---|---|---|---|---|
| 正常 | - | 106.11±16.87 | 99.45±20.66 | 79.04±9.20 | 88.92±10.93 |
| 模型 | - | 427.89±30.141) | 180.06±15.131) | 230.27±16.631) | 112.47±24.761) |
| 参苓白术散 | 10 | 350.35±22.213) | 168.35±20.022) | 142.59±28.343) | 100.58±8.293) |
| 30 | 181.68±14.093,4) | 152.69±23.112,4) | 131.22±14.613,4) | 94.36±8.413,4) |
3.2.5 对NAFLD大鼠肝细胞mTORC1,STAT3 mRNA及蛋白表达的影响
与正常组比较,模型组大鼠肝细胞mTORC1,STAT3 mRNA及蛋白表达水平显著上调(P<0.01);与模型组比较,参苓白术散低、高剂量组mTORC1,STAT3 mRNA及蛋白表达水平下调(P<0.05,P<0.01);与参苓白术散低剂量组比较,高剂量组mTORC1,STAT3 mRNA及蛋白表达明显降低(P<0.05,P<0.01)。见表4,表5,图3。
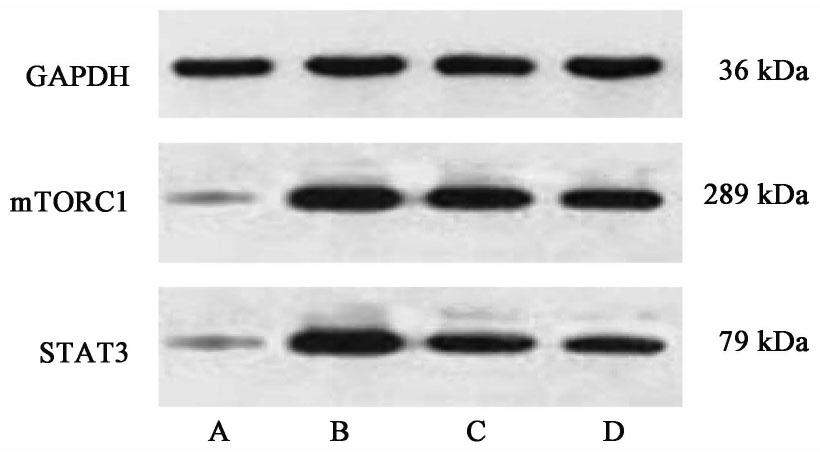
| 组别 | 剂量/g·kg-1 | mTORC1 | STAT3 |
|---|---|---|---|
| 正常 | - | 1.05±0.90 | 0.98±0.66 |
| 模型 | - | 7.44±1.171) | 5.44±1.021) |
| 参苓白术散 | 10 | 4.02±1.212) | 4.28±1.232) |
| 30 | 2.94±1.062,3) | 2.04±1.062,3) |
| 组别 | 剂量/g·kg-1 | mTORC1/GAPDH | STAT3/GAPDH |
|---|---|---|---|
| 正常 | - | 0.44±0.10 | 0.39±0.04 |
| 模型 | - | 1.32±0.151) | 1.16±0.081) |
| 参苓白术散 | 10 | 1.16±0.162) | 1.07±0.102) |
| 30 | 1.01±0.093,4) | 0.99±0.073,4) |
4 讨论
在中医古代文献中并没有关于NAFLD的记载。在《难经》中最早记载了“肝之积,名曰肥气”;《黄帝内经·素问·痹论》曰:“饮食自倍,肠胃乃伤。”根据其主要症状,临床上多将NAFLD归属于“肥气”“肝积”“胁痛”“痞满”等。2017年中华中医药学会脾胃病分会将NAFLD的中医病名规范为“肝癖”“积聚”“胁痛”,其病位在肝,与脾肾关系密切等,其病机以脾虚为主,以痰、湿、浊、瘀为主要病理因素[14],故在各个阶段的中医治疗中,绕不开治脾。张仲景《金匮要略·脏腑经络先后病脉证第一》曰:“夫治未病者,见肝之病,知肝传脾,当先实脾。”故运用参苓白术散防治NAFLD是“肝病治脾”理论的体现。现代研究表明,参苓白术散的健脾功效可能与修复肠道黏膜屏障,调节肠道菌群,减轻机体炎症反应,提高免疫功能有关[15-16],发挥多通路、多靶点作用,其机制可能与糖脂、能量代谢等密切相关[17]。
mTOR是一种非典型丝氨酸/苏氨酸蛋白激酶,分为mTORC1和mTORC2,目前研究多集中在研究mTORC1,mTORC2研究较少。mTORC1可以调节细胞合成及代谢过程,如蛋白质,核苷酸和脂质合成,同时抑制脂质等分解代谢[18-19]。当mTORC1通路阻断后,可减少由遗传和代谢紊乱,尤其是脂质代谢引起的机体紊乱[9]。STAT3主要存在于细胞质中,被Janus激酶家族成员磷酸化和激活后,促进脂质蓄积,并产生局灶性炎性微环境[11]。
研究发现,在NAFLD患者中,mTOR/STAT3及磷酸化产物等在肝脏脂肪变性组中比在对照组中表达更为频繁,mTOR在78%肝细胞中有表达,STAT3在73%的肝细胞和45%的肝星状细胞中存在表达,可见mTOR/STAT3的表达在肝脏脂肪变性患者中对疾病进展发挥了重要作用[20]。mTORC1可能通过信号转到蛋白GP130使STAT3和STAT1被独立激活诱导炎症的发生[21]。炎症程度加重时,mTOR和STAT3的活性及表达也随之升高[22]。mTORC1通路的激活与TNF-α和IL-6的表达有关。其机制可能是激活了核转录因子(NF)-κB和STAT3,激活的NF-κB上调TNF-α和IL-6表达,增强细胞增殖,促进STAT3蛋白表达[23],同时IL-1β,IL-5表达也能促进mTORC1蛋白表达[24-25]。以上表明,mTORC1/STAT3与炎症因子IL-1β,IL-5,IL-6,TNF-α关系密切。
由此可见,mTORC1/STATA信号通路是参与机体脂质代谢调节的关键环节,mTORC1/STAT3可能成为中医药有效防治NAFLD的药物作用靶点。本研究表明,采用高脂饲料喂养建立的NAFLD模型组大鼠血脂及炎症因子IL-1β,IL-5,IL-6,TNF-α水平较正常组大鼠显著升高;肝细胞mTORC1,STAT3 mRNA及蛋白表达较正常组显著上调。表明模型组大鼠肝脏存在较严重的脂质代谢紊乱和炎症反应。通过参苓白术散干预后,大鼠血脂及IL-1β,IL-5,IL-6,TNF-α水平降低明显,肝细胞mTORC1,STAT3 mRNA及蛋白表达亦有不同程度的下调,其中以参苓白术散高剂量组效果较为显著。以上提示mTORC1/STAT3信号通路是机体脂质代谢及炎症调控的关键靶点;参苓白术散可能通过抑制mTORC1/STAT3通路的激活,调节肝脏脂质代谢,减轻肝脏脂质蓄积和肝脏炎症反应,达到防治NAFLD的目的。此外,根据参苓白术散具有健脾益气的功效来推测NAFLD的中医辨证分型,NAFLD大鼠模型可能存在中医脾虚证的病机和证候特点,其有关详细机制仍值得进一步的研究和探讨。
参苓白术散加减治疗抗生素相关性腹泻脾胃虚寒证的临床观察
[J].中国实验方剂学杂志,2019,doi:10.13422/j.cnki.syfjx.20191835.
