痛风是由单钠尿酸盐(MSU)从过饱和的细胞液外析出,并沉积于关节及其周围关节囊、滑囊、软骨中,从而引起的炎性反应[1]。近年来,随着人民膳食结构的改变,蛋白质、糖、脂肪等摄入量明显增多,痛风的患病率逐渐升高,与年龄的增长呈现正相关,且呈现低龄化趋势。流行病学研究显示,已经有高达约3.9%的人群患有痛风[2]。每年男性痛风新发病率约为0.4%,女性约为0.14%[3]。其与其他代谢性疾病如高血压、糖尿病、血脂异常等疾病相伴,增加致死率[4]。影响痛风的因素主要有种族、年龄、性别、地区、环境因素、生活方式、疾病、职业和饮食等[5]。MSU晶体是痛风的关键诱导因素,其诱导的炎症是痛风的病理基础,固有免疫在痛风的发展中起着重要作用[6]。MSU结晶脱落进入关节腔,被巨噬细胞、中性粒细胞、滑膜细胞等多种免疫细胞以及炎症因子识别,激活细胞内信号传递,释放如白细胞介素(IL)-1β,IL-6及肿瘤坏死因子(TNF)-α等多种炎症介质,进而引起炎症级联反应[7]。从而导致滑膜血管扩张、通透性升高和白细胞渗出等病理反应,大量促炎因子及趋化因子释放,进一步加重炎症反应,出现关节红肿热痛等症状[8]。目前痛风的发病机制尚未明确,主要是认为尿酸升高、炎症反应参与其中,西医上针对痛风的病理机制展开的治疗方法多样,但因为存在较多的不良反应而限制了临床应用,中医学对痛风病认识较早,如“历节”“痹证”等,长时间的临床应用证明了其有效性及安全性[9]。现代研究发现,中医药在降尿酸、抗炎和改善关节功能及不良反应方面更具有优势[10-11]。因为中医药具有多靶点、安全性高的特点,所以从中药中寻找治疗痛风新药是具有前景的研究方向。本文试述近年痛风的发病机制及其治疗的研究进展。
1 痛风发病机制
1.1 病理机制
1.1.1 尿酸升高
痛风的最主要表现就是尿酸水平的升高,其中约10%是由于嘌呤代谢中嘌呤氧化酶活性增强或嘌呤利用障碍引起尿酸生成过多,在嘌呤代谢过程中,黄嘌呤氧化酶(XOD)催化次黄嘌呤转化为黄嘌呤,最终生成尿酸,所以XOD活性越高,尿酸生成越多[12]。而另外90%是由于肾小管尿酸盐转运蛋白功能异常导致尿酸排泄减少[13]。尿酸转运过程包括滤过-重吸收-分泌-分泌后重吸收4个步骤,通过尿酸盐转运蛋白之间的相互协调配合使尿酸的生成和排泄处于动态平衡中。因为尿酸能在肾小球全部滤过,所以转运蛋白只在肾小管重吸收和分泌过程中发挥作用,这也决定着尿酸排泄量的大小。研究发现,位于肾皮质近端小管上皮细胞管腔侧且特异性表达的尿酸盐转运蛋白1(URAT1)参与了尿酸在肾近端小管的重吸收过程[14]。葡萄糖转运蛋白9(GLUT9)是一种新型高性能尿酸转运体,主要存在肾脏和肝脏,是调节尿酸分泌的重要转运子。虽然大部分患者痛风发作时血尿酸水平显著升高,但是仍有一部分患者虽然临床症状典型,但血尿酸水平正常,甚至从不出现急性痛风性关节炎发作,说明痛风的发病还存在其他病理机制。
1.1.2 炎症反应
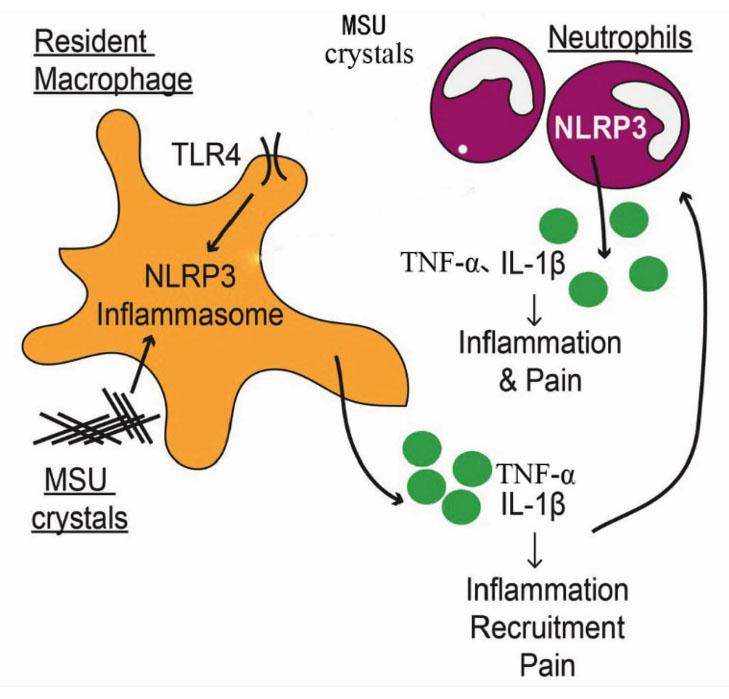
正常人体内尿酸盐沉积与溶解处于动态平衡,而痛风患者随着病程的迁延,当血清尿酸盐水平超过最大溶解度时,导致MSU晶体沉积在关节腔或软组织中。研究发现,MSU结晶能识别并与嗜中性白细胞碱性磷酸酶(NALP)炎症小体结合,促使单核巨噬细胞数量增多来吞噬MSU晶体,并破坏细胞的溶酶体等细胞器,释放出组胺、趋化因子等,引起局部血管扩张和白细胞聚集等炎症反应,产生并分泌IL-1β,TNF-α等炎症相关因子,引起促炎症因子和抗炎症因子表达失衡,激活环氧化酶-2(COX-2)合成前列素类,使炎症程度进一步加重,后期关节软骨遭到严重破坏[15-16]。前列腺素E2(PGE2)是参与关节周围组织和滑膜炎症病变的重要因子,MSU结晶的刺激可引起COX-2表达增加,促进PGE2合成增多而导致炎症进展[17]。IL-1是一种重要的前炎性细胞因子,IL-1β是其中主要的成员,作为调节炎症的一种始动因素,在MSU晶体通过多种途径刺激机体血液及关节液中的单核巨噬细胞使IL-1β大量释放之后,激活炎症趋化因子、细胞因子及血管内皮因子,导致白细胞聚集,之后白细胞吞噬MSU结晶,并分泌炎性因子,产生炎症反应,导致急性痛风性关节炎[18]。同时IL-1β在痛风的软骨破坏中同样扮演着重要角色[19]。而MSU晶体并不能直接促使巨噬细胞释放IL-1β,还需要NALP3炎性体的参与[20]。介导了尿酸钠晶体诱发的炎性反应,当MSU晶体被NALP3蛋白识别时,能促使IL-1β前体裂解成IL-1β,促进致炎细胞因子IL-1β分泌和成熟,激活炎症趋化因子、细胞因子等促进痛风病情进展[21]。TNF-α能诱导IL-1,趋化因子等炎性因子,激活中性粒细胞和淋巴细胞,诱发溶酶体及前列腺素释放,导致或加重炎症反应。此外,MSU晶体也可以直接刺激单核/巨噬细胞产生TNF-α,从而促发痛风炎性反应[22]。当炎性因子大量存在循环中,刺激全身的急性时相反应,患者会出现发热、白细胞升高等表现,同时,MSU晶体和炎性细胞因子又可延长中性粒细胞的生存期,导致炎症的持续[23]。
1.2 自发缓解机制
而痛风具有自限性,在未治疗的情况下,疾病也能在2周内自行缓解。研究发现在部分急性痛风性关节炎或无典型红肿热痛等关节炎症状的高尿酸血症患者的关节腔内也存在许多巨噬细胞,进而发现巨噬细胞的分化在痛风的自发缓解中具有一定作用,一方面,通过吞噬作为异物的MSU晶体,减少MSU对机体的刺激,促进痛风急性发作的自发缓解[24]。另一方面,分化成熟的巨噬细胞通过分泌抗炎性因子转化生长因子(TGF)-β1等,抑制炎性因子的表达而诱导炎症的自发缓解[25]。有研究发现,痛风患者关节液中TGF-β1浓度的上升先于白细胞,IL-6,IL-8,IL-10和TNF-α等指标的下降[26],也提出TGF-β1可能是通过限制炎症细胞浸润和促炎效应这两方面来控制痛风炎症[27]。除摄取MSU晶体外,其对凋亡中性粒细胞的清除,及组织原位巨噬细胞在炎症早期即表现的抑炎特征都是炎症终止作用机制[28]。
1.3 可能与痛风相关的信号通路和潜在靶点
痛风的发病机制除了上述描述的通路及靶点外,还需从痛风的炎症机制深入研究。研究表明,痛风的炎症机制是涉及补体激活、细胞激活以及与炎症反应相关的细胞内信号分子被激活等一系列组织有序的事件。尿酸晶体通过经典途径(即通过C1激活)激活补体,可能以两种方式发生,通过免疫球蛋白无关的C反应蛋白依赖途径激活经典途径以及通过特异性结合IgG抗体激活经典途径[29]。尿酸晶体诱导的补体激活级联放大后的结果是生成补体成分5a(C5a)及导致可溶性补体膜攻击复合物的产生,前者可产生强大的血管扩张作用和中性粒细胞等炎症细胞的趋化作用[30]。包被蛋白的尿酸盐晶体也可以通过激活免疫球蛋白、补体和其他细胞表面受体的能力来激活细胞。晶体激活细胞的方式仍是需要不断研究的课题方向。这些机制包括①通过Tollike受体(TLR)进行晶体识别[31]。②尿酸盐晶体与细胞膜胆固醇筏的相互作用。③直接吞噬作用。细胞膜(脂筏)富含胆固醇的区域具有信号分子密集的特点,是细胞激活的热点。在树突状细胞中,MSU与脂筏之间存在着受体无关的相互作用,直接导致了细胞的活化。这一效应背后的机制似乎与脂筏的氢键依赖性聚集有关;脂筏内跨膜受体的聚集导致免疫受体酪氨酸基激活基序的激活,随后信号分子酪氨酸激酶(Syk)的激活[32]。Syk激活可诱导细胞活化,包括磷脂酰肌醇3激酶(PI3K)信号、细胞骨架重排和晶体吞噬。尿酸盐晶体激活细胞后,许多与炎症反应相关的细胞内信号分子被激活。除Syk外,这些细胞内信号分子包括PI3K,细胞外调节蛋白激酶(ERK),C-Jun氨基末端激酶(JNK)和p38丝裂原活化蛋白(MAP)激酶,磷脂酶C和D,Rho家族蛋白,核转录因子-κB(NF-κB)等。根据所述细胞类型,这些分子的激活将导致特定表型的改变,包括细胞骨架的改变,细胞因子和脂质介质的产生,以及吞噬和超氧化物歧化酶的产生[33]。
2 治疗痛风的药物
2.1 西药
本病起病急,尿酸的产生和分泌的平衡决定了血清尿酸的水平,虽然存在疾病自限性机制,但是关节红肿热痛症状反复发作,关节受累可出现破坏、畸形,肾脏受累可合并痛风石、肾功能不全,高血压、脑动脉硬化等心血管疾病风险升高,逐渐出现全身多器官器质性病变,所以对于痛风的积极治疗是必要的[34]。而治疗的目标主要以防止急性痛风性关节炎症状的发生为目的。主要以纠正高尿酸血症,迅速终止痛风发作,防止复发以及防止尿酸结石的形成与肾功能的损害为治疗目的[35]。降尿酸目前认为清除关节腔内的MSU晶体最有效的方法为血尿酸的持续达标。使尿酸盐不再析出,已存在的MSU晶体逐步溶解[36]。2012年美国风湿病学会指南推荐,降尿酸治疗应控制血尿酸水平低于360 μmol·L-1,痛风石患者应低于300 μmol·L-1,并长期维持[37]。
2.1.1 抑制尿酸生成药物
黄嘌呤氧化酶(XOD)是一种氧化还原酶,机体内黄嘌呤氧化酶的活性大小直接调控着体内尿酸水平的高低[38]。别嘌醇是竞争性黄嘌呤氧化酶抑制剂,是一种非常有效的降尿酸药物。然而,别嘌醇不良反应也是不容忽视的,从轻度的皮疹到严重皮肤不良反应(剥脱性皮炎)。非布司他不是嘌呤类似物,并且仅抑制黄嘌呤氧化酶,而不抑制嘌呤和嘧啶代谢途径中的酶,轻度至中度肾衰竭的患者使用非布司他时不需要调整剂量。虽然非布司他安全性较高,但服用成本较高使得临床使用较为局限。
2.1.2 促进尿酸排泄药物
传统促进尿酸排泄药物的降尿酸作用主要通过抑制肾小管对尿酸的重吸收,增强各种参与尿酸排泄的转运体和蛋白的活性,从而使尿酸的排泄量增加。苯溴马隆就是通过抑制尿酸转运体1(URAT1)和GLUT9减少肾脏对尿酸重吸收,促进尿酸排泄而发挥作用[39]。该药在肾功能轻中度受损的患者中仍然有效。尽管具有高效性,但苯溴马隆由于肝功能异常和肝衰竭死亡等肝脏事件在大部分国家已不使用[40]。来辛奴拉是全球首个尿酸盐重吸收转运体抑制剂,其机制是通过抑制URAT1的活性,阻断近端肾小管对尿酸的重吸收,促进尿酸的排泄降低尿酸含量[41]。但是有肾功能障碍患者发生严重不良事件和肾脏不良事件的风险较高。乌地辛是一种嘌呤核苷磷酸化酶抑制剂,其不良反应为淋巴细胞亚群减少30%~70%,虽然没有其他明显不良反应的报告,但远期临床应用研究尚未完善[42]。曲尼司特抑制GLUT9介导的尿酸盐转运促进尿酸盐排泄,且其作用呈剂量依赖性[43]。另外研究发现,其还可抑制白细胞浸润和血浆外渗出,减少体内MSU诱导的炎症,具有与非甾体抗炎药的作用,但是此药物应用于痛风的治疗还需大量临床研究[44]。
2.1.3 抗炎药物
除了针对痛风的病理机制展开降尿酸治疗以外,还需要建立积极控制痛风炎症的治疗策略,COX-2能促进炎症中前列腺素类合成增加,研究发现尿酸钠结晶刺激使COX-2表达明显增加,促进PGE2合成增多,并与尿酸钠结晶浓度呈正相关[45]。目前主要应用于临床的有非甾体类抗炎药、激素、秋水仙碱等,但是服用药物过程中出现的皮疹、胃肠道出血风险、心肌梗死及过敏反应等副作用以及痛风患者并发的心肾、血管疾病都限制了西药的临床使用[46]。近年来生物制剂在痛风发作的治疗显现出一定疗效,如抗IL-1单抗,TNF-α抑制剂已在临床上逐步得到应用,但是相关的研究进展缓慢。对于一种临床不良反应少,能积极控制病情的药物需求日益增大,从天然药物中寻找新型抗痛风和高尿酸血症药物,加强对痛风疾病防治药物的研究近年来日益重要。
2.2 中药
《外台秘要》中有类似痛风症状的描述“其疾昼静而夜发,发即彻髓痠疼,乍歇。其病如虎之啮,故名曰白虎之病也。”现代中医学者将其归为痹病、历节、白虎、痛风范畴。
2.2.1 经典名方
痛风的病机内因是血分有热,外因是风湿寒等邪气侵袭,污浊凝滞而作痛。朱丹溪《格致余论·痛风论》曰:“彼痛风者,大率因血受热,已自沸腾,其后或涉冷水,或立湿地,或扇取凉,或卧当风,寒凉外搏,热血得寒,污浊凝涩,所以作痛,夜则痛甚,行于阴也。”其中以桂枝芍药知母汤、四妙散、白虎加桂枝汤最为常用或在此基础上加减而成的复方使用频率较高。桂枝芍药知母汤出自《金匮要略·中风历节病篇》,全方配伍严谨,寒热并用,燥中有制,散而有和,对风湿日久化热者,用之有相辅相成之妙。主治风寒湿痹日久,渐次化热伤阴之风湿历节,在临床上取得很好的疗效[47]。何力[48]用桂枝芍药知母加薏苡仁汤与对照组(秋水仙碱+洛索洛芬钠)比较,在降低血尿酸,红细胞沉降率,C反应蛋白(CRP)等方面具有一定优势。李建等[9]采用平胃散合桂枝芍药知母汤与别嘌醇组对照治疗慢性痛风性关节炎患者,观察6个月,治疗组痛风发作次数显著减少,并且降低尿酸水平和提高血尿酸达标率,减轻临床症状,并能减轻血清IL-1β,IL-8,IL-17和TNF-α水平等炎症因子反应,临床疗效优于单纯的西医治疗。胡阳广等[49]观察桂枝芍药知母汤对急性痛风性关节炎患者血浆炎症因子的影响,治疗组在秋水仙碱(对照组)基础上,予桂枝芍药知母汤加减,结果治疗组血浆IL-1,IL-6,TNF-α水平下降幅度较对照组更明显。四妙丸源自《丹溪心法》,由朱丹溪治疗湿热的二妙丸加牛膝、薏苡仁而成,共奏清热除湿、解毒通络、消肿止痛之效。黄飞等[50]采取加味四妙散内服合金黄膏外敷治疗与口服依托考昔片联合秋水仙碱片对比,中药组在改善关节活动功能,缓解压痛、肿胀及疼痛评分,以及降低CRP,红细胞沉降率(ESR),IL-8,血尿酸(BUA)水平方面,效果显著。徐洪等[51]研究发现,加味四妙散口服联合金黄散外敷治疗痛风性关节炎急性发作效果明显,疗效优于塞来昔布联合秋水仙碱治疗,且不良反应较少。袁晓等[52]研究发现,对照组予双氯芬酸钠缓释片口服,治疗组在西药组基础上联合加味四妙丸,两组均治疗3 d,治疗组CRP,UA水平及关节疼痛评分、关节红肿评分较对照组下降明显,提示加味四妙丸治疗痛风能抑制炎症反应,缓解关节肿痛症状,减少糖皮质激素使用。张会良等[53]发现加味四妙丸辅助双氯芬酸钠治疗急性痛风性关节炎具有显著的临床疗效,有利于改善患者的关节肿痛症状,同时降低血尿酸、红细胞沉降率,具有较好的安全性。白虎加桂枝汤是《金匮要略》中治疗热痹的经典方剂,多药配伍,谨守病机,共奏清热利湿、除痹止痛之效。苏利生等[54]采用美洛昔康口服治疗作为对照,治疗组给予白虎加桂枝汤合四妙散化裁治疗,能有效缓解湿热蕴结证急性痛风性关节炎的痛感,缩短病程,降低ESR,CRP水平,减少副作用。王锦霞[55]研究发现白虎汤加桂枝汤合四妙散方可有效缓解患处疼痛,消除肿胀,并提高患者的膝关节能力,进而改善患者全身性的不良症状,尤其是畏寒喜温、肢体萎软得到明显的改善。王挺挺等[56]运用白虎加桂枝汤合四妙丸对比别嘌呤醇片联合秋水仙碱片治疗,结果提示白虎加桂枝汤合四妙丸加味治疗急性痛风在降低血尿酸、血沉、血白细胞疗效显著,副作用小。
2.2.2 经验方
目前有很多现代经验方应用研究,戴跃龙等[57]观察痛风湿热蕴结证患者132例,以秋水仙碱片加碳酸氢钠片治疗作为对照组,发现治疗组加用中药透热转气组方治疗1周后,BUA,血沉,CRP,视觉模拟评分(VAS)评分明显优于对照组,且关节疼痛持续时间、红肿持续时间短于对照组,疗效显著。尹磊等[58]研究单纯口服中药对比西药治疗急性痛风性关节炎结果显示,中药治疗在控制疼痛、缓解关节肿胀、改善关节功能方面与秋水仙碱及非甾体类抗炎药(NSAIDs)疗效相当;在降低尿酸、血沉,减少不良反应,防止痛风复发及改善生活质量方面存在一定的优势。王士朋等[59]观察清热利湿法对40例急性痛风性关节炎患者血清炎症因子的影响,以依托考昔治疗为对照组,1周后治疗组UA,IL-1β,COX-2,TNF-α较对照组明显降低,关节红肿、疼痛、活动受限评分改善情况显著优于对照组。宁晓军等[60]观察温阳泄浊化湿中药治疗60例急性痛风性关节炎患者,以单纯口服双氯芬酸钠为对照组,发现中药治疗组可以使患者血清血沉,CRP,尿酸,IL-1β,TNF-α含量水平下降,且在调节UA,IL-1β,TNF-α等作用方面优于对照组。李娟娥等[61]运用循证医学的方法,纳入1 296例患者单纯口服中药治疗急性痛风性关节炎的随机对照研究,结果提示,单纯口服中药较西药对照组在改善急性痛风性关节炎方面存在一定优势,且安全性较好,疗效肯定。
2.2.3 基础研究中的中药方剂及成分
中药具有多成分,多靶点的特点,其药理机制十分复杂,近年来,中医药在基础研究方面也取得了较大进步,对中医药治疗该病的作用机制进行了大量的实验研究,发现中药成分、复方均能通过调控急性痛风性关节炎发病过程中的炎性细胞因子、炎性体及相关通路发挥治疗作用。
中药成分,在痛风中常用的药物为清热利湿药,频次较高的有车前草、萆薢、虎杖等,车前草具有清热利尿通淋的功效,研究发现,车前草乙醇提取物可抑制马肾脏Na+-K+-ATP酶活性,促进尿素与尿酸的排泄[62]。钱莺等[63]采用皮下注射氧嗪酸和灌胃次黄嘌呤建立大鼠高尿酸血症模型,发现给予车前草醇提物可显著降低模型大鼠血尿酸水平。曾金祥等[64]发现车前草提取物不仅能降低模型小鼠血尿酸水平,还能一定程度改善模型小鼠肾脏功能。粉萆薢具利湿祛浊、祛风除痹之功效,费洪荣等[65]通过腹腔注射尿酸钠混悬液制作高尿酸血症模型,以灌服苯溴马隆混悬液为对照,灌服粉萆薢水提物生药为治疗组,发现高剂量粉萆薢水提物能显著降低小鼠和大鼠血清尿酸含量,与苯溴马隆疗效相当。萆薢总皂苷可显著降低腺嘌呤加乙胺丁醇所致高尿酸血症大鼠的血清尿酸水平,对大鼠急性痛风性关节炎有明显的防治作用[66]。虎杖主要功效有祛风利湿、散瘀定痛,侯建平等[67-68]发现虎杖不同提取部位均能抑制氧嗪酸钾盐所致高尿酸血症小鼠血尿酸,抑制XOD的活性,可改善痛风性关节炎的病理改变。药理学研究表明虎杖其主要成分均有改善局部血液循环、抗氧自由基、减轻炎症渗出、促进局部对炎症渗出物的吸收、减轻局部炎症反应引起的黏连、促进受损组织的修复等作用,还具有良好的镇痛效应。苗药飞龙掌血提取物及所含的呋喃型香豆素、异戊烯基的简单香豆素、苯并菲类生物碱和呋喃喹啉类生物碱可降低痛风性关节炎大鼠外周血和滑膜组织中IL-1β,IL-6,TNF-α水平[69]。
经典名方,对于中药经方以及现代经验方的复方制剂也进行了大量研究,房树标等[70]研究桂枝芍药知母汤对尿酸钠致痛风性关节炎模型大鼠关节滑膜组织中炎性信号表达的影响,发现桂枝芍药知母汤治疗痛风性关节炎的作用机制可能与降低NLRP3,含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)表达,抑制IL-1β分化成熟及NF-κB活化,降低NLRP3炎性体信号通路炎性因子表达有关。李雅等[71]观察并分析桂枝芍药知母汤对尿酸钠诱导的急性痛风性关节炎大鼠促炎因子IL-6,TNF-α表达的影响,与秋水仙碱组比较,桂枝芍药知母汤组血清IL-6,TNF-α含量均降低。武士杰等[72]探讨桂枝芍药知母汤对急性痛风性关节大鼠抗炎作用机制,表明该方可降低大鼠血清中PGE2和白三烯的含量。肖碧跃等[73]探讨桂枝芍药知母汤对急性痛风性关节炎大鼠血清炎症因子IL-1,IL-4含量的影响,结果表明,该方能抑制急性痛风性关节炎大鼠促炎因子IL-1的表达,同时增加急性痛风性关节炎大鼠抗炎因子IL-4表达。王永辉等[74-75]以尿酸钠混悬液诱导大鼠巨噬细胞制备痛风性关节炎巨噬细胞模型,以桂枝芍药知母汤含药血清进行干预,在不加受体抑制剂的实验中,桂枝芍药知母汤各剂量组IL-1β,IL-6,IL-8,TNF-α含量显著降低,COX-2含量表达均明显低于模型组,而TGF-β1含量明显增高。王立祚[76]研究加味四妙散汤对急性痛风性关节炎大鼠炎性细胞因子及多靶点调节信号通路影响,发现加味四妙散汤可抑制急性痛风性关节炎大鼠关节液内IL-6,TNF-α及IL-1β含量,同时调节信号通路内组Caspase-1蛋白表达水平起到治疗作用,说明加味四妙散能对炎症细胞聚集起抑制作用,使趋化因子与炎症因子释放降低,同时抑制了炎症级联的放大效应。
经验方、复方制剂方面,肿节风具有祛风通络、活血化瘀、消肿散结之功效,钟舒红等[77]通过腹腔注射氧嗪酸钾人工复制小鼠急性高尿酸血症模型,发现复方肿节风颗粒显著地降低模型小鼠体内血清尿酸水平,抑制小鼠肝脏匀浆中XOD活性,效果不劣于别嘌醇。周敏等[78]以高蛋白、高钙饲料制备鸡高尿酸血症模型,研究痹清胶囊连续灌胃给药2周后,发现模型鸡的BUA显著下降,粪便尿酸排泄量增加,血清XOD活性降低,其降BUA机制可能是既抑制尿酸生成又促进尿酸排泄。张娴娴等[79]研究发现泄浊除痹方可能是通过下调URAT1基因的表达,抑制尿酸盐的重吸收而达到促进尿酸排泄的作用而有效降低模型小鼠血尿酸水平。施平[80]发现不论是急性高尿酸血症疾病的发生,以及复方虎杖胶囊治疗均对脾脏T淋巴细胞亚群无明显影响,猜测其抗痛风的机制可能与其抑制PGE2的合成有关。王红霞等[81]采用单尿酸钠晶体溶液注射大鼠右后侧膝关节制备急性痛风性关节炎(AGA)模型,发现泄浊解毒方能显著减轻大鼠膝关节肿胀,且以高剂量效果最佳,并且显著降低血清IL-1β,TNF-α含量。姚红等[82]以祛湿除痹中药与秋水仙碱对比治疗,发现祛湿除痹方各剂量组均能显著改善大鼠关节功能障碍,减少关节组织炎症细胞数,抑制炎症细胞因子IL-1β在关节组织内的表达,且中药高剂量组的疗效优于秋水仙碱。石尉宏等[83]采用尿酸钠膝关节进行痛风性关节炎造模,发现清热除痹方可抑制血清TNF-α,IL-1β炎性因子的表达,降低滑膜NALP3,Caspase-1,L-1β表达,明显降低和秋水仙碱组疗效相当,并于72 h药效达到最优水平,猜测清热除痹方可能是通过抑制NALP3炎性体的装配,进而降低IL-1β的表达,从而缓解大鼠关节局部炎症。朱亚菊等[84]采用踝关节腔注射尿酸钠混悬液建立急性痛风性关节炎大鼠模型,将SD大鼠随机分成秋水仙碱组、痛风宁组、模型组和正常组,每组18只,观察并检测各组各时间点关节液白细胞数、滑膜组织病理改变、关节液中炎症相关细胞因子IL-1β,TNF-α,PGE2及TGF-β1的含量。结果发现痛风宁能降低关节液白细胞数、改善病变关节滑膜组织的病理形态及降低IL-1β,TNF-α,PGE2含量,同时可升高TGF-β1含量,且在48h对各项指标的改善作用最明显。滕方舟等[85]采用踝关节局部注射尿酸钠混悬液建立急性痛风性关节炎模型,采用酶联免疫吸附测定法(ELISA)检测大鼠踝关节液IL-1β,TNF-α含量,蛋白免疫印迹法及实时荧光定量聚合酶链式反应检测滑膜组织NALP3炎性体相关蛋白与mRNA表达。结果显示,与秋水仙碱组比较,痛风宁组大鼠踝关节液IL-1β,TNF-α含量仍较高,但滑膜组织中NALP3,Caspase-1,ASC蛋白及mRNA表达均较低。痛风发病机制见图1。
3 问题与展望
痛风的病理机制复杂,不仅有高水平尿酸的参与,而且还存在一定程度的炎症反应,虽然其存在自限性,但在临床中因为关节症状的反复发作以及并发症的出现极大地影响了疾病的预后。西医在治疗痛风方面存在一定优势,但不可忽视其不良反应明显,而中医药在痛风方面因多靶点治疗、安全性高等优势突出,但是目前仍存在不足,如中药汤剂服用不便、不易存储,患者接受度及依从性差,而中成药弥补了这一不足,目前市场上可以替代西药治疗的中成药并不多,远远不能满足患者的需要。应该在中医理论的指导下,结合现代科学技术,加深药物作用机理的深入研究,扩大临床研究样本量,提升研究结果的可信度和客观性,对于研制出更多治疗痛风的高效、低毒的药物和有效的中成药,有着广阔的前景。
Differences in MSU induced superoxide responses by neutrophils from gout subjects compared to healthy controls and a role for environmental inflammatory cytokines and hyperuricemia in neutrophil function and survival
[J]. J Rheumatol,2010,37(6):1228-1235.
