乳腺癌是女性最常见的恶性肿瘤之一,其死亡率占女性癌症的15%,居女性各类恶性肿瘤死亡率之首。自20世纪90年代以来,乳腺癌发病率呈现快速上升趋势[1]。在中国年龄低于35岁的三阴性乳腺癌(TNBC)患者占较高比例,欧洲和中国女性的TNBC平均发病年龄较非TNBC提早约10年[2]。因其靶受体的丧失,TNBC患者不能受益于基于激素或基于曲妥珠单抗的靶向治疗[3]。由于缺乏靶向治疗,TNBC已成为临床治疗与研究的难点。乳腺癌在历代中医文献中一般被称为“乳岩”。《医学汇编·乳岩附论》指出:“正气虚则为岩”。研究表明,参芪扶正注射液联合顺铂能提高TNBC患者的疗效,延长患者的中位生存期,有效改善其生活质量[4-5];其辅助治疗还具有增强免疫作用,能明显提高TNBC患者的机体免疫力,降低化疗毒副作用[6-7]。同时,参芪扶正注射液能通过促进细胞凋亡和下调B细胞淋巴瘤-2(Bcl-2)表达逆转多药耐药[8]。但参芪扶正注射液在减轻TNBC耐药现象的机制有待进一步明确。肿瘤相关巨噬细胞(TAMs)在乳腺癌基质中大量存在并分泌细胞因子,发挥促瘤作用的M2型TAMs的表达与TNBC的化疗耐药具有明显的相关性[9]。本课题组前期研究显示,参芪扶正注射液能显著降低诱导TAMs极化的炎症因子的释放;下调顺铂耐药乳腺癌细胞中P-糖蛋白(P-gp)的表达,从而提高化疗药物敏感性。因此,本课题组提出“参芪扶正注射液能通过减少TAMs细胞因子分泌,防止向M2型极化,降低TNBC耐药”。拟从细胞凋亡和减少细胞因子释放,探讨参芪扶正注射液缓解顺铂耐药的效果及其作用机制。本研究在理论上,提出益气扶正治疗法对改善化疗耐药有积极意义;思路上,将前期研究结果与国内外研究进展相结合,运用乳腺癌细胞与TAMs共培养,探讨参芪扶正注射液从调节免疫、多个靶点地改善耐药的分子机制,为中医药改善耐药研究提供实验依据。
1 材料
1.1 细胞
人乳腺癌细胞MDA-MB-231(SCSP-5043),传至第5代。人单核细胞THP-1购自中国科学院细胞库(TCHu 57),传至第5代。
1.2 药物和试剂
参芪扶正注射液(丽珠集团利民制药厂,批号180820);参芪扶正注射液是以黄芪、党参为主要原料,经提取、分离有效成分而配制成的中药静脉制剂,含生药为160 g·L-1。噻唑蓝(MTT)细胞增殖试剂盒(碧云天生物技术公司,批号C0009);Annexin V-FITC/碘化丙啶(PI)试剂盒(Biovision公司,批号K101-100);BCA蛋白定量试剂盒,一氧化氮(NO)试剂盒(南京建成生物生物工程研究所,批号分别为A045-3,K12707E);白细胞介素-10(IL-10),前列腺素E2(PGE2)试剂盒(武汉博士德生物工程有限公司,批号分别为EK0416,EK7124);Bcl-2,B细胞淋巴瘤-w(Bcl-w),细胞外大淋巴瘤(Bcl-xl),Bcl-2相关X蛋白(Bax),人BH3结构域凋亡诱导蛋白(Bid),内参甘油醛-3-磷酸脱氢酶(GAPDH)一抗(美国CST公司,批号分别为3498,2724,2764,2772,8762,5174)。
1.3 仪器
BB15型CO2培养箱(德国Heraeus公司),CKX41型倒置显微镜(日本Olympus公司),LB940型多功能酶标仪(德国Berthold公司),FACS Calibar型流式细胞仪(美国BD公司),PAC200型电泳仪及转膜仪(美国Bio-Rad公司),ImageQuant LAS 4000 mini型成像系统(美国GE公司)。
2 方法
2.1 参芪扶正注射液配制
参芪扶正注射液加入RPMI 1640培养液,将注射液原液分别配成1,10,100 mL·L-1。
2.2 细胞培养
采用开放式单层贴壁法培养人乳腺癌MDA-MB-231细胞,培养液为RPMI 1640(加入100 mg·L-1链霉素,100 U·mL-1青霉素和10%胎牛血清),培养条件为37 ℃ 5%CO2,相对饱和湿度。隔日更换培养液,细胞呈贴壁生长,待细胞覆盖率达80%~90%时传代。人单核细胞THP-1培养于RPMI 1640中,以佛波酯(PMA,10 μg·L-1)刺激THP-1细胞3 d,诱导细胞贴壁分化成巨噬细胞(定义为M0型),再加入20 μg·L-1 IL-4 0.7 mL,培养72 h即可获得TAM。以MDA-MB-231-THP-1 1∶5进行直接接触共培养。
2.3 细胞存活率检测
采用MTT比色法检测人乳腺癌细胞MDA-MB-231与THP-1共培养,检测细胞的存活率。加入顺铂3.75,7.5,15,30,60 μmol·L-1,参芪扶正注射液+顺铂+M2(M2由IL-4诱导THP-1形成)组加入参芪扶正注射液10 mL·L-1),培养48 h,避光环境下每孔加入5 g·L-1 MTT溶液20 μL,37 ℃ 5%CO2培养箱内继续培养4 h,吸弃上清液,每孔加入DMSO 150 μL,微量振荡10 min。观察各孔在490 nm波长处的吸光度A。细胞存活率=A药物组/A空白组×100%。
2.4 Annexin V-FITC/PI双染检测细胞凋亡率
选取对数生长期的MDA-MB-231细胞1×106个/mL接种于25 cm2培养瓶中,37 ℃ 5%CO2相对饱和湿度中RPMI 1640孵育24 h,更换培养液,加入参芪扶正注射液(1,10,100 mL·L-1)。培养48 h后消化收集细胞,离心,先后加入PI 10 μL,Annexin V-FITC 10 μL混匀,避光孵育30 min,采用流式细胞仪检测,按Q2象限细胞(晚期凋亡)和Q4象限细胞(早期凋亡)所占百分比之和计算凋亡率。
2.5 蛋白免疫印迹法(Western blot)检测相关蛋白表达
细胞裂解,4 ℃,13 000 r·min-1离心10 min,取上清,测定蛋白浓度,进行SDS-PAGE电泳。电泳后转膜,15 V稳压转移30 min。5%脱脂奶粉室温封闭1 h,弃去封闭液,一抗(1∶1 000)室温孵育1 h,4 ℃孵育过夜;二抗室温孵育1 h。Odyssey红外荧光扫描成像系统进行成像。
2.6 统计学方法
采用SPSS 21.0软件进行统计分析,计量资料以
3 结果
3.1 参芪扶正注射液对细胞存活率的影响
将乳腺癌细胞MDA-MB-231与TAMs共培养,与单独参芪扶正注射液干预MDA-MB-231细胞组10,100 mL·L-1组比较,参芪扶正注射液+M2组细胞存活率均明显降低(P<0.05),参芪扶正注射液能显著抑制共培养细胞生长。见表1。
| 组别 | 质量浓度/mL·L-1 | 细胞存活率/% |
|---|---|---|
| 空白 | - | 100.00±5.29 |
| 参芪扶正注射液 | 1 | 100.47±6.34 |
| 10 | 94.46±11.37 | |
| 100 | 91.91±8.32 | |
| 参芪扶正注射液+M2 | 1 | 82.23±9.99 |
| 10 | 71.83±8.011) | |
| 100 | 59.95±9.322) |
3.2 参芪扶正注射液对细胞药物敏感性的影响
与顺铂+M2组比较,参芪扶正注射液10 mL·L-1+顺铂7.5,15,30,60 μmol·L-1+M2组细胞存活率均明显降低(P<0.05)。联用后顺铂组IC50由30 μmol·L-1降低至15 μmol·L-1,参芪扶正注射液提高了顺铂的药物敏感性。见表2。
| 组别 | 浓度/μmol·L-1 | 细胞存活率/% |
|---|---|---|
| 空白 | - | 100.00±5.62 |
| 顺铂 | 3.75 | 87.04±1.2 |
| 7.5 | 70.89±5.51 | |
| 15 | 54.95±4.71 | |
| 30 | 31.43±8.89 | |
| 60 | 13.39±4.86 | |
| 空白 | - | 116.81±2.81 |
| 顺铂+M2 | 3.75 | 107.55±3.38 |
| 7.5 | 96.25±4.43 | |
| 15 | 74.74±5.26 | |
| 30 | 63.77±4.48 | |
| 60 | 33.57±4.72 | |
| 空白 | - | 112.07±3.07 |
| 参芪扶正注射液+顺铂+M2 | 3.75 | 88.75±9.45 |
| 7.5 | 74.79±9.511) | |
| 15 | 48.77±3.522) | |
| 30 | 39.61±5.533) | |
| 60 | 24.74±9.254) |
3.3 参芪扶正注射液对细胞凋亡的影响
单独运用参芪扶正注射液1,10,100 mL·L-1分别干预共培养细胞,细胞凋亡率分别为7.9%,17.8%,22.4%。与15 μmol·L-1顺铂组比较,参芪扶正注射液+顺铂组细胞凋亡率明显增加(P<0.05),参芪扶正注射液能增加顺铂诱导MDA-MB-231与TAMs共培养细胞发生凋亡。见表3。
| 组别 | 浓度 | 细胞凋亡率/% |
|---|---|---|
| 空白 | - | 1.91±1.33 |
| 参芪扶正注射液 | 1 mL·L-1 | 7.92±1.87 |
| 10 mL·L-1 | 17.86±2.47 | |
| 100 mL·L-1 | 22.44±2.37 | |
| 顺铂 | 15 μmol·L-1 | 25.39±0.99 |
| 参芪扶正注射液+顺铂 | 10 mL·L-1+ 15 μmol·L-1 | 40.89±5.991) |
3.4 参芪扶正注射液对细胞凋亡相关蛋白表达的影响
与空白组比较,参芪扶正注射液+顺铂组能明显抑制Bcl-2,Bcl-w,Bcl-xl蛋白表达,增加Bax,Bid蛋白表达(P<0.05),参芪扶正注射液联合顺铂能抑制MDA-MB-231与TAMs共培养细胞中凋亡相关蛋白的表达。见图1,表4。
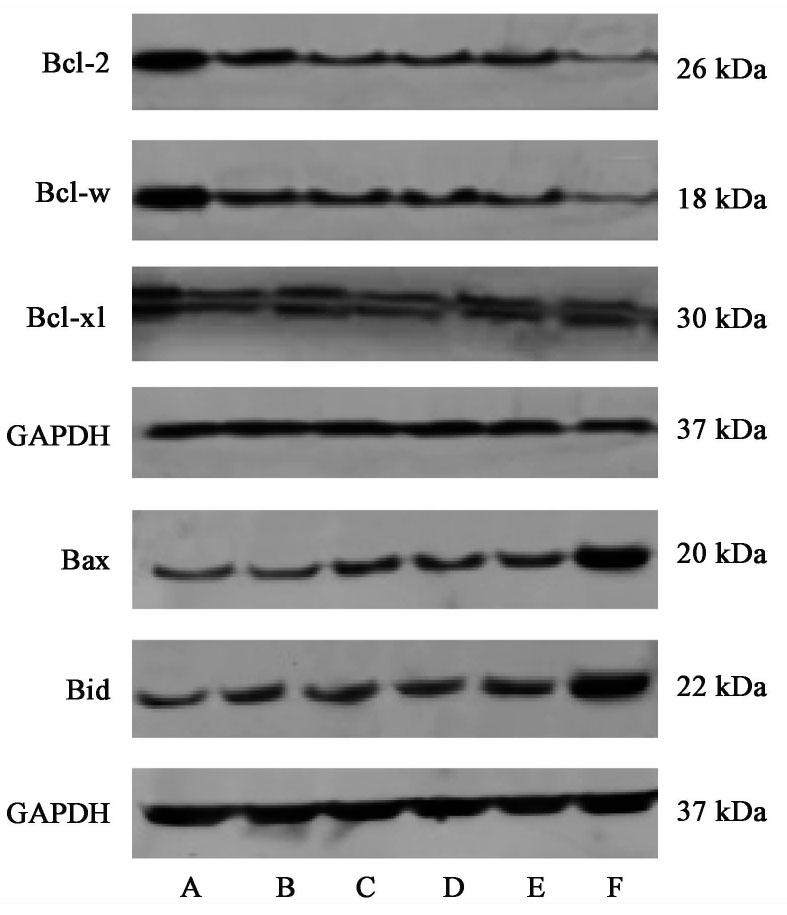
| 组别 | 浓度 | Bcl-2/GAPDH | Bcl-w/GAPDH | Bcl-xl/GAPDH | Bax/GAPDH | Bid/GAPDH |
|---|---|---|---|---|---|---|
| 空白 | - | 1.03±0.12 | 0.99±0.13 | 0.98±0.16 | 0.48±0.11 | 0.46±0.04 |
| 参芪扶正注射液 | 1 mL·L-1 | 0.95±0.14 | 0.92±0.18 | 0.69±0.09 | 0.49±0.09 | 0.52±0.07 |
| 10 mL·L-1 | 0.62±0.09 | 0.71±0.20 | 0.75±0.13 | 0.63±0.12 | 0.55±0.03 | |
| 100 mL·L-1 | 0.59±0.04 | 0.65±0.11 | 0.72±0.11 | 0.68±0.08 | 0.64±0.10 | |
| 顺铂 | 15 μmol·L-1 | 0.63±0.05 | 0.52±0.09 | 0.68±0.08 | 0.78±0.14 | 0.81±0.16 |
| 参芪扶正注射液+顺铂 | 10 mL·L-1+ 15 μmol·L-1 | 0.28±0.021) | 0.21±0.051) | 0.56±0.061) | 0.92±0.161) | 0.91±0.211) |
3.5 参芪扶正注射液对细胞中顺铂诱导的细胞因子释放的影响
与空白组比较,顺铂组TAMs中释放IL-10,PGE2和NO水平明显增加(P<0.05)。与顺铂组比较,顺铂+参芪扶正注射液组IL-10和PGE2水平明显降低(P<0.05),参芪扶正注射液能降低共培养细胞中顺铂诱导的细胞因子释放。见表5。
| 组别 | 浓度 | IL-10/ng·L-1 | PGE2/ng·L-1 | NO/μmol·L-1 |
|---|---|---|---|---|
| 空白 | - | 62.63±7.43 | 50.09±8.51 | 42.52±6.64 |
| 参芪扶正注射液 | 1 mL·L-1 | 61.57±8.74 | 49.12±5.46 | 45.95±6.33 |
| 10 mL·L-1 | 60.43±11.59 | 43.11±6.71 | 44.53±7.69 | |
| 100 mL·L-1 | 55.95±7.72 | 35.45±9.48 | 42.21±7.59 | |
| 顺铂 | 15 μmol·L-1 | 73.28±9.731) | 58.85±8.121) | 49.98±7.961) |
| 顺铂+参芪扶正注射液 | 15 μmol·L-1+1 mL·L-1 | 70.05±9.28 | 56.72±9.32 | 48.24±7.60 |
| 15 μmol·L-1+10 mL·L-1 | 59.48±9.472) | 48.85±9.922) | 45.06±6.78 | |
| 15 μmol·L-1+100 mL·L-1 | 41.47±14.173) | 41.17±6.593) | 43.29±10.94 |
4 讨论
三阴性乳腺癌不能从针对乳腺癌的内分泌治疗及抗Her-2的靶向治疗中获益[10]。因此积极寻找TNBC的治疗靶点是目前国内外乳腺癌研究领域的难点和热点。临床对TNBC的治疗仍以蒽环类和紫杉烷类为标准的新辅助和辅助化疗方案[11]。然而,TNBC的早期复发率仍然很高,所以针对性的靶向治疗或多靶点的联合治疗或许为三阴性乳腺癌患者带来新的希望。
乳腺癌发病的主要原因是正气不足,邪气入侵是重要外因,肝郁脾虚、冲任失调影响其病程发生发展的重要因素。其病机是“本虚标实,虚实夹杂”。因手术损伤机体元气,放化疗耗气伤津,属热毒,长期放化疗生痰致瘀,导致肿瘤复发或转移,因此提倡使用“益气扶正”之法来治疗该疾病。方中黄芪健脾益气,既能使脾气健运,痰浊得消,又能补气而活血,使气行则血行,瘀血自消。气能生血,气又为血之帅,能助其行血,气血充足,则能有力抵挡外邪,促邪外出,抑制乳腺癌转移,减少复发概率。党参性平味甘微酸,具有补中健脾益气的功效。《本草从新》记载党参:“补中益气、和脾胃、除烦渴。中气微弱,用以调补,甚为平妥”。党参与黄芪合用,能加强黄芪益气健脾,化痰散浊的作用。
近年,有关参芪扶正注射液改善化疗耐药进行了大量研究。结果显示,参芪扶正注射液能通过调节MDRl,Bcl-2和Bax mRNA的转录及蛋白表达逆转多药耐药[12];能调节细胞凋亡,逆转A549/DDP细胞对顺铂的耐药性[13]。但参芪扶正注射液通过调控免疫机制抑制TNBC的作用机制有待进一步明确。
细胞凋亡又称细胞程序性死亡,细胞凋亡机制异常可以导致包括癌症在内的多种疾病的发生。乳腺癌治疗面临最大的问题之一就是癌细胞对各种放化疗诱导的细胞生长抑制和细胞凋亡不敏感或产生抗性。Bcl-2家族蛋白调控细胞凋亡在乳腺癌治疗中发挥关键调控作用。Bcl-2,Bcl-xl,Bcl-w等属于Bcl-2家族抗凋亡蛋白,临床发现约75%的乳腺癌组织高表达Bcl-2[14]。Bcl-2表达高低可以作为乳腺癌化疗敏感性的判断指标。中药及其成分在诱导肿瘤细胞凋亡中起着重要作用。温阳散结中药能够有效抑制细胞增殖及诱导凋亡[15];毛钩藤碱可诱导MDA-MB-231细胞发生凋亡[16];本课题组前期研究显示,姜黄素能通过诱导乳腺癌细胞凋亡提高丝裂霉素C的化疗敏感性[17],改善其耐药[18]。本研究显示,参芪扶正注射液能通过诱导细胞凋亡,提高顺铂的药物敏感性,并且其作用机制与其抑制抗凋亡蛋白和增加促凋亡蛋白表达有关。
TAMs来源于血液循环中的单核细胞,在肿瘤微环境中分化成为M2表型的巨噬细胞,是乳腺癌基质中主要的炎症细胞[19]。研究显示,TAMs与肿瘤免疫逃逸有关[20]。参芪扶正注射液通过提高荷瘤小鼠的细胞免疫功能,改善荷瘤小鼠的抗肿瘤免疫状态,协同对肿瘤细胞的直接杀伤作用,在荷瘤小鼠体内发挥其抑瘤抗瘤作用[21]。参芪扶正注射液联合化疗有助于清除和杀伤癌细胞,增强机体免疫力,可以作为胃癌化疗的辅助用药[22]。本研究结果显示,参芪扶正注射液能通过调节M2型TAMs提高顺铂药物敏感性,能降低顺铂诱导的IL-10和PGE2释放,进一步揭示参芪扶正注射液通过改善免疫发挥其协同抗肿瘤效应。
综上所述,参芪扶正注射液能显著抑制人乳腺癌细胞MDA-MB-231与THP-1共培养细胞生长,其与顺铂联合运用,提高了共培养细胞对顺铂的敏感性,促进了细胞凋亡。参芪扶正注射液降低了顺铂诱导的IL-10和PGE2释放。正气虚弱是乳腺癌发病的根本病机,晚期乳腺癌患者经过长期化疗后,其免疫功能低下明显。机体免疫功能与乳腺癌的发病及预后密切相关。因此,改善机体免疫状态,通过提高免疫功能来防治肿瘤已成为不可忽视的重要环节。本研究中,参芪扶正注射液通过调节免疫细胞改善了乳腺癌细胞MDA-MB-231对顺铂的敏感性,起到协同抑制肿瘤细胞增殖的作用。由于益气扶正中药具有疗效显著、毒副作用小且不易产生耐药的特点,具有广阔的应用前景,因而揭示其作用机制也显得尤为必要。

