刺五加是五加科五加属多年生木本植物,具有益气健脾,补肾安神的功效[1]。2015年版《中国药典》记载干燥的根和根茎或茎为刺五加的药用部位[2]。广泛分布于黑龙江、吉林地区的长白山脉和小兴安岭等地区[3-4]。由于药用植物是中药的主要来源,而植物受生物学因素或非生物学因素所形成的植物次生代谢物是其有效成分的物质基础,也是发现药物作用的物质基础及发现新药的重要来源[5-6]。植物-土壤反馈可以对植物个体产生巨大的变化[7]。因此,在人工种植刺五加的过程中,研究植物-土壤反馈对刺五加幼苗的次生代谢产物变化情况对刺五加成品药材的质量控制有着重要的意义。
植物-土壤反馈是指植物改变根际土壤的生物和非生物特征,同时改变植物生长,从而影响植物群落组成及植物间的相互作用[8]。该过程可能改变植物的物质分布[9]。同样的,中药质量是中药临床疗效的保障,是中药产业发展的生命线[10-11],中药质量标记物(Q-marker)更是与植物次生代谢产物有着紧密的联系,可以说植物幼苗质量直接影响着成品药材的质量。然而,在对刺五加的植物-土壤反馈和次生代谢产物相结合的研究并不多见。
本文从植物-土壤反馈角度出发,通过盆栽试验初步模拟植物-土壤反馈对刺五加幼苗的影响,系统分析比较植物-土壤反馈对刺五加幼苗次生代谢产物的影响,从而希望在一定程度上阐明多年种植刺五加的土壤对刺五加幼苗质量的影响[12]。进而加深刺五加的植物-土壤反馈研究深度,并为农田栽培刺五加技术标准提供理论依据和技术支持。
1 材料
2018年5月初,在伊春红星林业局中心苗圃选取连续3年种植刺五加的农田、黑龙江中医药大学药园选取连续多年种植刺五加的地块和未种植过刺五加的地块,分别收集表层土壤50 kg,去除枯枝落叶和碎石等杂质,用于温室盆栽实验。
2018年5月初,在伊春红星林业局中心苗圃选取长势一致的刺五加1年生幼苗,带回黑龙江中医药大学药园温室进行移栽。植株经黑龙江中医药大学王振月教授鉴定为刺五加Acanthopanax senticosus。
E2695型高效液相色谱仪(Waterse公司),AE240 Mettle型1/10万分析天平(德国梅特勒-托利多国际有限公司),KM-822C型超声波清洗器(频率480 W功率40 kHz,广州市科洁盟实验仪器有限公司)。
刺五加苷E,原儿茶酸,槲皮素,绿原酸,金丝桃苷,芦丁,L-苯丙氨酸,咖啡酸,异嗪皮啶,刺五加苷B(上海源叶生物生物科技有限公司,批号分别为W11J7K8869,Z30M6L1,C20J6Y1722,Y24J7K16726,Y04A9X62302,Y06J8S37439,J04J7R8481,Y17D6C7672,Y12J7S17732,Y28M9H57297,纯度分别为≥98%,≥98%,≥98%,≥98%,≥98%,≥98%,≥99%,≥98%,≥99%,≥98%);乙腈(GradeDikmaPure公司,批号R141434,色谱纯),蒸馏水实验室自制。
2 方法
2.1 试验设计
以收集的多年栽培刺五加的土壤和未栽培过刺五加的土壤为栽培基质,分别去除表面的枯枝落叶和碎石后,选取长势一致的刺五加1年生幼苗,分别移栽到装有黑龙江中医药大学药园采集的未种植过刺五加的土壤(1组)、伊春红星林业局中心苗圃采集的连续3年生长刺五加的土壤(2组),黑龙江中医药大学药园采集的多年生长刺五加的土壤(3组),共计3组,每组12盆,共计36盆。所有盆放置在黑龙江中医药大学温室中,每周随机调换位置,每周浇水一次,温室栽培5个月后,刺五加幼苗全株收获,用自来水冲净后,用滤纸吸干表面水分,将植株根、茎、叶分开,然后放入35 ℃的烘箱中烘干,即可。
2.2 色谱条件
Symmetry C18色谱柱(4.6 mm×150 mm,5μm);流动相乙腈(A)-0.2%磷酸水(B),梯度洗脱(0~3 min,4.5%~5.4%A;3~50 min,5.4%~20.7%A,50~60 min,20.7%~24%A,60~70 min,24%~50%A);柱温20 ℃;体积流量0.8 mL·min-1;检测波长210 nm;进样体积10 μL[13-14]。
2.3 混合对照品溶液制备
精密称取L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素适量,加甲醇(刺五加苷E和金丝桃苷对照品先加50%甲醇溶解)制成L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素质量浓度分别为0.020 4,0.045 6,0.270 7,0.374 4,1.188 5,0.039 3,0.043 7,0.695 0,0.136 9,0.065 5 g·L-1的混合对照品溶液。
2.4 供试品溶液制备
取采集的刺五加植物样品,35 ℃烘干后,粉碎,过40目筛。取样品粗粉约2 g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇25 mL,称定质量,超声处理(功率480 W,频率40 kHz)30 min,放冷。再次称定质量,用50%甲醇补足损失的质量,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.5 系统适用性试验
取上述混合对照品溶液、供试品溶液各适量,按上述色谱条件进样测定,记录色谱图。计算结果显示L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素组分的理论板数均高于3 000,分离度均>1.15,各成分基线分离良好。混合对照品及供试品色谱见图1。
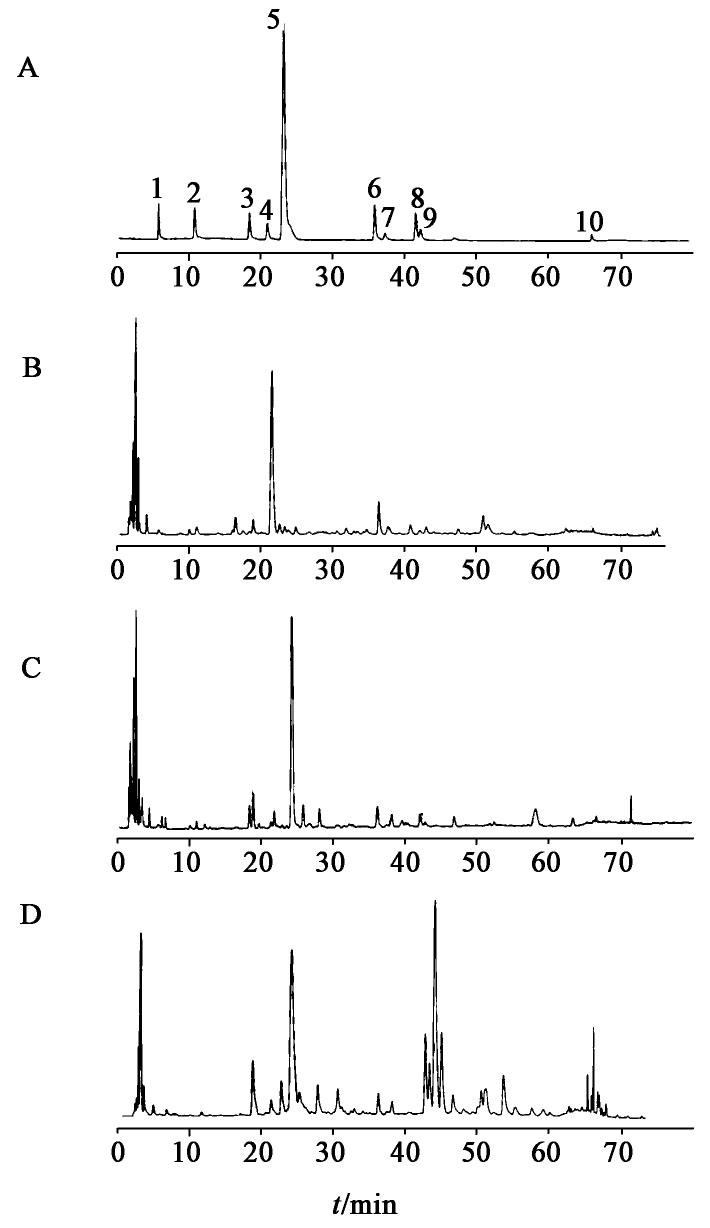
2.6 线性关系考察
分别精密吸取混合对照品溶液0.5,2,4,6,8,10 mL定容至10 mL,并在上述色谱条件下测定,以刺五加苷B为参考峰,以刺五加苷B相应的峰为参比峰(S峰),计算其他对照品峰与参比峰的相对保留时间,记录色谱图。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),对L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素进行线性回归计算。绘制L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素的标准曲线。见表1。
| No. | 名称 | 线性方程 | R2 | 线性范围/g·L-1 |
|---|---|---|---|---|
| 1 | L苯丙氨酸 | Y=2.743 9×107X-2.971 7×105 | 0.999 3 | 0.001 0~0.020 4 |
| 2 | 原儿茶酸 | Y=6.070 2×106X-1.234 8×105 | 0.999 4 | 0.002 3~0.045 6 |
| 3 | 刺五加苷B | Y=1.681 7×106X-1.801 0×105 | 0.999 0 | 0.013 5~0.270 7 |
| 4 | 绿原酸 | Y=2.231 7×106X-3.301 9×105 | 0.999 7 | 0.018 7~0.374 4 |
| 5 | 咖啡酸 | Y=3.848 5×106X-1.648 5×106 | 0.999 3 | 0.059 4~1.188 5 |
| 6 | 刺五加苷E | Y=7.941 9×106X-1.322 5×105 | 0.999 6 | 0.002 0~0.039 3 |
| 7 | 异嗪皮啶 | Y=7.661 1×106X-1.581 7×105 | 0.999 7 | 0.002 2~0.043 7 |
| 8 | 芦丁 | Y=2.824 7×106X-9.429 8×105 | 0.999 1 | 0.034 8~0.695 0 |
| 9 | 金丝桃苷 | Y=6.191 7×106X-4.634 6×105 | 0.999 8 | 0.006 8~0.136 9 |
| 10 | 槲皮素 | Y=8.358 7×106X-3.593 1×105 | 0.999 0 | 0.003 3~0.065 5 |
2.7 重复性试验
分别取刺五加根、茎、叶各6份,在上述条件下测定含量,并计算RSD。测得刺五加幼苗中根、茎、叶中L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素的RSD,见表2。
| No. | 名称 | 根 | 茎 | 叶 | |||
|---|---|---|---|---|---|---|---|
| 质量分数( |
RSD | 质量分数( |
RSD | 质量分数( |
RSD | ||
| 1 | L-苯丙氨酸 | 0.028 2±0.000 4 | 1.0 | 0.027 5±0.000 2 | 1.5 | 0.020 1±0.000 2 | 0.8 |
| 2 | 原儿茶酸 | 0.078 2±0.001 6 | 1.6 | 0.158 9±0.003 1 | 2.1 | 0.071 3±0.001 2 | 1.9 |
| 3 | 刺五加苷B | 1.960 0±0.033 3 | 1.1 | 0.849 5±0.010 9 | 1.7 | 0.372 9±0.004 3 | 1.3 |
| 4 | 绿原酸 | 1.693 2±0.017 2 | 0.7 | 1.056 5±0.018 9 | 1.0 | 2.291 8±0.017 0 | 1.8 |
| 5 | 咖啡酸 | 3.457 6±0.060 1 | 1.1 | 1.356 0±0.029 4 | 1.7 | 1.020 8±0.011 4 | 2.2 |
| 6 | 刺五加苷E | 0.139 8±0.002 9 | 1.4 | 0.035 5±0.000 7 | 2.0 | 0.400 5±0.005 6 | 2.0 |
| 7 | 异嗪皮啶 | 0.123 9±0.001 4 | 1.7 | 0.039 0±0.000 4 | 1.1 | 0.066 5±0.001 1 | 1.1 |
| 8 | 芦丁 | 1.142 0±0.012 4 | 0.2 | 0.458 6±0.001 9 | 1.1 | 0.458 4±0.000 9 | 0.4 |
| 9 | 金丝桃苷 | 0.223 7±0.004 2 | 0.7 | 0.101 8±0.000 1 | 1.9 | 0.108 4±0.000 7 | 0.1 |
| 10 | 槲皮素 | 0.072 8±0.000 9 | 0.2 | 0.139 1±0.002 6 | 1.3 | 0.065 4±0.000 1 | 1.9 |
2.8 精密度试验
分别取同一对照品溶液,在上述色谱条件下连续进样6次,记录峰面积,其中L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素的RSD分别为1.0%,1.5%,1.2%,1.9%,1.8%,1.2%,1.9%,1.9%,1.5%,2.0%。
2.9 稳定性试验
取同一供试品溶液,室温下放置,分别在0,2,4,6,8,24,48 h后进样分析,按上述色谱条件进行测定,记录峰面积。刺五加幼苗中根茎叶中L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素的峰面积RSD分别为1.4%,1.2%,1.3%,1.9%,1.0%,1.0%,1.5%,0.4%,0.5%,1.2%。
2.10 加样回收率试验
取已测定的同一批样品,根茎叶各6份,精密称定,分别加入适量L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸、咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素对照品,每次进样10 μL进行测定。计算刺五加幼苗中根茎叶中10个成分平均回收率,结果见表3。
| No. | 名称 | 部位 | 加样回收率 | 平均加样回收率 | RSD |
|---|---|---|---|---|---|
| 1 | L-苯丙氨酸 | 根 | 97.43~102.05 | 100.53 | 1.6 |
| 茎 | 97.34~103.48 | 99.45 | 2.2 | ||
| 叶 | 97.22~102.00 | 99.02 | 1.5 | ||
| 2 | 原儿茶酸 | 根 | 97.27~102.97 | 99.93 | 2.4 |
| 茎 | 98.63~103.35 | 101.67 | 1.9 | ||
| 叶 | 97.46~102.52 | 100.29 | 1.8 | ||
| 3 | 刺五加苷B | 根 | 98.36~103.10 | 100.07 | 1.7 |
| 茎 | 97.64~102.26 | 99.11 | 1.7 | ||
| 叶 | 99.46~101.42 | 100.74 | 0.7 | ||
| 4 | 绿原酸 | 根 | 98.96~102.75 | 100.90 | 1.4 |
| 茎 | 97.32~102.32 | 100.09 | 1.6 | ||
| 叶 | 98.00~103.32 | 99.87 | 1.7 | ||
| 5 | 咖啡酸 | 根 | 97.80~103.43 | 100.35 | 1.9 |
| 茎 | 97.28~101.41 | 99.52 | 1.7 | ||
| 叶 | 97.84~102.93 | 99.96 | 1.7 | ||
| 6 | 刺五加苷E | 根 | 98.19~103.30 | 100.80 | 1.6 |
| 茎 | 97.70~101.53 | 99.54 | 1.4 | ||
| 叶 | 101.03~102.88 | 101.81 | 0.6 | ||
| 7 | 异嗪皮啶 | 根 | 98.00~102.67 | 100.66 | 1.5 |
| 茎 | 97.09~100.57 | 98.98 | 1.3 | ||
| 叶 | 97.24~101.01 | 99.22 | 1.6 | ||
| 8 | 芦丁 | 根 | 97.15~101.80 | 99.02 | 1.8 |
| 茎 | 98.35~102.85 | 101.01 | 1.4 | ||
| 叶 | 98.99~102.87 | 100.54 | 1.6 | ||
| 9 | 金丝桃苷 | 根 | 99.17~101.96 | 101.05 | 0.9 |
| 茎 | 97.19~101.73 | 99.13 | 1.6 | ||
| 叶 | 97.15~102.10 | 99.14 | 1.8 | ||
| 10 | 槲皮素 | 根 | 97.18~103.44 | 100.95 | 2.2 |
| 茎 | 97.13~103.04 | 100.14 | 2.0 | ||
| 叶 | 98.25~99.61 | 99.02 | 0.5 |
2.11 样品测定
取生物量测定后的烘干刺五加幼苗的根、茎、叶,按照供试品溶液制备方法制备供试品溶液,按上述色谱条件测定,并计算各组刺五加幼苗的次生代谢产物L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素的含量。
2.12 数据处理
试验数据采用SPSS 20.0统计软件进行统计分析,通过主成分分析,反映植物-土壤反馈中次生代谢产物的综合含量差异。同时利用单因素方差分析(One-way ANOVA)对数据进行分析。根据方差分析结果采用邓肯法(Duncan)对数据进行多重比较,并利用Origin2018软件作图。最后利用R语言进行聚类分析,用聚类热图反映出植物-土壤反馈中次生代谢产物的分布情况[15]。
3 结果与分析
3.1 植物-土壤反馈对刺五加幼苗中次生代谢产物的具体影响
L-苯丙氨酸,原儿茶酸,刺五加苷B,绿原酸,咖啡酸,刺五加苷E,异嗪皮啶,芦丁,金丝桃苷,槲皮素对多年生长刺五加土壤对刺五加幼苗叶和根均有显著性差异,但在茎中绿原酸和刺五加苷E无显著性差异。其中刺五加苷E,异嗪皮啶,芦丁和金丝桃苷在多年生刺五加土壤种植的幼苗叶中未检出。在刺五加幼苗的根中多数次生代谢产物呈现正反馈,即多年种植刺五加的土壤高于未种植过刺五加的土壤。在刺五加幼苗的茎中咖啡酸,刺五加苷E,金丝桃苷,槲皮素呈现负反馈,即多年种植刺五加的土壤低于未种植过刺五加的土壤。在刺五加幼苗的叶中多数次生代谢产物呈现正反馈,即多年种植刺五加的土壤低于未种植过刺五加的土壤。见表4。
| 部位 | 组别 | L-苯丙氨酸 | 原儿茶酸 | 刺五加苷B | 绿原酸 | 咖啡酸 |
|---|---|---|---|---|---|---|
| 根 | 1 | 0.017 8±0.000 2c | 0.042 2±0.003 3c | 0.539 3±0.211 3b | 1.044 0±0.014 8c | 2.107 0±0.247 1b |
| 2 | 0.019 5±0.000 6b | 0.069 6±0.002 2a | 0.404 5±0.037 3c | 2.309 6±0.076 6a | 0.991 0±0.040 2c | |
| 3 | 0.023 5±0.000 9a | 0.049 7±0.006 0b | 1.959 0±0.054 0a | 1.198 0±0.052 1b | 3.565 5±0.036 3a | |
| 茎 | 1 | 0.017 6±0.002 3b | 0.042 2±0.008 6b | 0.833 9±0.212 3c | 1.352 9±0.128 0ab | 3.550 2±0.391 7a |
| 2 | 0.023 6±0.002 9b | 0.090 2±0.018 9a | 1.991 0±0.112 4a | 1.464 6±0.240 2a | 2.824 3±0.689 7b | |
| 3 | 0.053 1±0.015 4a | 0.047 2±0.010 6b | 1.274 0±0.015 9b | 1.315 4±0.043 6b | 2.516 1±0.308 9b | |
| 叶 | 1 | 0.076 1±0.004 7a | 0.298 1±0.003 1a | 1.130 5±0.078 1a | 1.335 9±0.023 1a | 8.447 6±1.070 0a |
| 2 | 0.027 7±0.000 3b | 0.150 7±0.013 1b | 0.812 1±0.058 7b | 1.156 0±0.068 9b | 1.361 7±0.056 6b | |
| 3 | 0.020 4±0.001 3c | 0.134 7±0.005 0c | 0.234 8±0.019 3c | 1.001 4±0.009 1c | 1.225 0±0.019 8b |
3.2 植物-土壤反馈对刺五加幼苗中次生代谢产物的聚类分析
聚类分析结果见图2,10种次生代谢产物在植物-土壤反馈的刺五加幼苗中的累积差异为:根中积累差异为2类,茎中为3类,叶中为3类。其中根中未种植过刺五加土壤(1组)中原儿茶酸、绿原酸和刺五加苷E的累积量高于种植过刺五加土壤(2组,3组),但其他次生代谢产物的累积量多年种植刺五加的土壤明显高于其他两组。叶中次生代谢产物的累积量未种植过刺五加土壤(1组)中显著高于其他两组。
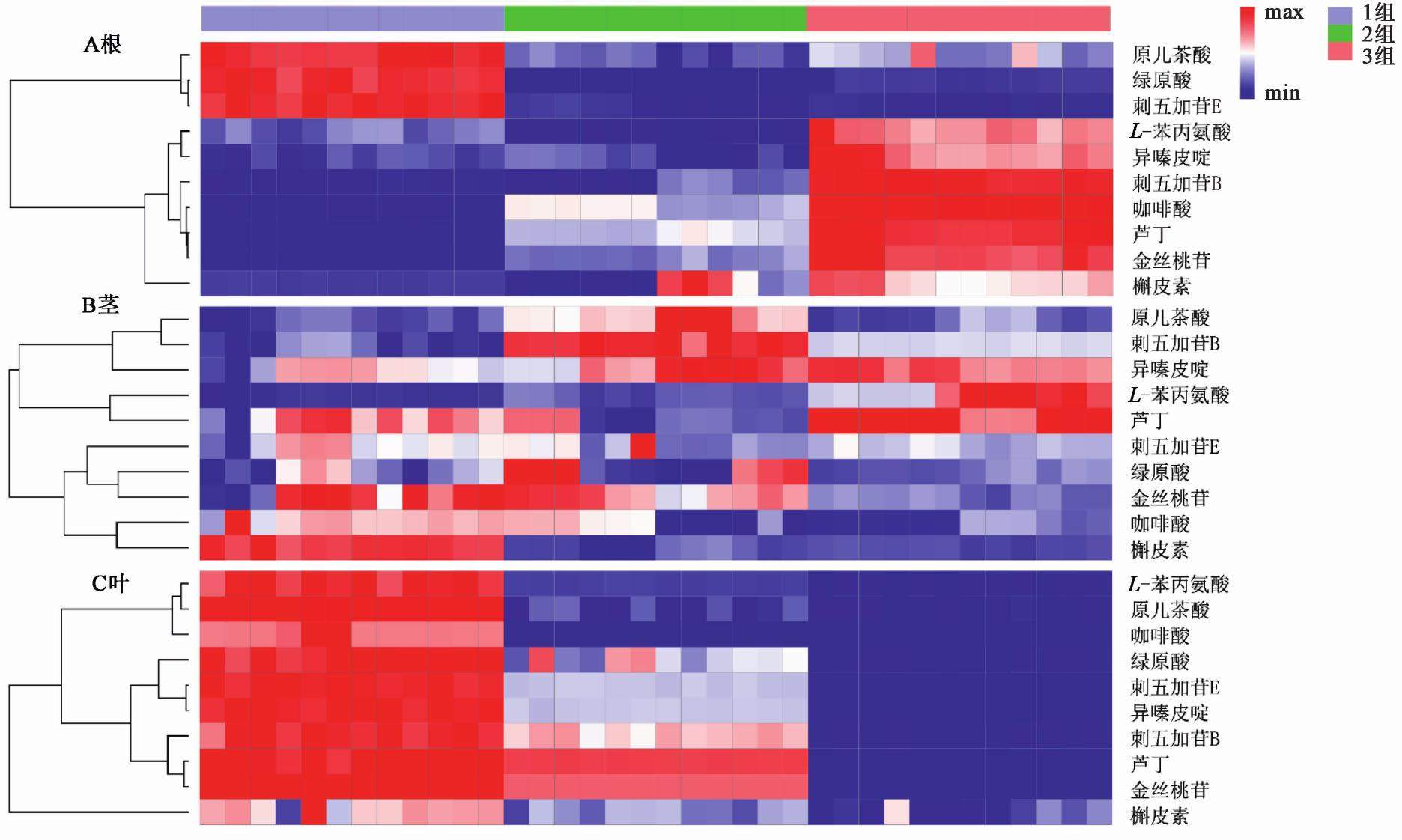
3.3 植物-土壤反馈对刺五加幼苗中次生代谢产物的主成分分析
从以上分析结果中可以看出,植物-土壤反馈中不同次生代谢产物的变化不同。为了进一步对实验结果进行分析,本研究采用主成分分析方法对数据进行进一步的分析。通过SPSS软件进行主成分分析,用主成分综合得分Q值说明植物-土壤反馈对刺五加幼苗根、茎、叶中10种主要药用次生代谢产物含量变化的整体趋势。结果表明,植物-土壤反馈中,10种主要药用次生代谢产物在刺五加幼苗的根、茎、叶显示出不同的积累趋势。其中茎中呈现正反馈,即多年种植刺五加的土壤高于未种植过刺五加的土壤。叶中呈现负反馈,即多年种植刺五加的土壤低于未种植过刺五加的土壤。见表5。
| 部位 | 组别 | Q值 |
|---|---|---|
| 根 | 1 | -0.61±0.28 |
| 2 | 2.14±0.11 | |
| 3 | 2.75±0.44 | |
| 茎 | 1 | -0.98±1.39 |
| 2 | 0.87±0.42 | |
| 3 | 0.10±0.23 | |
| 叶 | 1 | 3.43±0.29 |
| 2 | 3.43±0.27 | |
| 3 | -3.02±0.20 |
4 讨论
目前,植物-土壤反馈研究逐渐增加,但试验方法还不太成熟,研究方法比较单一,并且目前对中草药在植物-土壤反馈方面的研究不多,判定植物-土壤反馈作用强度和方向主要通过测定供试种生物量、株高及种子萌发等情况[16-18]。然而,对于中药而言,药效成分才是临床用药的基础,中药种植更是要以药效成分为目标区别于传统的种植。本文在温室可控的条件下,尝试从植物-土壤反馈角度结合次生代谢产物的含量方法,分析了刺五加幼苗在植物-土壤反馈中的次生代谢产物的变化情况。试验周期较短,只进行了一个生长季节的观察,而次生代谢产物的变化情况也比较复杂,需要进一步的细化研究,如不同月份的连续变化情况、结合生物量、光合作用、土壤微生物、丛枝菌根等生物和非生物的多种因素综合分析,才能更加准确的分析。

