肺癌是起源于支气管上皮细胞的原位癌,目前仍然是全球引起癌症相关死亡的主要病因[1-2]。临床治疗以手术、化疗、放疗、靶向治疗等综合治疗为主。但晚期非小细胞肺癌中位生存时间为8~10个月[3],小细胞肺癌中位生存期为11个月[4]。近年来,生物治疗逐渐兴起,尤其免疫治疗程序性死亡受体-1/程序性死亡-配体1(PD-1/PD-L1)抑制剂为肺癌提供新的治疗手段。中医药在降低肺癌复发转移、减轻放化疗及靶向治疗副反应、改善患者生存质量方面也发挥积极作用。
中医认为,肺癌为正气内虚、邪毒外侵,内生痰湿、瘀血、气滞、毒邪等因素综合作用形成。其中,正气虚损为主要内因。治疗以扶正祛邪为根本大法。人参-黄芪为临床常用补气扶正抗癌之对药。王莉新等[5]通过数据挖掘以及关联算法分析中医治疗肺癌方药,人参与黄芪作为药对频数是46,居中医治疗肺癌药对频数第5位。人参有大补元气、化生津液之功,《名医别录》记载:调中,止消渴,通血脉,破坚积。黄芪为补药之长,具托毒生肌之效,《神农本草经》:“主痈疽,久败疮,排脓止痛,补虚。”现代研究表明,人参Rg3可诱导人肺癌A549细胞凋亡[6],二醇组人参皂苷Rh2抑制Lewis细胞增殖[7]。黄芪多糖可抑制Lewis肺癌血管内皮生长因子(VEGF)表达、提高内皮抑素(Endostatin)蛋白表达[8],黄芪水提物显著抑制小鼠肺部肿瘤数量及体积[9]。关于人参、黄芪单味药的药理药效研究较多,但关于人参-黄芪作为对药联合应用药效机制的报道较少。
本文通过网络药理学研究方法,构建“药物-成分-靶点-疾病”网络,探索人参-黄芪药物活性成分、潜在治疗靶点和作用机制,阐述人参-黄芪治疗肺癌的科学内涵,为进一步实验验证人参-黄芪作用机制提供新靶点和新思路。
1 材料与方法
1.1 筛选人参-黄芪有效成分及靶基因
传统中药系统药理学数据库和分析平台(TCMSP)是基于传统中草药系统药理学框架而建立的数据库和可视化平台,包括在中国药典中注册的499种中草药,29 384种成分,3 311种作用靶点和837种相关疾病[10]。通过TCMSP进行人参和黄芪活性成分及靶基因筛选。分别检索关键词“人参”“黄芪”,选择“Ingredients”,再根据口服生物利用度(OB)>30%和类药性(DL)>0.18进行筛选,得到人参、黄芪生物活性成分。选择“Related Targets”,获取人参和黄芪所有活性成分对应的靶基因。
1.2 获取肺癌相关基因
人类基因数据库(GeneCards,https://www.genecards.org)是一个自动整合网络资源的基因数据,全面提供所有有关人类基因注释和预测信息[11]。输入关键词“Lung Cancer”,获得肺癌相关基因。将人参、黄芪靶基因与肺癌相关基因映射,得到人参、黄芪治疗肺癌的靶基因。
1.3 构建“药物-成分-靶点-疾病”网络
将人参、黄芪治疗肺癌的靶基因与OB>30%和DL>0.18筛选出的人参、黄芪活性成分映射,建立活性成分与靶基因对应关系,得到治疗肺癌的活性成分以及关键靶基因。Cytoscape是一个开源软件平台,可将复杂网络可视化并且可与任何属性数据进行整合。创建“药物-成分”“成分-靶点”“疾病-靶点”关系文件以及属性文件,导入到Cytoscape(Version 3.7.1)构建“药物-成分-靶点-疾病”网络。在网络中,节点(node)代表人参和黄芪、生物活性成分、关键靶基因以及肺癌。边(edge)代表人参、黄芪与对应活性成分、活性成分与靶基因、肺癌与靶基因相互作用关系。
1.4 构建蛋白-蛋白相互作用(PPI)网络
STRING(Version 11.0,https://string-db.org)是整合已知和预测的蛋白质-蛋白质相互作用数据库,而且有可视化展示蛋白质-蛋白质相互作用网络功能[12]。选择“multiple proteins”,输入关键靶基因,选择“Homo sapiens”进行检索。选择中等置信度为0.400,下载蛋白质-蛋白质文件中蛋白-蛋相互作用tsv文件。将tsv文件导入到Cytoscape,使用插件CentiScape计算度中心性(DC),筛选得到PPI网络核心基因。
1.5 关键靶基因基因本体(GO)及京都基因与基因组百科全书(KEGG)分析
在R软件(Version 3.5.2)安装Bioconductor软件包“org.Hs.eg.db”并运行,将人参-黄芪治疗肺癌的关键靶基因转换成entrezID。然后在R软件安装“clusterProfiler”包,根据已转换的entrezID,以P<0.05,Q<0.05进行关键靶基因GO与KEGG功能富集分析,并将结果以条形图和气泡图形式输出。
2 结果
2.1 人参-黄芪活性成分和靶基因
在TCMSP数据库检索关键词“人参”“黄芪”分别获得190个和87个活性成分。然后以OB>30%和DL>0.18进行筛选,分别筛出22个人参和20个黄芪活性成分。选择“Ingredients”,获得748个人参,953个黄芪所有活性成分对应的靶基因。
2.2 肺癌相关基因
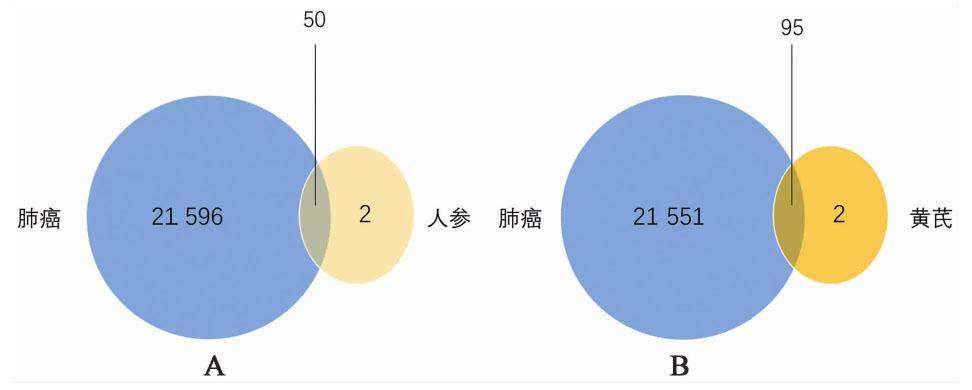
在GeneCards数据库检索“Lung Cancer”,共筛选出21 646个肺癌相关基因,然后分别与748个人参,953个黄芪对应的靶基因映射,得到50个人参,95个黄芪活性成分治疗肺癌的靶基因,见图1。
2.3 “药物-成分-靶点-疾病”网络
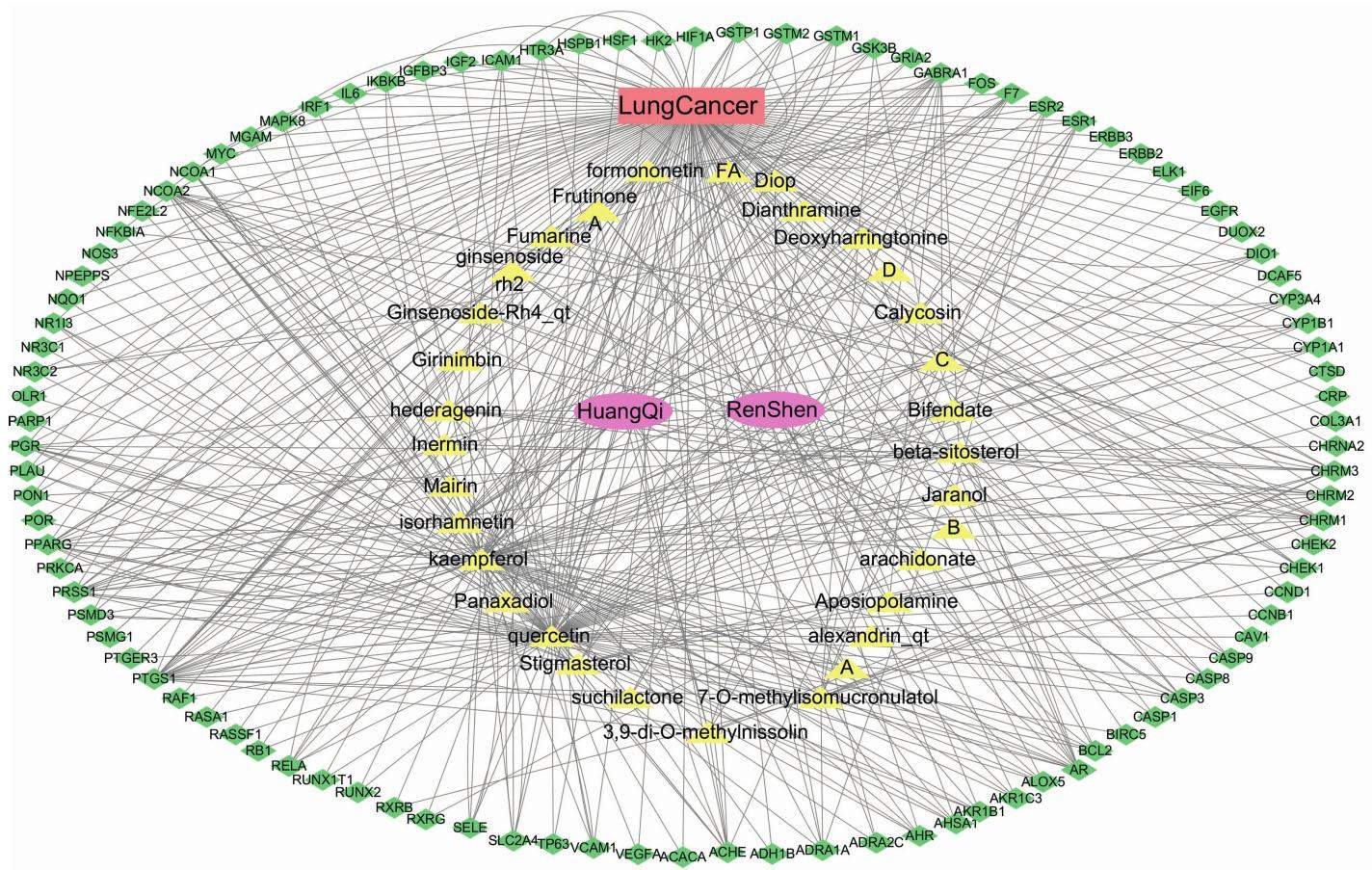
将50个人参,95个黄芪治疗肺癌的靶基因分别与22个人参,20个黄芪活性成分进行映射,建立人参、黄芪活性成分与靶基因对应关系,得到与治疗肺癌相关的17个人参和16个黄芪活性成分,见表1,以及与之对应的50个靶基因和95个靶基因,将两者合并后去重,筛出101个关键靶基因。将人参、黄芪与对应活性成分,活性成分与关键靶基因,关键靶基因与肺癌对应关系以及属性导入到Cytoscape,建立“药物-成分-靶点-疾病”网络,见图2。使用CentiScape计算活性成分DC。一个节点DC越大,说明节点在网络中越重要。Quercetin(槲皮素)为78,kaempferol(山柰酚)为70,isorhamnetin(异鼠李素)为18,7-O-methylisomucronulatol为17,beta-sitosterol(β-谷甾醇)为16,位于前5位。
| 名称 | MOLID | 药物成分 | 中文名称 | OB/% | DL |
|---|---|---|---|---|---|
| 人参 | MOL005308 | aposiopolamine | 阿朴天仙子碱 | 66.65 | 0.22 |
| MOL005321 | frutinone A | 灌木远志酮A | 65.90 | 0.34 | |
| MOL003648 | inermin | 马卡因 | 65.83 | 0.54 | |
| MOL005356 | girinimbin | 吉九里香碱 | 61.22 | 0.31 | |
| MOL000787 | fumarine | 原阿片碱 | 59.26 | 0.83 | |
| MOL005384 | suchilactone | 苏齐内酯 | 57.52 | 0.56 | |
| MOL005320 | arachidonate | 花生四烯酸 | 45.57 | 0.20 | |
| MOL000449 | stigmasterol | 豆甾醇 | 43.83 | 0.76 | |
| MOL002879 | diop | 邻苯二甲酸二异辛酯 | 43.59 | 0.39 | |
| MOL000422 | kaempferol | 山柰酚 | 41.88 | 0.24 | |
| MOL005318 | dianthramine | 石竹胺 | 40.45 | 0.20 | |
| MOL005317 | deoxyharringtonine | 脱氧三尖杉酯碱 | 39.27 | 0.81 | |
| MOL005399 | alexandrin_qt | 胡萝卜苷 | 36.91 | 0.75 | |
| MOL000358 | beta-sitosterol | β-谷甾醇 | 36.91 | 0.75 | |
| MOL005344 | ginsenoside rh2 | 人参皂苷Rh2 | 36.32 | 0.56 | |
| MOL005376 | panaxadiol | 人参二醇 | 33.09 | 0.79 | |
| MOL005348 | ginsenoside-Rh4_qt | 人参皂苷Rh4 | 31.11 | 0.78 | |
| 黄芪 | MOL000378 | 7-O-methylisomucronulatol | - | 74.69 | 0.30 |
| MOL000392 | formononetin | 刺芒柄花素 | 69.67 | 0.21 | |
| MOL000433 | FA | 富马酸 | 68.96 | 0.71 | |
| MOL000380 | (6aR,11aR)-9,10-dimethoxy-6a,11a-dihydro-6H-benzofurano[3,2-c]chromen-3-ol | (6aR,11aR)-9,10-二甲氧基紫檀烷-3-O-b-D-吡喃葡萄糖苷 | 64.26 | 0.42 | |
| MOL000211 | mairin | 白桦脂酸 | 55.38 | 0.78 | |
| MOL000371 | 3,9-di-O-methylnissolin | - | 53.74 | 0.48 | |
| MOL000239 | jaranol | 华良姜素 | 50.83 | 0.29 | |
| MOL000354 | isorhamnetin | 异鼠李素 | 49.60 | 0.31 | |
| MOL000417 | calycosin | 毛蕊异黄酮 | 47.75 | 0.24 | |
| MOL000098 | quercetin | 槲皮素 | 46.43 | 0.28 | |
| MOL000422 | kaempferol | 山柰酚 | 41.88 | 0.24 | |
| MOL000442 | 1,7-dihydroxy-3,9-dimethoxy pterocarpene | 1,7-二羟基-3,9-二甲氧基紫檀烯 | 39.05 | 0.48 | |
| MOL000296 | hederagenin | 常春藤皂苷元 | 36.91 | 0.75 | |
| MOL000379 | 9,10-dimethoxypterocarpan-3-O-β-D-glucoside | 黄芪异黄烷苷 | 36.74 | 0.92 | |
| MOL000033 | (3S,8S,9S,10R,13R,14S,17R)-10,13-dimethyl-17-[(2R,5S)-5-propan-2-yloctan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol | - | 36.23 | 0.78 | |
| MOL000387 | bifendate | 联苯双酯 | 31.10 | 0.67 |
2.4 PPI网络构建
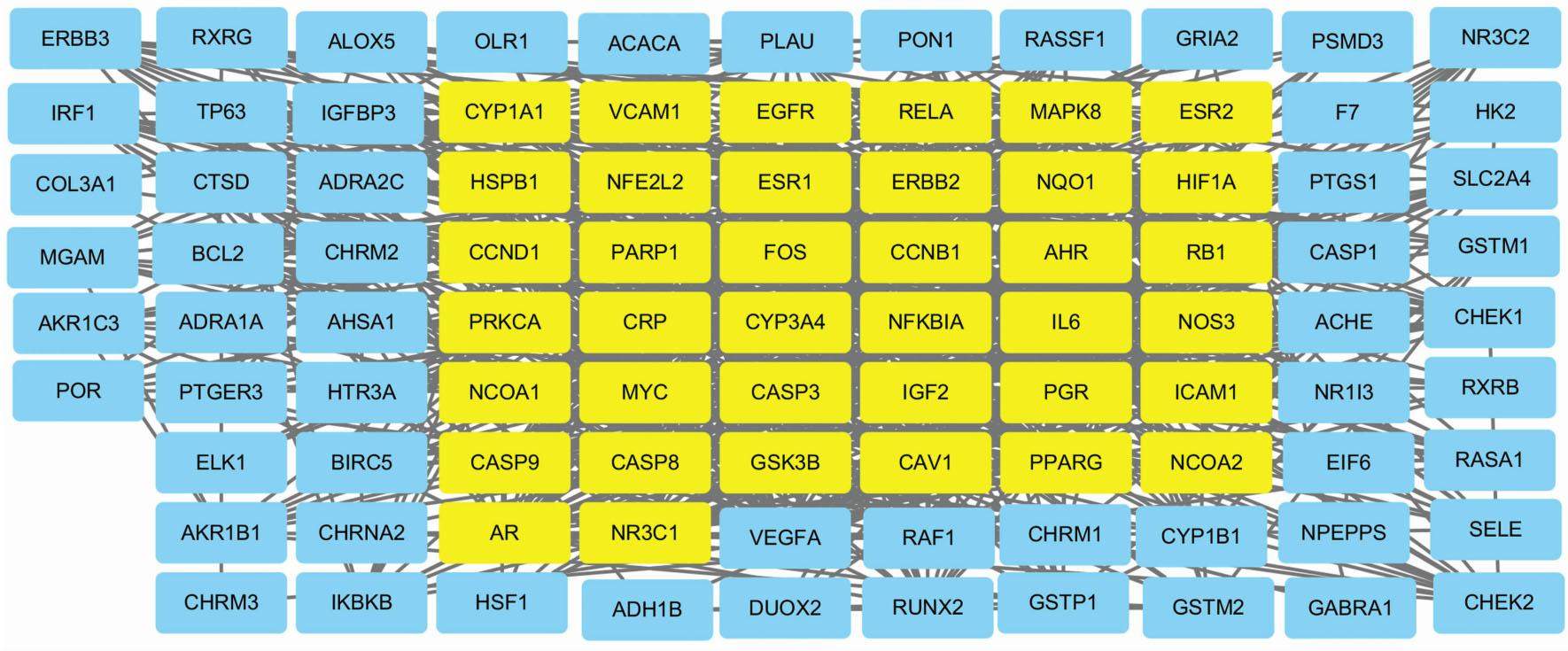
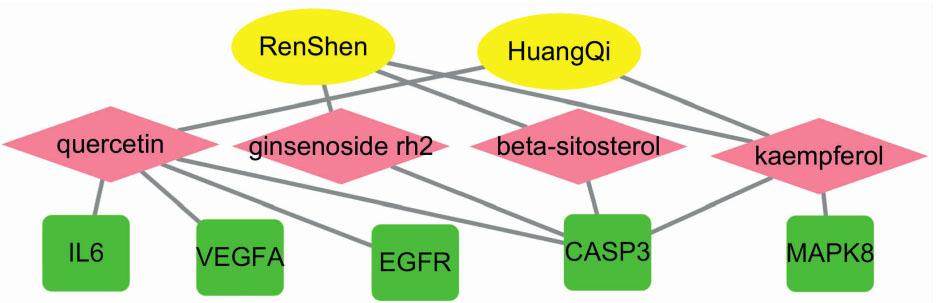
将关键靶基因输入到STRING,选择中等置信度0.400,下载PPI tsv文件导入到Cytoscape,得到96个PPI网络的基因。用CentiScape计算出DC均值为17.8,以>17.8进行筛选,得到38个核心基因,其中白细胞介素-6(IL-6)DC值为57,血管内皮生长因子A(VEGFA)为52,半胱氨酸蛋白酶-3(Caspase-3)为52,丝裂原活化蛋白激酶8(MAPK8)为51,表皮生长因子受体(EGFR)为49,位于前5位,见图3。前5位核心基因与人参-黄芪活性成分对应关系,见图4。
2.5 GO功能富集分析
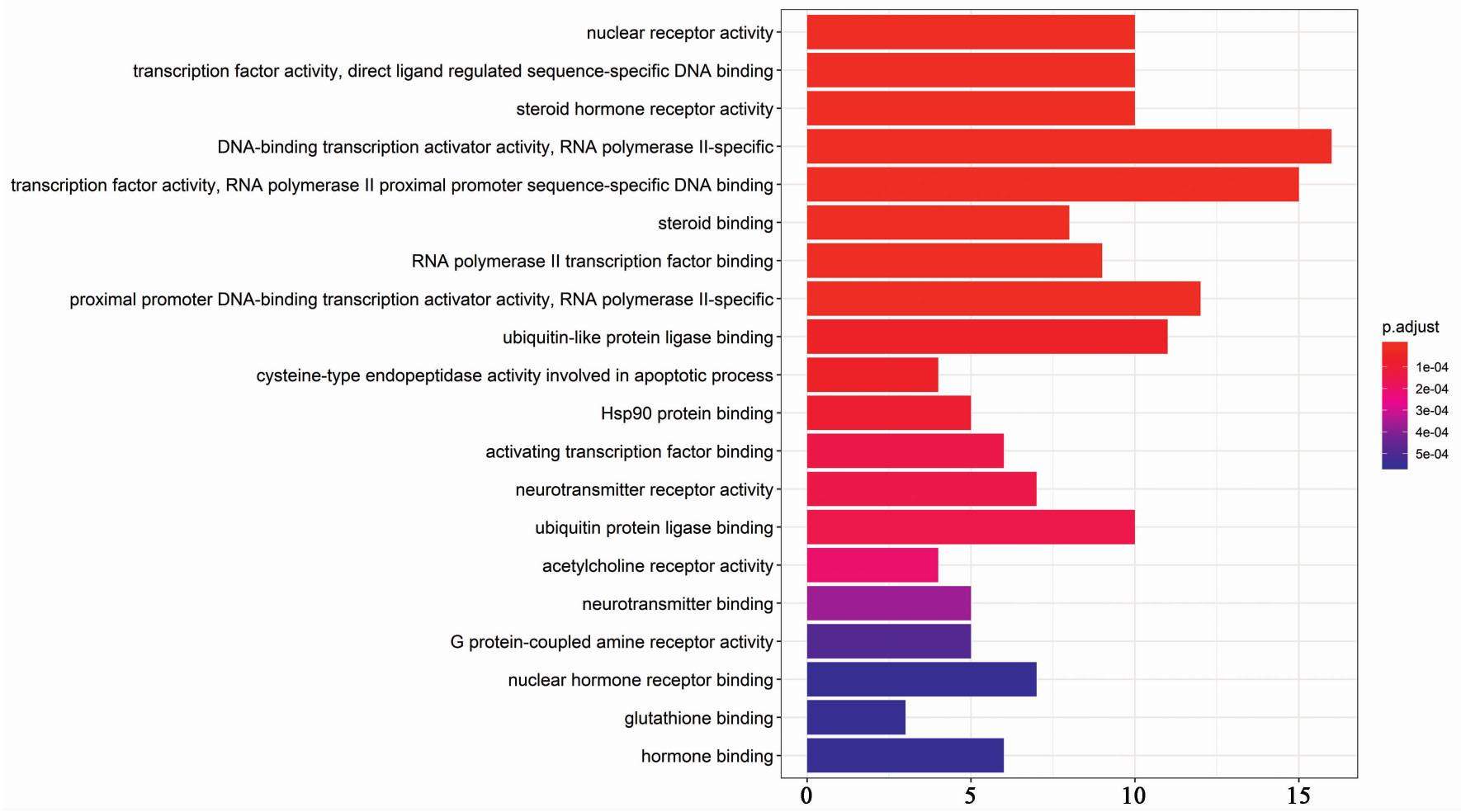
通过关键靶基因,共富集121个生物学过程和功能,根据校正后P进行排序,选择前20个进行条形图展示,见图5。人参-黄芪主要参与核受体功能、转录因子活性,类固醇激素受体活性、脱氧核糖核酸(DNA)结合转录激活因子活性和核糖核酸(RNA)聚合酶Ⅱ特异性,RNA聚合酶Ⅱ近端启动子序列特异性DNA结合,固醇类激素结合,RNA聚合酶Ⅱ转录因子结合、近端启动子DNA结合转录激活因子活性、泛素样蛋白连接酶结合、细胞凋亡、热休克蛋白90(Hsp90)蛋白结合、激活转录因子结合、神经递质受体活性、乙酰胆碱受体活性、神经递质结合,G蛋白偶联胺受体活性,核激素受体结合、谷胱甘肽结合、激素结合等。
2.6 KEGG通路富集分析
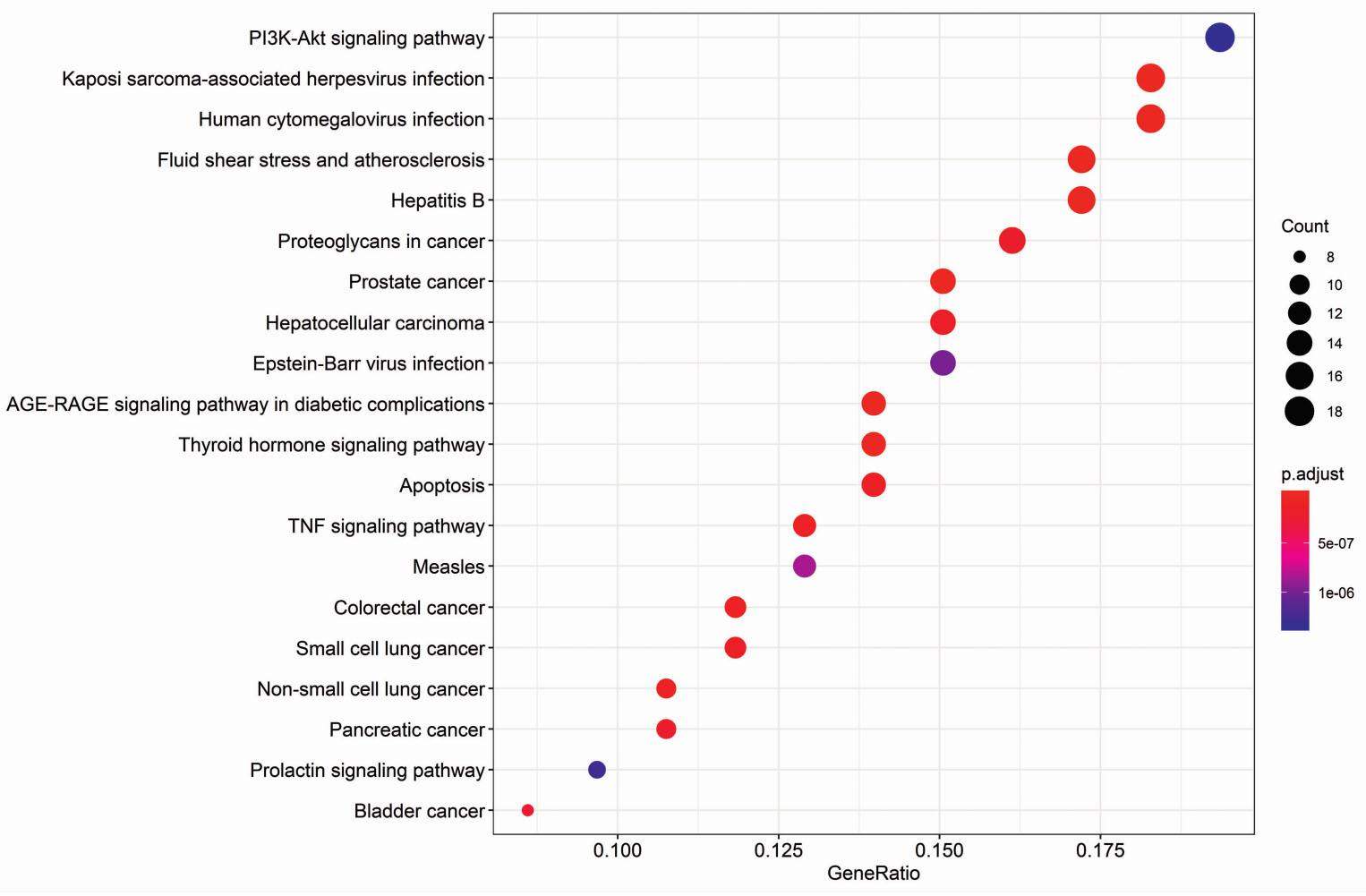
关键靶基因与KEGG通路进行映射,共富集133条通路,根据校正后P进行排序,选择前20个进行气泡图展示,见图6。人参-黄芪治疗肺癌的信号通路包括磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt),细胞凋亡、肿瘤坏死因子(TNF),p53,肿瘤蛋白多糖等信号通路,还包括前列腺癌、肝细胞癌、结直肠癌、胰腺癌、膀胱癌等其他肿瘤相关信号通路。
3 讨论
中医认为,肺癌的发生因正气先虚,无力抗邪,所谓“正气存内,邪不可干”,加之患者经手术、放化疗等治疗后,更伤正气,因此人参-黄芪补虚扶正抗癌切中肯綮。在本研究中,人参-黄芪主要活性成分包括槲皮素,山柰酚,异鼠李素,7-O-methylisomucronulatol,β-谷甾醇等。有研究表明,槲皮素通过Stat3通路抑制肺癌A549细胞增殖、迁移和侵袭[13],促进人非小细胞肺癌获得性耐药细胞株PC9细胞凋亡[14]。山柰酚可诱导人小细胞肺癌H446细胞周期阻滞和细胞凋亡[15],通过抑制雌激素受体相关受体α(ERRα)降低A549细胞侵袭和迁移,抑制上皮间质转化(EMT)[16]。异鼠李素可通过抑制Akt ser473位点磷酸化抑制PC9细胞增殖[17]。β-谷甾醇可诱导A549细胞周期阻滞于G2/M期和细胞凋亡[18]。7-O-methylisomucronulatol是黄芪特有活性成分,目前鲜有相关研究。在“药物-成分-靶点-疾病”网络中,7-O-methylisomucronulatol与过氧化物酶体增殖物激活受体γ(PPARG),雄激素受体(AR)等靶基因相关联,PPAR被作为是治疗肺癌潜在靶点[19],AR阳性表达可能与淋巴结转移和肺癌进展相关[20]。因此推测7-O-methylisomucronulatol可能有抗肺癌作用,值得进一步实验研究。
通过构建关键靶基因PPI网络,得到PPI网络核心基因,其中IL-6,VEGFA,Caspase-3,MAPK8,EGFR基因位于核心位置。IL-6基因编码IL-6蛋白,有研究认为,血清IL-6水平与非小细胞肺癌分期具有相关性[21]。VEGFA基因编码VEGF蛋白,VEGF与非小细胞肺癌局部转移以及预后相关[22]。CASP3基因编码Caspase-3蛋白,可促进细胞凋亡,在肺癌患者组织Caspase-3表达明显减弱[23]。MAPK8基因编码MAPK8蛋白,又名c-Jun氨基末端激酶1(JNK1),可以调控细胞凋亡和自噬,激活JNK1/2可抑制非小细胞肺癌发生发展[24]。EGFR是公认与肺癌发生密切的基因之一,表皮生长因子酪氨酸激酶抑制剂(EGFR-TKIs)已广泛应用于EGFR突变非小细胞肺癌治疗。
核心基因的GO功能富集主要集中在核受体功能,转录因子活性、聚合酶Ⅱ近RNA端启动子等转录调控相关功能,泛素化蛋白降解相关功能,细胞凋亡功能等。这些基本生物学过程和功能体现在人参-黄芪活性成分调节对应靶基因和具体通路过程中。关于KEGG通路富集,主要包括PI3K/Akt,细胞凋亡,TNF,p53等信号通路。许多肿瘤包括肺癌,PI3K/Akt通路处于激活状态,激活下游信号抑制细胞凋亡,获得性抵抗EGFR-TKIs的治疗[25]。TNF-α通过激活TNF信号通路促进肺癌细胞侵袭和转移[26]。p53是公认抑癌基因,p53信号通路激活可抑制A549细胞增殖[27],促进A549细胞凋亡[28]。
网络药理学基于已有中药活性成分数据库,可能存在尚未发现或鉴定的人参、黄芪活性成分。已如前述,人参皂苷Rg3,黄芪多糖已证实具有抗肺癌作用,但两者未见于“药物-成分-靶点-疾病”网络中,说明网络药理学分析结果不够全面。基于网络药理学分析得到的活性成分与靶基因具有相关性,但不能明确活性成分对靶基因调控关系。一部分中药活性成分与靶基因相互作用是通过计算机模拟得出,仍需实验加以验证。
综上所述,基于网络药理学研究方法,通过构建“药物-成分-靶点-疾病”网络,从多成分、多靶点、多通路阐释人参-黄芪作为对药治疗肺癌的作用机制,发现活性成分7-O-methylisomucronulatol,为后续深入研究提供一定参考。

