在我国心血管疾病不仅严重威胁50岁以上的中老年人健康,且呈现年轻化趋势,是严重危害人类健康最的疾病之一[1-2],寻找和解决适症药物和治疗方式尤为重要。而经皮冠状动脉介入治疗术(PCI)是目前ST段抬高型心肌梗死的主要治疗手段,可有效缓解冠状动脉狭窄及闭塞,改善心肌血流灌注[3],但仍有10%~30%患者术后出现心肌组织冠脉无复流和缓慢血流的现象[4]。缺血缺氧期间,伴随着ATP的耗竭和线粒体膜的去极化,线粒体通透性转换孔开放,线粒体功能异常。在PCI术后,大量氧气进入导致线粒体电子传递链及其他位点爆发产生活性氧,启动多种细胞内信号传导途径,促进血管炎症与凝血反应以及细胞凋亡,进而损害血管内皮细胞结构和功能,血管通透性增强,红细胞和白蛋白外漏,白细胞和血小板沿内皮细胞滚动黏附,形成斑块造成血管内狭窄,导致心肌缺血。而介入后的损伤没有引起人们足够重视,西药治疗局限性高,中药具有多靶点整合干预的优势,在PCI围手术期使用广泛,发挥抗氧化应激,改善内皮功能,扩张血管,防止再次栓塞等作用,研究寻找可应用于抗氧化应激、改善PCI术后伤损伤的药物前景广阔。本研究总结了在PCI围手术期与氧化应激相关的酶及分子通路,归纳了中医药在抗氧化应激方面的研究进展,旨在为PCI及实验研究提供参考。
1 氧化应激在冠状动脉介入损伤中的作用
1.1 冠状动脉介入治疗的概况
心血管疾病是目前严重危害人类健康疾病之一,具有发病率高、致残率高、致死率高、复发率高以及并发症多的特点。目前临床上采用溶栓治疗或PCI减少心肌梗死面积和改善临床疗效。PCI是应用特制的带气囊导管,经外周动脉(股动脉或桡动脉)送到冠脉狭窄处,充盈气囊扩张狭窄的管腔,并放置支架,改善血流防止再狭窄。国家心血管疾病医疗质量控制中心发布最新冠心病介入治疗情况:2018年,我国全年冠心病介入例数为915 256例,患者平均植入支架数为1.46个,与2017年相比,2018年PCI病例数增长了21.5%[5]。可见接受PCI治疗患者人数众多,但由于各种因素的综合作用,支架植入处易形成血栓,导致冠状动脉管腔完全性或不完全性阻塞,患者的五年复发率为15%~20%,死亡率高达5%~45%[6]。从最初1997年的经皮腔内冠状动脉成形术(PTCA),到金属裸支架(BMS),药物洗脱支架(DES),直至生物可吸收支架(BRS),不断迭代的最新支架研发显著改善了PCI后晚期血栓和再狭窄,然而仍需相关药物的辅助治疗,改善患者症状,提高生存率。
1.2 氧化应激概述
氧化应激是指细胞或细胞器中氧化剂的水平和类型平均显著超过基态/静息/稳态水平,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,造成细胞或组织损伤的一种病理反应。氧化应激产生的主要物质基础就是活性氧(ROS),活性氧包括:①自由基活性氧:超氧阴离子自由基(O2·-)和羟基自由基(·OH);②非自由基活性氧:过氧化氢(H2O2)和单线态氧(1O2);③其他:一氧化氮(NO),金属氧复合物等[7]。自由基活性氧和非自由基活性氧可以通过酶和非酶机制相互转化(取决于相关过程的ΔΨ)。活性氧存在于许多疾病的发生发展过程中,其生成和清除间的平衡受到高度控制,且始终遵循着“过量有害”的原则[8]。在正常情况下机体内ROS的产生和清除处于动态平衡状态,可触发细胞保护信号通路,清除异常的细胞或线粒体,调节细胞周期。当多种内源性或外源性有害物质侵入机体时,平衡状态被打破,ROS大量产生超过机体内抗氧化系统的清除能力,机体产生氧化应激,引起DNA的氧化损伤和蛋白质的表达异常,产生细胞毒效应并最终对机体造成不可逆的损伤。
1.3 氧化应激在PCI损伤中的作用机制
冠状动脉介入治疗的过程实际就是心肌缺血再灌注的过程,损伤发生在缺血和再灌注2个阶段,每个阶段都有多种因素可能造成冠状动脉和心肌组织的多重损害。缺血再灌注损伤机制见图1。缺血期间,氧气和营养物质的缺失破坏了氧化磷酸化,导致线粒体膜的去极化和ATP的耗竭,ATP的消耗还会造成Na+-K+-ATP酶功能失常,从而导致细胞内Na2+超载及随后的细胞浆中Ca2+的超载,线粒体通透性转换孔开放,细胞内pH值降低[9]。再灌期间,ROS是造成损伤的主要原因,ROS来源于再灌注时重新激活的电子传递链、内皮细胞中的黄嘌呤氧化酶以及中性粒细胞中的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶等。首先,ROS爆发所产生的过氧化物可损害DNA,导致脂质过氧化,影响细胞膜结构的完整,启动多种细胞内信号传导途径,引发炎症因子的释放,选择素和黏附因子的高表达,进而引起细胞损伤,最终导致细胞凋亡。其次,ROS增多可损害内皮细胞结构和功能,肌动蛋白解偶联(F-actin),内皮细胞连接蛋白磷酸化且排列紊乱,血管通透性增高,红细胞和血浆蛋白外逸,组织水肿。最后,白细胞和血小板沿内皮细胞滚动黏附,形成斑块造成血管内狭窄,产生的不稳定斑块在缺血再灌时破裂,随血流运动可能会导致远端微血管栓塞,造成微循环障碍。总之,再灌注期ROS的激增可导致多种损害,如氧化应激,炎症,Ca2+超载,线粒体功能障碍,内质网功能障碍,白细胞募集,细胞凋亡,内皮损伤等发生,这些加重了心脏功能的障碍,最终引起心肌收缩功能障碍,心脏衰竭[10-12]。
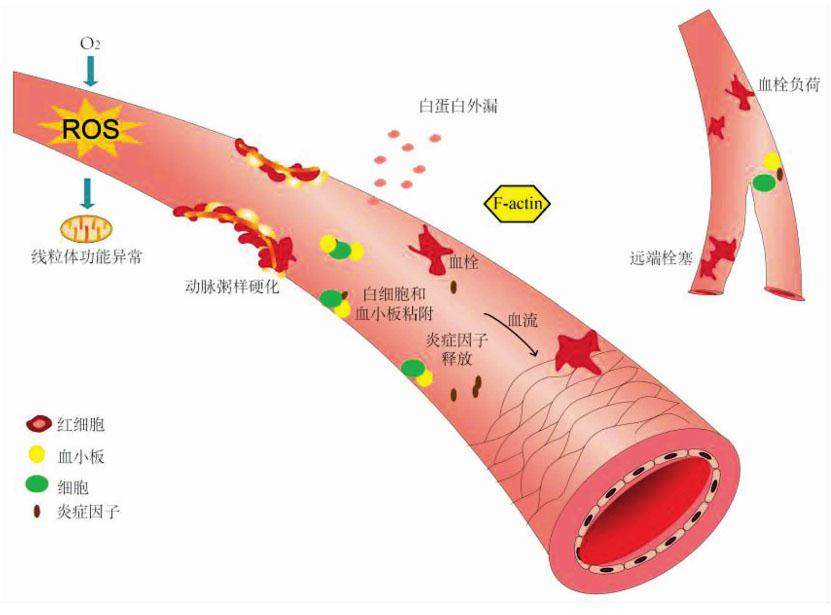
2 冠状动脉介入损伤相关的氧化应激分子机制
氧化应激在调节体内动态平衡和疾病发生发展等许多方面发挥重要作用,经研究证实氧化应激是心肌缺血再灌注的重要发病机制之一[13],且与线粒体能量代谢紊乱、炎症反应等密切相关。氧化应激参与缺血性心脏病、糖尿病、高血压、神经退行性疾病、自身免疫性疾病、癌症、外伤性远隔脏器损伤以及肾小管上皮损伤等多种疾病过程。在细胞中,线粒体、内质网和烟酰胺腺嘌呤二核苷酸氧化态/烟酰胺腺嘌呤二核苷酸还原态(NAD+/NADH)的比率等都能影响活性氧(ROS)的产生和清除的平衡[14]。线粒体是ROS生成和影响的主要场所之一[15-16],线粒体中ROS的产生是由于在呼吸链电子传递过程中发生了电子渗漏并还原氧分子而形成的。受线粒体膜电位的影响,线粒体通透性转换孔道(MPTP),线粒体内膜阴离子通道(IMAC)的激活会引起线粒体内外氧化还原环境的改变,导致ROS的释放,较长时间的MPTP开放可能导致ROS爆发,线粒体损伤,细胞凋亡[17]。
2.1 PCI中ROS的主要产生位点
2.1.1 线粒体电子传递链复合物
复合物I(Complex I)别称NADH脱氢酶,其中黄素单核苷酸(FMN),铁硫中心N2和辅酶(CoQ)是产生ROS的3个重要位点[18]。在缺氧条件下,引起还原型辅酶/辅酶(CoQH2/CoQ)比值的增加,导致复合物I的电子通量减慢和N2 Fe/S簇的还原形式的寿命增加,电子泄漏和O2·-的生成,产生氧化应激。普遍的观点认为复合体I缺陷是线粒体中ROS的主要来源,至少40%的线粒体疾病与复合体I亚单位的突变有关[19]。复合物I缺陷与心肌病[20]、白内障[21],亚急性坏死性脑脊髓病[22]、运动不耐受、乳酸中毒、卒中样发作[23],多种神经退行性疾病[24]等广泛的病理类型有关。线粒体呼吸链电子传递ROS的生成过程见图2。
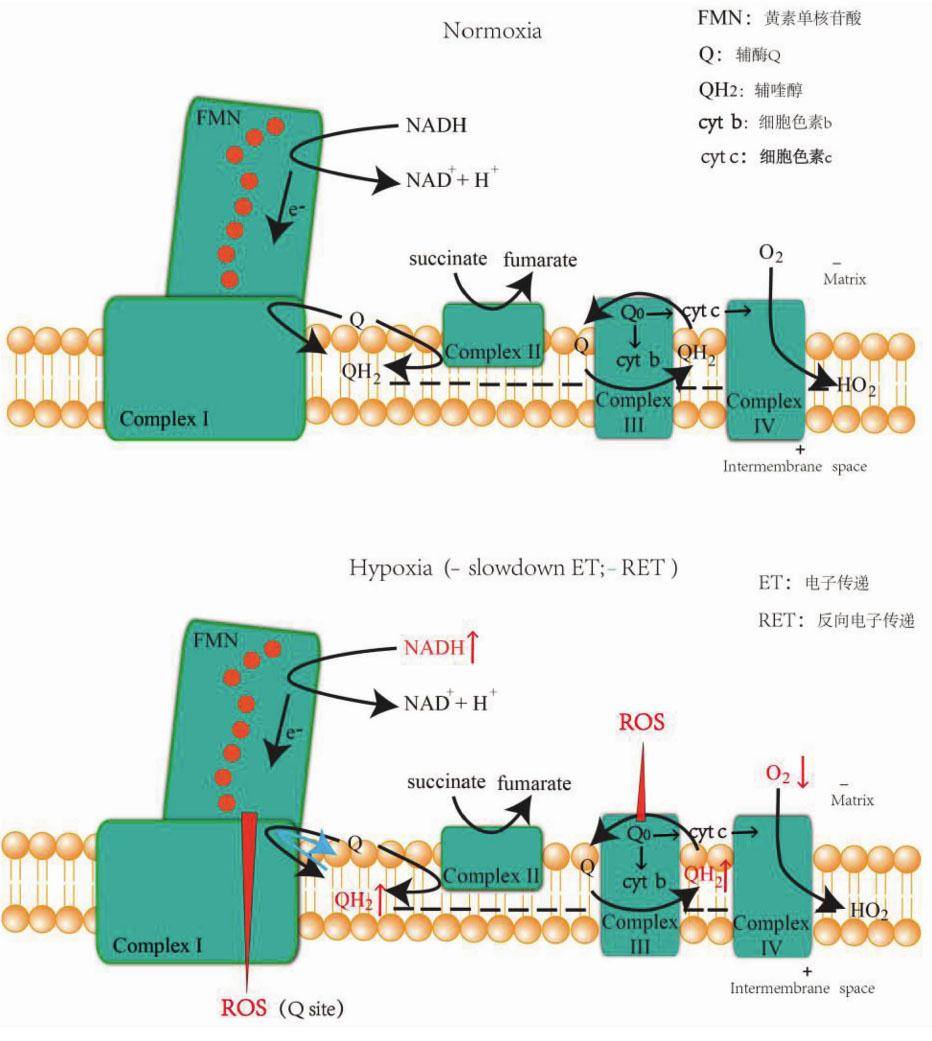
复合物Ⅱ(Complex Ⅱ)别称琥珀酸脱氢酶(SDH),是唯一一个即属于三羧酸循环又属于电子传递链的酶,将琥珀酸氧化为富马酸,为复合物Ⅱ提供电子。但复合物Ⅱ不是线粒体中活性氧产生的主要位点。其底物琥珀酸是免疫信号中的一种代谢物,在炎症过程中稳定缺氧诱导因子-1(HIF-1a)并促进白细胞介素-1β(IL-1β)的产生[25]。
复合物Ⅲ(Complex Ⅲ)别称CoQH2-细胞色素c还原酶,是线粒体中ROS的主要来源,其中细胞色素b[26],和喹醇(Qo)[27]是产生ROS的重要位点。复合物Ⅲ通过Q循环机制进行电子传递,一方面,辅喹醇(QH2)通过铁硫簇蛋白(ISP)传递电子给细胞色素c,进一步将电子传递给细胞色素Ⅳ;另一方面,QH2通过Qo位点将电子传递给细胞色素b,进而将电子传递回Q循环系统。当受到受到抗霉素A等抑制时,Qo位向细胞色素b传递的电子增多,QH2增多导致ROS增多。线粒体复合物Ⅲ的损坏会降低线粒体呼吸链连接代谢,导致血管内皮细胞增殖减少,并损害血管生成[28]。此外,T细胞需要线粒体复合体Ⅲ来维持免疫调节基因的表达和抑制功能[29]。因此,复合物Ⅲ在血管生成、免疫、炎症方面起着重要的作用。
2.1.2 NADPH氧化酶
NADPH-氧化酶(NOX)存在于吞噬细胞和B淋巴细胞的质膜上,通过排出ROS参与吞噬细胞的活动。到目前为止,已鉴定出NOX的7种异构体,即NOX1,NOX2,NOX3,NOX4,NOX5,DUOX1,DUOX2,其中NOX4是该家族中唯一具有线粒体定位的成员[30]。NADPH氧化酶的激活很复杂,其活性受蛋白激酶、磷脂酶、肌动蛋白、皮质肌动蛋白(皮动蛋白)、冠蛋白和脂质筏等的调节。ZHANG等[31]研究发现,心肌缺血再灌注时,NOX2基因表达显著上调,伴随活性氧水平升高,NOX4基因表达虽然有增加趋势,但未达到显著水平,提示NOX2在介导心肌缺血再灌注氧化损伤中起主要作用。NADPH-氧化酶(尤其是NOX4)在血管生成[32]和动脉粥样硬化、糖尿病损伤[33]及其他病理过程中的发挥重要作用。
2.1.3 单胺氧化酶
单胺氧化酶(MAO),主要位于线粒体膜外表面,结缔组织中也有存在[34]。MAO产生H2O2的活性可能比线粒体内的位点都要高,是ROS的另一来源[7]。其在大脑和周围神经组织中催化一些生物体产生的胺,氧化脱氨产生H2O2[35]。MAO在脑[36]、肾[37]和心脏[38]缺血再灌注过程产生H2O2中发挥重要作用。
2.1.4 p66shc
p66shc是Shc蛋白家族的重要成员之一,能被蛋白激酶Cβ(PKCβ),Jun氨基末端激酶(JNK)和p53等激活,促进线粒体产生ROS[39]。Migliaccio等[40]在1999年首先报道了p66shc可以调控寿命和氧化应激。p66产生的ROS可调节胰岛素信号通路,T细胞和B细胞信号通路,调节NOX4的表达和活性,并激活NF-κB,从而增强氧化应激和炎症反应。XIAO等[41]发现,通过表观遗传调控p66shc介导的氧化应激途径可抑制S-腺苷高半胱氨酸水解酶诱导的内皮功能障碍。
2.1.5 α-甘油磷酸脱氢酶
α-甘油磷酸脱氢酶位于线粒体内膜外表面。Mrácek等[42]研究发现,其活性在肝、心和脑中相对较低,而在棕色脂肪组织中较高。α-甘油磷酸脱氢酶可通过Ca2+水平的升高激活H2O2的产生,该机制在很大程度上独立于生物能状态,甚至可以在受损的、功能丧失的线粒体中进行[43]。
2.1.6 电子转移黄素蛋白(ETF)和ETF-辅酶Q氧化还原酶(ETF-QO)
ETF接受线粒体黄素蛋白脱氢酶的电子,然后传递至ETF-QO中,进而传递给辅酶Q,用ATP的生成[44]。当受外界刺激时,ETF和ETF-QO中电子传递受损,导致辅酶Q的功能混乱,产生ROS。ETF-QO缺陷是由FAD-CoQ界面周围的单点突变引起的,并导致一种被称为多种酰基辅酶A脱氢酶缺乏症(MADD)的人类遗传疾病,这是以脂肪和蛋白质代谢受损为特征的,可引发全身虚弱、肝脏肿大、心力衰竭等[45]。Reid等[46]研究发现,ETF-QO缺陷引起线粒体功能障碍和脂质过氧化物积累,并削弱了细胞的脂肪酸氧化能力。
2.1.7 一氧化氮合酶(NOS)
NOS是一种同工酶,有神经元型一氧化氮合酶(nNOS),内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶(iNOS)3种亚型。一氧化氮(NO)是一种在心血管生理和病理中起关键作用的信号分子[47]。酶或非酶来源的O2.-和NO相结合会产生过氧亚硝酸根(ONOO-),ONOO-是一种与细胞损伤、心肌收缩力降低和充血性心力衰竭有关的氧化剂[48]。NOS与神经性疾病、糖尿病、心血管疾病等多种病理过程有关。
2.2 PCI中关于ROS的主要分子通路
氧化应激可涉及多种信号通路的激活,包括Kelch样环氧氯丙胺相关蛋白1(Keap1)/核转录因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE),Nrf2/血红素加氧酶-1(HO-1),磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt),核转录因子-κB(NF-κB),JNK以及去乙酰化酶(SIRT)信号通路等,当ROS水平超过细胞清除能力时可导致氧化应激,并激活促炎途径,继而导致内皮功能障碍和心肌再灌注损伤的形成。
2.2.1 Nrf2信号通路
Keap1/Nrf2/ARE信号通路可以调节抗氧化基因的转录,维持细胞内稳态和毒素水平[49-50],Nrf2的主要作用是调节细胞抵抗ROS。在正常条件下,Nrf2存在于细胞胞质中,与Keap1蛋白结合,并通过Keap1介导的泛素化和26S蛋白酶体介导的降解维持在低水平。当细胞受到氧化应激刺激时,Keap1中的SH-1基团构象改变及Nrf2磷酸化,导致两者解偶联,Nrf2释放入细胞核内,与Maf蛋白二聚化,并与ARE结合激活超氧化物歧化酶(SOD),过氧化氢酶(CAT)及Ⅱ相解毒酶,清除ROS等有害物质。DENG等[51]研究表明,Tsg101水平的升高可能通过激活p62/Keap1/Nrf2信号通路对心肌缺血再灌注(IR)损伤具有保护作用。Keap1/Nrf2/ARE信号通路参与慢性疾病中的抗氧化抗炎过程,如运动、糖尿病、心血管疾病、癌症、神经退行性疾病、中风、肝肾系统等方面[52]。
HO-1是受Nrf2调控的一种Ⅱ相解毒酶,Nrf2/HO-1通路参与抗氧化应激过程。HO-1易被多种氧化应激相关刺激诱导激活,与细胞色素P450结合,血红素正中位α碳链断裂,产生了胆绿素、一氧化碳和Fe2+,在胆绿素还原酶的作用下胆绿素随后转化成胆红素,这3种产物都有抗氧化损伤的作用[53]。同时,HO-1对于NADPH-氧化酶有调节作用,可以抑制NADPH-氧化酶衍生的氧化应激反应[54]。Nrf2/HO-1通过发挥抗炎、抗氧化、减少线粒体损伤、调节钙离子内流、调控细胞凋亡、自噬等作用[55],抵抗氧化应激损伤。YE等[56]研究表明,潘尼卡拉金通过激活Nrf2/HO-1信号通路降低阿霉素诱导的心脏毒性,从而保护H9c2心肌细胞。Nrf2/HO-1在急性呼吸窘迫综合征、心肌缺血再灌注损伤、阿尔茨海默症、内毒素血症、急性肾损伤、血液系统的氧化应激性疾病中发挥作用。许多中药单体如:羟基红花黄色素,丹参素,白藜芦醇都能通过Nrf2/HO-1改善心肌缺血再灌注损伤[57]。
2.2.2 PI3K/Akt信号通路
PI3K/Akt信号通路参与细胞物质代谢、基因表达、葡萄糖转运、增殖和凋亡等多种细胞功能的调节,可直接被氧化应激激活,发挥抗氧化应激和改善细胞凋亡的作用。PI3K激活后磷酸化形成PIP3来激活Akt,Akt可以抑制细胞凋亡,促进细胞生长。Akt有许多底物、环路和分支,作用机制复杂,广泛参与多种人类疾病,包括癌症、糖尿病、心血管疾病、神经疾病、肠缺血再灌注过程[58-59]等。ZHAO等[60]研究发现,PI3K/Akt/糖原激酶3β(GSK3β)信号通路可能是芪苈强心胶囊在体内和体外保护氧化应激后心肌细胞凋亡的一种新的靶向途径,芪苈强心通过激活PI3K/Akt信号通路使GSK3β受体失活而下调drp1可以抑制线粒体裂变,上调B淋巴细胞瘤-2(Bcl-2)的表达,下调Bax,细胞色素c,凋亡酶激活因子(Apaf-1),活化半胱氨酸蛋白酶(cleaved-Caspase)-9,cleaved-Caspase-3的表达,抑制氧化应激诱导的心肌细胞凋亡。Dawoud等[61]研究发现,对氧磷酶2通过PI3K/Akt/GSK3β风险途径调节线粒体功能和氧化应激,从而保护急性心肌缺血再灌注损伤。此外,SHI等[62]研究发现,肾素-血管紧张素系统抑制剂通过PI3K/Akt/mTOR途径减轻氧化应激诱导的人冠状动脉内皮细胞功能障碍。
2.2.3 NF-κB信号通路
NF-κB是一种广泛表达的转录因子,介导细胞从生长、炎症、宿主免疫、凋亡等过程,与氧化应激、炎症反应、免疫应答等过程密切相关[63]。NF-κB信号通路是由细胞因子、紫外线及ROS等细胞外的刺激引起的,细胞外信号因子与细胞膜上的受体结合,开启了一连串下游的反应。受体蛋白接受刺激后先活化IκB激酶(IKK),IKK会激活IκB亚基调节位点的丝氨酸磷酸化,使得IκB亚基被泛素化修饰,进而被蛋白酶降解,从而释放NF-κB二聚体,导致细胞损伤[64]。NF-κB参与肿瘤[65]、神经系统疾病[66]、衰老[67]以及心血管疾病等过程。Park等[68]研究发现,NF-κB介导的炎症反应在血管内再狭窄的发生和发展中起关键作用,NF-κB途径可以诱导激活物蛋白1(AP-1)高表达进进而导致神经节炎性反应,可能诱发血管痉挛。Nataliyu等[69]研究发现,NF-κB途径还可以激活白细胞介素-1(IL-1),IL-2,IL-8等炎性细胞因子,可能导致血管内皮损伤和凋亡,并可能促进内皮细胞炎症反应。此外邱立强等[70]还发现,NF-κB途径还可能诱导平滑肌细胞(VSMCs)迁移至内膜并过度增殖而导致的血管再狭窄。
2.2.4 JNK信号通路
丝裂原活化蛋白激酶(MAPK)可分为4个亚族:ERK,p38,JNK和ERK5。JNK是MAPKs中的一个亚类,在炎症与细胞凋亡等应激反应中起重要作用,参与多种病理生理过程如糖尿病、冠心病、缺血再灌注损伤、慢性炎症、神经退行性疾病等[71-72]。ROS激活JNK能诱导内源性和外源性凋亡信号通路。ROS可以激活ASK1,激活JNK,引起FoxO1核转位,上调FoxO1的表达,调控细胞氧化应激。在ROS和JNK之间可能存在1个正反馈效应,ROS可以促进JNK的活化,活化的JNK反过来刺激产生更多的ROS。JNK/Sab/Src/Ros信号通路可以抑制电子传递链,使线粒体ROS生成增加,引起细胞凋亡。ZHANG等[73]研究表明,缺氧/复氧导致H9C2细胞线粒体中JNK/Sab/Src/Ros信号通路的激活,导致线粒体氧化应激。抑制线粒体上Sab蛋白介导的p-JNK的表达,降低了Src的去磷酸化程度,减少了线粒体中ROS的产生,减轻了线粒体中的氧化应激。此外,易登良等[74]研究表明,硫氢化钠可能通过作用于JNK/FoxO1/Bcl-2通路抗氧化应激,抑制细胞凋亡,发挥糖尿病心肌病的心脏保护作用。
2.2.5 SIRT家族信号通路
Sirtuins家族由7种蛋白质(SIRT1~SIRT7)组成,在新陈代谢中起着重要调节作用,SIRT1是Sirtuins家族中研究最多的成员[75]。过氧化物酶体增殖物激活受体γ共激活因子-1(PGC-1α)及其下游转录因子即核呼吸因子1(NRF1)和线粒体转录因子A(TFAM),他们是调节线粒体生物合成的关键因子。SIRT1通过去乙酰化激活PGC-1α,使其下游表达增加,改善线粒体功能,减少氧化应激和细胞凋亡[76]。SIRT1调节通路参与糖尿病肾病[77]、溃疡性结肠炎[78]、心血管疾病[79]的发生发展过程,并起到保护作用。SIRT1在人内皮细胞中高度表达,SIRT1缺乏导致炎症、氧化应激、泡沫细胞形成增加,NO产生受损和自噬,从而促进血管老化和动脉粥样硬化[80]。SIRT3具有去乙酰化、调节能量代谢、清除氧自由基、参与细胞凋亡作用,与心脏肥厚、动脉粥样硬化、脑卒中等相关[81]。Jamar等[82]研究发现,褪黑素通过SIRT3-SOD2依赖机制改善母体肥胖相关的氧化应激。此外,Hyeong等[83]研究发现,SIRT6通过减少小鼠的氧化应激来保护肝脏免受酒精诱导的组织损伤。
2.2.6 其他分子通路
氧化应激是一个多分子、多通路的复杂过程,各通路之间不是相互独立,而是相互关联作用的,更深层的分子机制也有待于进一步的发现。除上面提到的分子通路外,还有许多通路在心血管氧化应激中起着重要的作用,如mTOR信号通路[84-85],TXNIP/Redd1信号通路[86],S100A8/A9信号通路[87]等。
3 冠状动脉介入损伤的中医认识及防治
我国2018年冠心病介入人数已达到91万例,但是心血管疾病的死亡率不降反增,就是介入后的损伤缺少积极治疗。西医抗凝、抗脂等常规治疗的效果不能满足临床需求,而中医药多靶点整合干预具有优势,可以适时地提供帮助,中西医结合治疗越来越受到人们的关注。
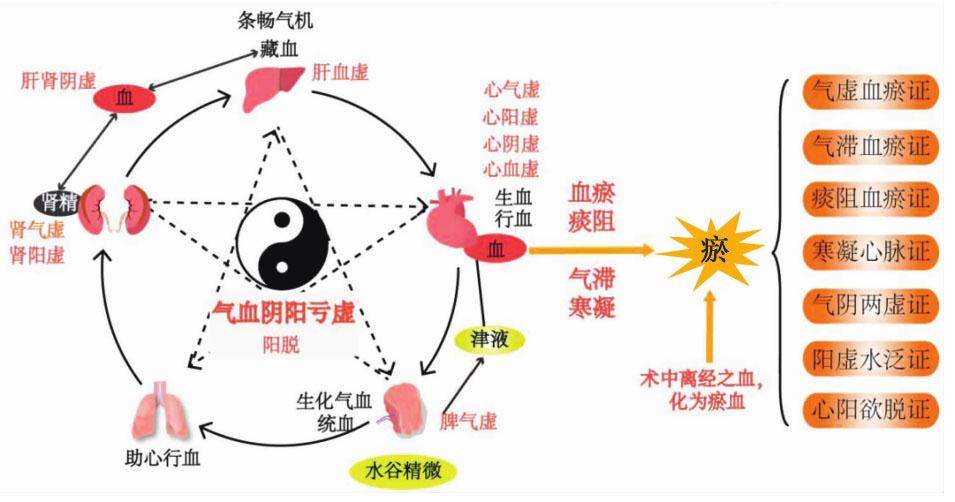
目前,中医将PCI术后纳入“胸痹”“心痛”“真心痛”范畴,清代王清任《医林改错》云:“元气既虚,必不能达于血管,血管无气,必停留而瘀”。中医气血、阴阳、五脏三者互有关联,气为阳,血为阴,气血的生成与运行与五脏的功能密切相关。心为五脏六腑之大主,具有生血、行血的功能,可以“奉心化赤”生成血液,并推动着血液的运行。肝藏血并可将多余血液转化为肾精,肝主疏泄,可通调血脉,升降气机。脾运化水谷精微产生诸气与津液,津液与营气入心化生为血液,脾主统血,使血液行于脉内。肺主一身之气,气能生血,气旺则生血功能亦强,可助心行血。肾藏精化生为元气,元气转化生诸气,精生髓,精髓能化生血液,藏于肝中,故有血之源头在于肾之说。五脏存在着“一损俱损”的关系,脏器的虚损会影响气血的生成与运行,造成气虚血瘀,从而造成机体虚损。
邓铁涛教授提出病机特点为“本虚为主,兼有邪实”,本虚以脏腑气血阴阳亏虚为主,标实以血瘀、痰阻、气滞、寒凝多见。常见气滞血瘀证、气虚血瘀证、痰瘀互阻证、寒凝心脉证、气阴两虚证、阳虚水泛证、心阳欲脱证等中医证候[88-89]。他认为PCI有“破血”的作用,属于中医“祛邪”治法,使原本闭塞的经络得以开通,同时又兼具破血的作用,但手术会导致人体正气耗伤,不足运血,气血不能调和,继而成瘀[89]。陈可冀教授通过临床试验观察发现活血化瘀中药对冠状动脉腔内扩张术后再狭窄的防治有明显作用[90-91]。阮士怡教授提出“扶正法”,通过益肾健脾、补气活血以气旺血行畅达[92]。此外,中医综合治疗对PCI术后护理康复方面同样具有重要作用,如给予情志调节、浴足、耳穴贴压、针灸按摩、食疗等[93-94]。传统中医药治疗能够显著改善PCI前后冠心病患者的心肌缺血再灌注及心功能指标,帮助患者术后恢复,临床疗效显著。
4 冠状动脉介损伤的中药防治进展
中医药是我国的宝库,中药研究是建国以来我国心血管药理学研究的主要课题之一,并取得一定成就。中医药治疗目前主要采用益气活血法、芳香温通法、祛瘀止痛法等。常见的治疗心血管疾病的中药复方有复方丹参滴丸、复方丹参片、冠心二号、通冠胶囊、芪苈强心胶囊、芪参益气滴丸、参芪四物汤、生脉散和通心络等。一些注射液也用于治疗心脑血管疾病,例如丹红注射液、参附注射液、注射用丹参多酚酸、血必净注射液、血塞通注射液和益气复脉注射液。此外,人参、丹参、黄芪、三七、川芎、红花等传统中药也具有良好的疗效。有研究报道,丹红注射液可改善不稳定型心绞痛患者临床症状,有效清除自由基,抑制氧化应激,抑制PCI围术期炎症反应,具有保护缺血心肌的作用[95-96]。在PCI术后患者通过服用中药,可预防血管的再次栓塞,既减轻了患者的经济负担,又改善患者的症状,因而研制价廉效高的中药以改善PCI术后损伤很有意义。
4.1 单味药、有效成分
4.1.1 红花
红花为菊科植物红花(Carthamus tinctorius L.)的干燥管状花,含有大量的黄色素、总黄酮和挥发性物质,具有活血通经,散瘀止痛的功效。羟基红花黄色素A(HSYA)是从红花中提取得到的水溶性黄色素,属单查尔酮苷类结构的化合物,具有活血、化瘀、通脉的功效。现代药理学实验证明,红花具有广泛的药理活性,尤其是心脑血管方面的活性,可用于心绞痛、心肌梗死损伤、脑缺血再灌注损伤、动脉粥样硬化、心肌细胞氧化损伤的治疗。
红花具有抗凝[97]、抗心肌缺血[98]、保护血管内皮细胞[99]、抗氧化应激[98]等药理作用,广泛应用于心血管疾病,在PCI术后通过合理使用红花注射液等中药制剂来活血化瘀,减小氧化应激损伤和血管阻塞等风险。ZHOU等[100]通过建立大鼠缺血再灌注模型和H9c2心肌细胞缺氧复氧模型,发现HSYA通过抑制JAK2(由AG490)/STAT1(由S1491)信号通路和减少cTnI,MDA,IL-6和LDH的释放来增强的抗氧化能力作用,减轻心肌损伤,此外,HSYA还可以抑制细胞Caspase-3活性和降低Fas,FasL和Bax的表达水平,抑制细胞凋亡,抗心肌缺血,起到心脏保护作用。HU等[101]研究发现HSYA可增强HO-1的表达,Akt的磷酸化及Nrf2的易位,通过Akt/Nrf2/HO-1信号通路增强抗氧化能力及抗细胞凋亡作用起到对心脏的保护作用。由此可见,红花可通过JAK2/STAT1,HO-1等信号通路发挥抗氧化应激作用,减少细胞凋亡,来抵抗心肌缺血,参与心脏保护作用。
4.1.2 丹参
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎,具有活血通络、祛瘀止痛、凉血消痈的功效,主要化学成分为丹参酮、丹参酚酸类及挥发油。中医有“一味丹参,功同四物”之说,现代药理学实验也证明,丹参具有广泛的药理活性,临床上常用于治疗冠心病及缺血性脑血管疾病,如心绞痛、动脉粥样硬化、心肌缺血再灌注损伤、脑缺血再灌注损伤、微循环障碍等。
丹参具有保护血管内皮细胞[102]、抗心肌纤维化[86]、抗心律失常、抗氧化应激[103]、改善血管微循环[104]等药理作用,复方丹参滴丸和注射用丹参多酚酸等许多丹参制剂在心血管疾病方面具有广泛应用,是活血化瘀药的典型代表,改善了PCI围术期患者的不适症状。丹参主要化学成分为脂溶性的二萜醌类化合物和水溶性的酚酸类成分,丹参酮ⅡA是丹参中的脂溶性成分,通过激活PI3K/Akt-eNOS通路,磷酸化Akt和eNOS水平升高和调节MPTP的开放保护心肌免受缺血再灌注损伤[105]。丹酚酸A是丹参中的水溶性成分,可减小心肌梗死面积,降低血清cTnT和CK-MB水平,抑制二磷酸腺苷诱导的血小板聚集,降低IL-1β和TNF-α活性,减少缺血心肌细胞肿胀和炎性细胞浸润,增加NO水平,对大鼠心肌缺血再灌注损伤具有保护作用[106]。由此可见,丹参可保护心肌免受缺血再灌注损伤。
4.2 中药复方防治进展及机制
芪参益气滴丸由黄芪、丹参、三七、降香4味中药材组成,具有益气养血、活血化瘀、行气止痛的功效,是2003年国家食品药品监督管理局批准的治疗心功能不全的复方中药,能够明显改善冠心病PCI术后心绞痛(气虚血瘀证)。芪参益气滴丸的主要活性成分有黄芪甲苷、丹参素、三七皂苷R1和降香油。
芪参益气滴丸可以抑制心肌缺血期间的心肌能量代谢异常,减轻心肌纤维的损伤。WEI等[107]对QSYQ在缺血再灌注损伤的药效,从体内和体外俩个方面进行了系统的研究,评估了其3种活性成分AsIV,DLA和R1在保护IR引起的心肌纤维化中的生物活性,并发现芪参益气滴丸的3种主要成分表现出不同的效果,体现了中医“君臣佐使,配伍用药”的理念。此外,还进一步证实单核细胞C5aR和TGF-β1/Smads信号通路参与芪参益气滴丸对心肌纤维化的治疗。芪参益气滴丸能明显减少RP S19二聚体的释放,减少巨噬细胞的极化,减少TGF-β1,TGF-β RII,Smad3,P Smad3,MMP2/9,组织蛋白酶B和肌成纤维细胞数量的表达。抑制了TGF-β1诱导的P-Smad3从细胞质到细胞核的易位,而Smad7 siRNA转染则消除了芪参益气滴丸对成纤维细胞胶原生成能力的影响。在后续的研究中,进一步发现芪参益气滴丸对心肌I/R损伤的能量代谢异常具有较强的修复作用,DLA恢复线粒体复合物I亚基NDUFA10的低表达,这不仅改善了能量代谢,而且还抑制了过氧化物的产生和心肌细胞的凋亡[108]。此外,这些成分通过作用于TLR4和NF-κB减少促炎细胞因子的产生和炎症细胞的浸润,来抑制I/R引起的炎症以及恢复能量代谢紊乱和减轻氧化应激。因此,芪参益气滴丸能够减轻微循环功能障碍、心肌损伤和心脏纤维化的损害,显示出多靶点药物在对抗复杂疾病方面的优势,可通过进一步的临床试验来检验芪参益气滴丸对PCI患者的有效性和安全性。
5 讨论和展望
冠状动脉介入术是目前治疗冠心病冠状动脉狭窄及闭塞的最有效的策略,我国2018年接受治疗手术治疗的人数已达91万,且仍有上升趋势,但手术并没有降低心血管疾病的死亡率,仍呈递增趋势。氧化应激在冠状动脉介入术中发挥着重要作用,ROS的爆发可引发能量传递异常和离子稳态失衡,损害内皮细胞结构和功能,血管通透性增高,红细胞和血浆蛋白外逸,白细胞和血小板沿内皮细胞滚动黏附,形成斑块造成血管内狭窄。线粒体作为ROS产生代谢的主要场所之一,存在许多酶调控着ROS的生成,通过激活Keap1/Nrf2/ARE,Nrf2/HO-1,PI3K/Akt,NF-κB,JNK,SIRT1等信号通路,参与心血管疾病、神经退行性疾病等许多病理过程。
中西医对于冠状动脉介入损伤存在着不同的认识,其理论存在着极大的差异,但两者都认同PCI再通血管且应注意活血化瘀,因此存在着某些联系。从中医角度出发,认识并寻找冠状动脉介入损伤的治疗方法并结合现代医学的分子研究,以抗氧化应激中药为“桥梁”建立中西医之间的关联,为中医药的抗氧化原理提供现代医学佐证。中药具有多靶点整合干预的特色和优势,可同时干预PCI术后的多个病理环节,起到整体调节的作用,对防治PCI术后问题有较大探索空间,并已成为研究热点。中医药是我国珍贵的宝库,里面许多的中医认识和治病原则都值得借鉴思考,通过借助中医疗法,开展中药实验寻找探究有效成分,为减轻PCI后不良症状和提高患者生活质量提供思路方法。
Early-onset cataracts,spastic paraparesis, and ataxia caused by a novel mitochondrial tRNAGlu (MT-TE) gene mutation causing severe complex I deficiency: a clinical, molecular, and neuropathologic study
[J]. J Neuropathol Exp Neurol,2013,72(2):164-175.Punicalagin protects H9c2 cardiomyocytes from doxorubicin-induced toxicity through activation of Nrf2/HO-1 signaling
[J]. Bioscience Rep, 2019,doi:10.1042/BSR20190229.NF-κB and mitochondria cross paths in cancer: mitochondrial metabolism and beyond
[J]. Semin Cell Dev Biol,2019,doi:10.1016/j.semcdb.2019.05.021.The epigenetic regulator SIRT6 protects the liver from alcohol-induced tissue injury by reducing oxidative stress in mice
[J]. J Hepatol,2019,doi:10.1016/j.jhep.2019.06.019.
