当今,肺癌的发生率和死亡率仍占据全球癌症的一个主导地位,预计在2018年将新增210万例肺癌患者,和180万肺癌死亡病例,约占据全球癌症死亡病例的18.4%。大部分男性肺癌死亡患者分布在东欧、西亚、非洲北部,特别是在东亚(中国)和亚洲东南部[1]。肺癌根据病理类型可分为小细胞肺癌和非小细胞肺癌(NSCLC),其中NSCLC约占85%~90%,大部分在临床确诊时属于中晚期,且整体5年生存率仍低于20%[2]。近年来,分子靶向药物表皮生长因子受体酪氨酸酶抑制剂(EGFR-TKIs)对表皮生长因子受体(EGFR)基因突变的晚期非小细胞肺癌患者,其疗效优于化疗,其中代表药物为吉非替尼(Gefitinib)。但是,大部分有效患者在服用Gefitinib 10~16个月时出现获得性耐药[3]。所以,寻找克服耐药的方法成为了分子靶向治疗亟需解决的问题之一。Gefitinib耐药的主要机制是EGFR基因Exon20的二次突变,T790M基因突变,间质上皮转化因子(MET)扩增,肝细胞生长因子(HGF)过表达等[4-8],这些机制最终都要通过胞内磷脂酰肌醇激酶(PI3K)/蛋白激酶B(Akt)或者甲基乙基酮(MEK)/细胞外调节蛋白激酶(ERK)通路影响细胞增殖和细胞生存。据相关研究报道,F-盒和含蛋白7的WD重复结构域(FBW7)/及髓样细胞白血病-1(MCL-1)非依赖胞PI3K/Akt和MEK/ERK通路介导EGFR-TKIs获得性耐药[9]。
扶正抗癌(FZKA)方为广东省中医院肿瘤科吴万垠主任的经验方,在临床应用中疗效确切。前期临床也表明,FZKA方能延长晚期非小细胞肺癌患者的生存时间,提高患者的生存质量[10],基础研究显示,其机制可能为FZKA方激活半胱氨酸蛋白酶-3(Caspase-3)/B淋巴细胞瘤-2相关X(Bax),信号转导子与转录激活子(STAT3)/胰岛素样生长因子结合蛋白1(IGFBP1)/波形蛋白(Vimentin)/N-钙黏蛋白(N-cadherin)/基质金属蛋白酶-9(MMP-9),腺苷酸活化蛋白激酶α(AMPKα)/Akt/叉头蛋白O3a(FOXO3a),PI3K/附膜蛋白1(Muc1),MET/PI3K等通路从而有效诱导肺癌细胞凋亡和抑制肺癌细胞增殖及侵袭转移能力[11-15]。
目前研究FZKA方促进Gefitinib药敏性的潜在机制的研究有限,本研究拟通过探索FZKA方联合Gefitinib应用后对人肺腺癌A549细胞增殖凋亡、侵袭转移的影响,从FBW7/MCL-1通路探讨FZKA方联合Gefitinib对A549细胞协同抗癌作用的机制。
1 材料
1.1 细胞株
人肺腺癌A549细胞,由广东省中医药科学院提供。
1.2 药物和试剂
FZKA方颗粒由黄芪30 g,太子参30 g,白术15 g,甘草片10 g,炒薏苡仁30 g,山慈菇30 g,白花蛇舌草30 g,龙葵30 g,石见穿30 g,八月札30 g,蛇泡簕30 g,莪术15 g炮制而成,由广东省中医院制剂室提供,批号J1503001,饮片经柳州市中医医院药剂科梁学政主任鉴定为正品;Gefitinib溶液(英国阿斯利康公司,国药准字J20100014);DMEM培养基,胎牛血清,胰酶,磷酸盐缓冲液(美国Gibco公司,批号分别为8118240,1671329,957208,8118127);噻唑蓝(MTT,美国Sigma公司,批号#MKBX0151V);BCA蛋白检测试剂盒,5×上样缓冲液(美国Thermo公司,批号分别为#QK224833,P0015);Annexin V FITC/碘化丙啶(PI) apoptosis kit,cell cycle kit(南京凯基生物公司,批号分别为KGA105-KGA108,KGA511-KGA512);兔抗Caspase-3,Bcl-2,Bax,β-肌动蛋白(β-actin)多克隆抗体,HRP-羊抗兔酶标抗二抗(美国CST公司,批号分别为9662S,3498S,2772S,4970S-15,7074S-27);兔抗FBW7,MCL-1多克隆抗体(美国Abcam公司,批号分别为AR104057-9,AR226223-40);transwell小室,matrigel(美国Corning公司,批号分别为06118026,8113007);结晶紫染色液(南京碧云天公司,批号C0255)。
1.3 仪器
ME215S型电子天平(美国Sartorius公司);IC-1000型全自动细胞计数仪(上海Count Star公司);IX71型倒置显微镜(日本Olympus公司);VICTOR X5型多功能酶标仪(美国PerkinElmer公司);IKA MS3型圆周振荡摇床(德国IKA公司);5702型冷冻离心机,5418R小型离心机(德国Eppendorf公司);FC500/MCL型Gallios型流式细胞仪(美国Beckman公司);MP-4型蛋白印迹垂直电泳槽和转膜槽,170-8265型化学发光成像系统(美国Bio-Rad公司)。
2 方法
2.1 细胞培养
用含10%胎牛血清的DMEM培养基作为细胞培养液,将细胞放在37 ℃ 5%CO2条件下的无菌细胞培养箱中培养,取对数生长期的细胞待用。
2.2 药物制备
称取适量的FZKA,加入DMEM培养基,充分振荡并使用超声助溶,使其完全溶解,3 000 r·min-1离心10 min,取上清用0.22 μm滤器过滤后,呈混悬状态,于4 ℃冰箱保存待用,用时充分摇匀。
2.3 MTT比色法检测细胞活力
取对数生长期的A549细胞,经胰酶消化吹打成细胞悬液后,经计数仪技术后,以3×103个/孔接种于96孔板,置于细胞培养箱中培养24 h。待第2天细胞贴壁后,用5 mL注射器轻轻吸走旧培养液,加入FZKA方(0.2,0.4,0.8,1.6,3.2 g·L-1)及吉非替尼(5,10,15,20,40 mg·L-1),同时分别设空白组,使每孔最终的培养液总体积为100 μL,每个浓度设3个平行复孔,分别培养24,48,72 h,吸走旧液。每孔加入0.5 g·L-1 MTT溶液15 μL,继续在培养箱中培育4 h后倒出液体,并用滤纸吸干液体,每孔加入DMSO 150 μL,震荡10 min,在酶标仪中检测波长为490 nm的吸光度A,设空白组细胞存活率为100%,细胞增殖抑制率=(1-A药物组/A空白组)×100%。
2.4 细胞划痕实验检测细胞迁移
取对数生长的细胞,以5×105个/孔接种在六孔板里,培养24 h,细胞铺满六孔板底面,用200 μL的枪头均匀垂直板,以约45°斜角划痕,保证划痕边缘整和平整。弃去培养液,用PBS轻轻地清洗漂浮的细胞。根据细胞增殖结果,选取FZKA方组(2 g·L-1),Gefitinib组(10 mg·L-1),联合给药组取FZKA方(2 g·L-1),Gefitinib(10 mg·L-1),干预A549细胞24 h,分别在0,24 h时,光学显微镜下选取适当的视野拍照,记录每个孔细胞的迁移情况,并用Image J软件测量划痕的距离的变化。
2.5 Transwell实验检测细胞增殖
实验前1 d,将细胞培养在无血清的培养基中饥饿12 h。第2天,取出小室放在24孔板上,用1∶8稀释的matrigel胶200 μL包被Transwell小室底部膜的上室面,细胞培养箱孵育30 min后,吸出小室中残余液体,每孔加入5×105个A549细胞100 μL均匀铺在小室内。另外,在24孔板里加入含10%胎牛血清的培养液500 μL,将小室放在其上面,放在培养箱里培养24 h。最后用棉签把小室内的细胞轻轻刮除,用4%的多聚甲醛固定下室细胞30 min,后用PBS洗3次,每次10 min,再在24孔板中加入结晶紫染色液500 μL,将小室置于其中,使膜浸没在结晶紫染色液中,孵育15~30 min取出,PBS洗3次,每次15 min。在光学显微镜下观察并拍照,并统计细胞数目。
2.6 流式细胞仪检测细胞凋亡率
细胞分组及培养同2.4项,收集细胞,用PBS洗涤细胞2次,加入Binding Buffer 500 μL重悬细胞,每管加入Annexin V-FITC 5 μL和PI 5 μL,室温避光孵育5 min,采用流式细胞仪激发波长488 nm处检测样品凋亡情况,实验重复3次。
2.7 流式细胞仪检测细胞周期
细胞分组及培养同2.4项,收集细胞,用PBS洗涤细胞2次,离心,加入预冷70%乙醇500 μL,4 ℃固定过夜。后用PBS洗去固定液,每孔加入RNase A 50 μL和PI 10 μL,室温避光孵育30 min,采用流式细胞仪激发波长488 nm处检测样品周期情况,实验重复3次。
2.8 蛋白质免疫印迹法检测蛋白表达
细胞分组及培养同2.4项,收集细胞,提取蛋白。制备蛋白样品,用PBS轻轻清洗细胞2遍,用ripa强裂解液冰上裂解细胞30 min,细胞刮将细胞刮下并移至1.5 mL的离心管内,4 ℃,12 000 r·min-1离心20 min后,转移上清至新离心管。BCA蛋白检测试剂盒检测蛋白浓度,用5×蛋白上样缓冲液按比例混合样品,100 ℃,10 min变性,存于-20 ℃冰箱。取蛋白样品上样,跑电泳,转膜,封闭,一抗(1∶1 000)室温孵育20 min,4 ℃冰箱孵育过夜后,TBST液10 min,洗膜3次,二抗(1∶5 000)孵育1 h,洗膜。在化学发光成像系统免疫发光仪器中,用Image Lab显影成像。实验重复3次,Iamge J软件统计条带灰度值。
2.9 统计学方法
采用SPSS 22.0统计软件处理结果,结果以
3 结果
3.1 FZKA方,Gefitinib对A549细胞的增殖能力的影响
与空白组比较,FZKA方,Gefitinib作用于A549细胞后,随着给药浓度的增加,细胞抑制率呈递增趋势(P<0.05);与24 h比较,随着药物作用时间的增加,细胞抑制率呈递增趋势。见表1,表2。
| 组别 | 浓度/μmol·L-1 | 24 h细胞抑制率 | 48 h细胞抑制率 | 72 h细胞抑制率 |
|---|---|---|---|---|
| Gefitinib | 10 | 12.27±3.561) | 19.13±3.511) | 26.30±4.891) |
| 20 | 17.88±6.341) | 25.27±2.401) | 30.33±11.621) | |
| 40 | 22.78±3.071) | 40.79±1.511) | 47.80±3.441) | |
| 60 | 37.64±1.501) | 53.01±10.171) | 63.86±5.631) | |
| 80 | 44.74±6.481) | 61.84±5.981) | 70.43±3.401) | |
| 100 | 57.62±6.121) | 68.37±10.331) | 79.21±1.701) |
| 组别 | 质量浓度/g·L-1 | 24 h细胞抑制率 | 48 h细胞抑制率 | 72 h细胞抑制率 |
|---|---|---|---|---|
| FZKA方 | 0.2 | 0.98±1.471) | 1.61±0.641) | 5.20±0.561) |
| 0.4 | 3.98±4.111) | 4.98±3.141) | 9.99±6.671) | |
| 0.8 | 9.13±4.601) | 9.43±3.691) | 19.83±1.761) | |
| 1.6 | 11.71±4.861) | 17.19±4.301) | 26.23±4.361) | |
| 3.2 | 16.25±4.911) | 23.46±3.161) | 32.07±1.5251) | |
| 4.6 | 21.64±3.591) | 32.35±5.331) | 45.79±4.061) |
3.2 FZKA方联合Gefitinib对A549细胞增殖能力的影响
FZKA方,Gefitinib联合作用于A549细胞后,与空白组比较,均有效地抑制A549细胞的增殖(P<0.05);与单独FZKA方,Gefitinib给药组比较,细胞抑制率更明显(P<0.05)。见表3。
| 组别 | 浓度 | 细胞抑制率/% |
|---|---|---|
| FZKA方 | 2 g·L-1 | 16.90±4.881) |
| Gefitinib | 40 μmol·L-1 | 26.42±4.581) |
| FZKA方+ Gefitinib | 2 g·L-1+40 μmol·L-1 | 44.15±1.931,2,3) |
3.3 FZKA方联合Gefitinib对A549细胞凋亡率的影响
与空白组比较,各用药组凋亡率明显增加(P<0.05);联合用药组细胞凋亡率较单独使用FZKA方,Gefitinib的细胞凋亡率增加更明显(P<0.05)。见表4。
| 组别 | 浓度 | 细胞凋亡率/% |
|---|---|---|
| 空白 | - | 0.28±0.06 |
| FZKA方 | 2 g·L-1 | 3.25±0.341) |
| Gefitinib | 40 μmol·L-1 | 4.02±0.541) |
| FZKA方+ Gefitinib | 2 g·L-1+40 μmol·L-1 | 10.67±1.511,2,3) |
3.4 FZKA方联合Gefitinib对A549细胞周期分布的影响
与空白组比较,各用药组G0/G1期细胞的比例明显增多,S期细胞的比例明显减少(P<0.05);与FZKA方,Gefitinib组比较,联合用药组较细胞G0/G1期细胞的比例明显增加,S期细胞的比例明显减少(P<0.05)。见表5。
| 组别 | 浓度 | G0/G1期 | G2/M期 | S期 |
|---|---|---|---|---|
| 空白 | - | 30.52±1.42 | 18.85±0.91 | 50.64±2.13 |
| FZKA方 | 2 g·L-1 | 41.95±1.731) | 21.23±3.211) | 36.83±1.621) |
| Gefitinib | 40 μmol·L-1 | 47.07±2.231) | 12.75±5.001) | 40.18±3.421) |
| FZKA方+Gefitinib | 2 g·L-1+40 μmol·L-1 | 55.20±4.001,2,3) | 16.73±4.001,2,3) | 28.03±2.081,2,3) |
3.5 FZKA方联合Gefitinib对A549细胞转移侵袭能力的影响
与空白组比较,各用药组划痕愈合能力减弱(P<0.05);与FZKA方,Gefitinib比较,FZKA方联合Gefitinib组划痕愈合能力减弱(P<0.05)。与空白组比较,各用药组穿过transwell小室的细胞数目均减少(P<0.05),与FZKA方组,Gefitinib组比较,FZKA方联合Gefitinib组穿过transwell小室的细胞数目减少更明显(P<0.05)。见图1,图2和表6,表7。

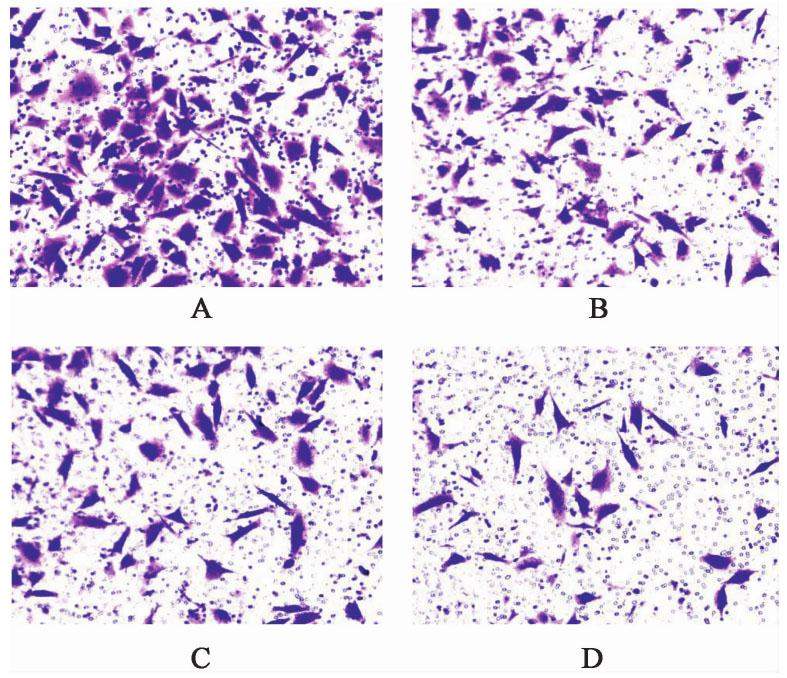
| 组别 | 浓度 | 24 h划痕长度的变化率/% |
|---|---|---|
| FZKA方 | 2 g·L-1 | 54.53±0.521) |
| Gefitinib | 40 μmol·L-1 | 47.34±3.061) |
| FZKA方+Gefitinib | 2 g·L-1+40 μmol·L-1 | 3.28±0.121,2,3) |
| 组别 | 质量浓度 | 穿过基质膜的细胞数/个 |
|---|---|---|
| 空白 | - | 374.00±17.35 |
| FZKA方 | 2 g·L-1 | 274.00±22.721) |
| Gefitinib | 40 μmol·L-1 | 269.00±39.891) |
| FZKA方+ Gefitinib | 2 g·L-1+40 μmol·L-1 | 183.00±16.041,2,3) |
3.6 FZKA方联合Gefitinib对凋亡相关蛋白表达的影响
与空白组比较,各用药组Bcl-2蛋白表达明显下降,cleaved-Caspase-3,Bax蛋白表达明显上调(P<0.05);与单独FZKA方,Gefitinib组比较,联合用药组的Bcl-2蛋白表达量下调更明显,cleaved-Caspase-3,Bax蛋白上调更明显(P<0.05)。见图3,表8。
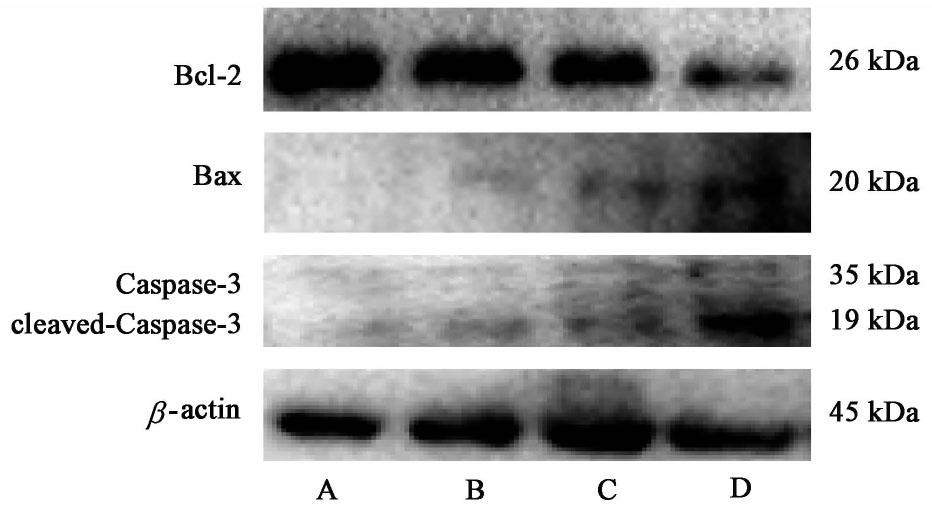
| 组别 | 浓度 | Bcl-2/β-actin | Bax/β-actin | Caspase-3/β-actin |
|---|---|---|---|---|
| FZKA方 | 2 g·L-1 | 0.60±0.011) | 3.06±0.011) | 1.33±0.041) |
| Gefitinib | 40 μmol·L-1 | 0.39±0.031) | 5.40±0.041) | 2.98±0.571) |
| FZKA方+Gefitinib | 2 g·L-1+40 μmol·L-1 | 0.23±0.041,2,3) | 8.82±0.041,2,3) | 4.10±0.511,2,3) |
3.7 FZKA方联合Gefitinib对FBW7/MCL-1蛋白表达的影响
与空白组比较,各给药组MCL-1蛋白表达明显下降,FBW7蛋白表达明显上调(P<0.05);与单独FZKA方,Gefitinib组比较,联合用药组的MCL-1蛋白表达下调更明显,FBW7蛋白上调更明显(P<0.05)。见图4,表9。
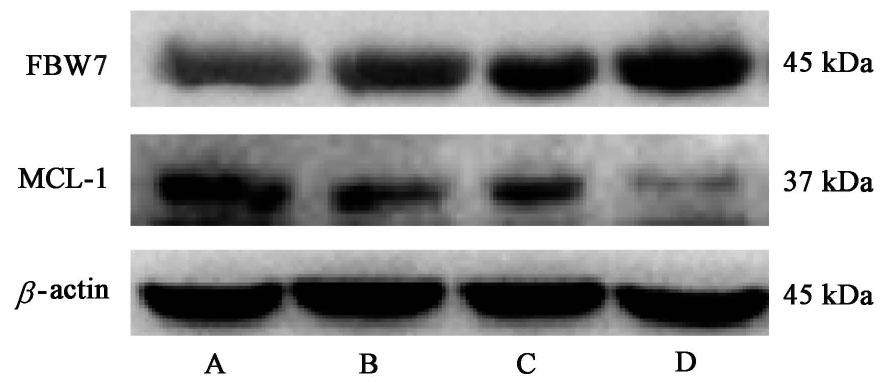
| 组别 | 浓度 | FBW7/β-actin | MCL-1/β-actin |
|---|---|---|---|
| FZKA方 | 2 g·L-1 | 1.47±0.011) | 0.56±0.011) |
| Gefitinib | 40 μmol·L-1 | 1.52±0.011) | 0.40±0.031) |
| FZKA方+ Gefitinib | 2 g·L-1+40 μmol·L-1 | 2.09±0.041,2,3) | 0.23±0.011,2,3) |
4 讨论
肺癌在中国医学中属于“肺痈”“肺积”“息贲”及“息积”等范畴,多因痰瘀毒互结,日久发为肿块。病理特点是本虚标实,因虚而致实,虚实夹杂[16]。随着肺癌靶向药的广泛应用,患者对靶向药耐药,且靶向药副作用大。中医药的地位越来越重要,靶向药联合应用中医药,能增强靶向药的疗效,减轻副作用。
扶正抗癌方是广东省中医院肿瘤科吴万垠主任根据多年的临床经验,系统分析肺癌的常见证型,辨证与辨病结合、中医与西医结合拟定的方药。全方以四君子汤为基础方,方中太子参益气健脾,生津润肺,白术健脾益气、燥湿化痰,黄芪补气升阳、益卫固表、托毒排脓,炒薏苡仁健脾利湿,甘草片益气补中、调和诸药,五药共用健脾益气、补肺化痰,以扶正为主;白花蛇舌草、龙葵清热解毒,山慈姑清热解毒、消肿散结,八月札活血理气、散结消肿,石见穿活血化瘀,莪术破血行气消积,蛇泡簕清热散瘀,七药共用清热散结活血,以驱邪为主。全方从辨证论治、整体观念出发,标本同治,病证结合,共奏扶正抗癌之效[17]。扶正抗癌方单独应用可以调控肺癌细胞的增殖与凋亡[18],本研究旨在明确扶正抗癌方与吉非替尼联合应用后是否有协同增效的作用及其作用机制。
本研究发现,FZKA方联合Gefitinib在抑制人肺腺癌细胞A549上明显优于单独应用Gefitinib,其可能通过FBW7/MCL-1通路对A549细胞增强抗癌作用。本研究选取FZKA方对细胞抑制不明显的浓度联合低浓度的Gefitinib作用于A549细胞,结果显示,与Gefitinib单独用药比较,FZKA方联合Gefitinib能明显抑制A549的增殖和侵袭转移,诱导其凋亡,并能调控凋亡相关蛋白Bcl-2,Bax,Caspase-3,说明FZKA方能增强Gefitinib对A549细胞的敏感性。FBW7是E3泛素连接酶的底物结合单位,是一种肿瘤抑制蛋白,其活性对维持EGFR-TKIs敏感性是必需的,可调节原癌基因(C-myc),细胞周期素E(Cyclin E),氨基端激酶(c-Jun)和MCL-1。MCL-1是凋亡家族Bcl-2成员,其作用是抑制该家族的促凋亡因子Bax从而对凋亡起到负向调控。相关研究表明,FBW7失活导致的MCL-1水平上调使结肠癌及卵巢癌细胞对抗微管药物紫杉醇及长春新碱耐药,而在FBW7敲除的细胞中利用RNA干扰抑制MCL-1水平则使细胞凋亡显著增加,从而恢复对药物的敏感性[19]。本研究发现FZKA方联合Gefitinib后,FBW7明显上调,MCL-1明显下调,所以认为,FZKA方联用Gefitinib可能通过FBW7/MCL-1通路增强对A549细胞抗癌作用。
综上,FZKA方联用Gefitinib后可能通过FBW7/MCL-1增强对人肺腺癌细胞A549抗癌作用,抑制肺癌细胞增殖、侵袭转移能力,诱导其凋亡。本研究为中医经方联合西医靶向药治疗肺癌的思想提供了必要的实验依据,具有重要的临床意义。

