胆汁淤积是一种由多种原因引起的胆汁分泌和/或排泄障碍的临床症状,患者常表现为皮肤瘙痒,大便色浅,尿色加深,乏力及黄疸等,重者可演变为胆汁淤积性肝硬化和肝衰竭[1]。引起胆汁淤积的病因主要有病毒,药物,酒精,结石和肿瘤等,持续的胆汁淤积使胆汁流入十二指肠受阻,导致肝内胆汁淤积,肠道胆汁缺乏和血中胆汁成分增多,从而导致胆汁淤积性肝病(CSLD)以及相应的全身症状[2]。目前临床上尚无疗效确切且稳定的治疗药物[3]。在中医学中,CSLD属“黄疸”范畴[4],中药治疗黄疸历史由来已久,尤其对于治疗顽固性黄疸有一定的优势[5-6]。加味茵陈蒿汤(活血清解灵)是由吴咸中院士研制已应用于临床数十年的经验方,现为天津市南开医院院内制剂,方由茵陈、丹参、大黄、白头翁、败酱草、炙甘草6味中药组成。本方由伤寒论中的经典方剂茵陈蒿汤加减而来,多用于以湿热证为主的胆道系统感染,方中重用茵陈,清利湿热,利胆退黄,去栀子弱其清热泻火之功,加丹参增强其活血凉血,祛瘀止痛之效,二者合用,共为君药。以大黄为臣,降瘀泻热,通利大便,以白头翁和败酱草为佐,清热解毒,消痈排脓,以甘草为使,取其益气和中,调和诸药之用,在诸多苦寒药中发挥其和脾胃,以防苦寒伤中之效[7]。
胆汁淤积伴随胆汁酸浓度增高,而胆汁酸的毒性作用会导致胆管和肝实质的损伤[8]。同时由于胆汁淤积时活性氧的释放,引起促炎因子的生成从而引起肝脏的炎性反应[9]。在过往研究中,已有文献探讨过CSLD相关炎症反应的机制,药物通过下调炎症因子从而治疗CSLD[10]。而值得注意的是,近年来,有研究显示胆汁酸受体G蛋白偶联胆汁酸受体(TGR5)对炎症小体NLRP3的调控机制可视为疾病潜在的治疗靶点[11]。因此,本文从胆汁淤积与继发炎症反应的角度探讨胆汁酸受体TGR5对相关炎性因子活性的影响,进而探讨加味茵陈蒿汤对促进胆汁酸排泄的利胆作用及抗炎作用,亦为此方的临床应用提供实验依据。
1 材料
1.1 动物
SPF级Wistar雄性大鼠56只,体质量(220±20) g,北京维通利华实验动物技术有限公司,饲养环境12 h光照与黑暗交替循环,温度(22±3) ℃,相对湿度(50±10)%,正常饲料喂养,自由进食饲料和水,实验前适应性喂养1周,本动物实验经天津市医药科学研究所动物伦理委员会批准进行(编号IMPS-EAEP-Q-131TD-02)。
1.2 药物与试剂
加味茵陈蒿汤配方颗粒由茵陈、丹参、大黄、白头翁、败酱草、炙甘草组成(北京康仁堂药业有限公司,批号分别为18000671,18016391,18004941,18018071,18004621,18014211);α-异硫氰酸萘酯(ANIT,美国Alfa Aesar公司,批号10205233);复方甘草酸苷胶囊(瑞阳制药有限公司,批号H20110056);苏木素染色液,伊红染色液(北京雷根生物技术公司,批号分别为DH0001,DH0044);核苷酸结合寡聚化结构域样受体3(NLRP3)抗体,G蛋白偶联胆汁酸受体5(TGR5)抗体,辣根过氧化物酶(HRP)标记羊抗兔二抗(美国Abcam公司,批号分别为GR3191281-14,GR3240620-3,GR3234362-4);半胱氨酸蛋白酶-1(Caspase-1)抗体(美国Novus公司,批号NB100-56565);甘油醛-3-磷酸脱氢酶(GAPDH)抗体,辣根过氧化物酶(HRP)标记羊抗鼠二抗(美国Proteintech公司,批号分别为10004185,20000002);总胆红素(TBIL),直接胆红素(DBIL),间接胆红素(IBIL),丙氨酸氨基转移酶(ALT),总胆汁酸(TBA)(中生北控生物科技股份有限公司,批号分别为190921,190921,190921,190821,190811)。
1.3 仪器
TBA2000-FR型全自动生化分析仪(日本东芝公司);KHBST-36型酶标仪(上海科华公司);HH-2型数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);Kubota3500型冷冻离心机(日本久保田公司);MiNi Proteam 3 Cell型电泳仪及转膜仪,ChemiDocXRS型化学发光分析仪(美国Bio-Rad公司);EG1150H型包埋机,RM2235/2245型切片机,ASP300型脱水机,DM400B型荧光显微镜(德国Leica公司)。
2 方法
2.1 动物造模及给药
将56只雄性SPF级Wistar大鼠随机分为7组,分别为空白组,模型组,复方甘草酸苷胶囊低、高剂量(22.5,45 mg·kg-1)组,加味茵陈蒿汤低、中、高剂量(4.1,8.1,16.2 g·kg-1)组。复方甘草酸苷胶囊作为治疗肝病常用药,过往动物实验中无一致的有效剂量,因此为保证药物治疗效果本文选用高、低2个剂量进行对照实验[12-14]。用生理盐水将复方甘草酸苷胶囊及加味茵陈蒿汤配方颗粒按体质量换算为临床等效剂量后溶解为相应浓度[15],在造模第2天开始灌胃给药,连续4 d。ANIT用橄榄油溶解,以ANIT(100 mg·kg-1)灌胃1次,灌胃体积为5 mL·kg-1,血清中TBIL,TBA水平增高表明胆汁淤积性肝损伤模型成功[16]。
2.2 标本采集及处理
给药第5天,3%戊巴比妥(40 mg·kg-1)麻醉,大鼠取仰卧位固定,开腹,胆管插管取胆汁,腹主动脉取血,离心取血清备用,取肝组织于中性甲醛中固定,另取部分肝组织冻存于-80 ℃备用。
2.3 胆管插管手术法检测胆汁流速
大鼠腹腔麻醉后取仰卧位固定开腹,经胆总管行胆管插管手术,留取胆汁1 h,通过监测胆汁容积与时间,计算流速。
2.4 全自动生化仪检测血清肝功能
经腹主动脉取血,静置凝固后3 000 r·min-1离心10 min,取上清检测TBIL,DBIL,IBIL,ALT和TBA的含量,进样量分别为14.3,14.3,14.3,25,7 μL,酶标仪检测波长分别为451,451,451,340,410 nm,实验步骤严格按照试剂盒说明书进行。
2.5 苏木素-伊红(HE)染色观察肝组织病理学变化
肝组织于中性甲醛中固定48 h后取出,常规脱水,石蜡包埋,切片,60 ℃烤片1 h,二甲苯脱蜡,梯度乙醇复水,苏木素染色,流水冲洗15 min,伊红染色,流水冲洗多余染料,脱水透明,中性树胶封片,在显微镜下观察肝组织形态变化。
2.6 蛋白免疫印迹法(Western blot)检测肝组织中NLRP3,Caspase-1及TGR5蛋白表达
取肝组织称质量,加入蛋白裂解液和蛋白酶抑制剂,在冰上进行超声破碎,13 000 r·min-1离心10 min取上清,重复2次,用BCA试剂盒进行蛋白定量,用loading buffer配平蛋白提取液并在95 ℃金属浴中加热15 min,每个孔蛋白上样量为50 μg,蛋白用SDA-PAGE电泳分离,转膜,室温下用5%脱脂牛奶封闭2 h,各条带分别孵育一抗NLRP3(1∶1 000),Caspase-1(1∶1 000),TGR5(1∶600)及GAPDH(1∶5 000)4 ℃过夜,洗膜,室温下分别孵育羊抗兔二抗(1∶8 000),羊抗鼠二抗(1∶1 000)1.5 h,洗膜,加入ECL发光液于化学发光分析仪中曝光。以GAPDH为标准化参考物,用Image J软件测量各条带灰度值。
2.7 统计学分析
采用SPSS 19.0软件进行数据统计处理,结果以
3 结果
3.1 对大鼠胆汁流速影响
与空白组比较,模型组胆汁流速显著降低(P<0.01);与模型组比较,复方甘草酸苷胶囊组与加味茵陈蒿汤低、中剂量组对于胆汁流速影响不明显,加味茵陈蒿汤高剂量组大鼠胆汁流速明显增高(P<0.05)。见表1。
| 组别 | 剂量/g·kg-1 | 胆汁流速/μL·min-1 |
|---|---|---|
| 空白 | - | 19.24±1.71 |
| 模型 | - | 5.17±1.281) |
| 复方甘草酸苷胶囊 | 0.023 | 7.77±1.79 |
| 0.045 | 5.15±1.35 | |
| 加味茵陈蒿汤 | 4.1 | 9.51±1.58 |
| 8.1 | 8.08±1.37 | |
| 16.2 | 11.95±2.152) |
3.2 对大鼠TBIL,IBIL,DBIL,ALT,TBA影响
与空白组比较,模型组大鼠血清学各项数值均显著增高(P<0.01),与模型组比较,复方甘草酸苷胶囊组对于血清学指标无明显影响,加味茵陈蒿汤高剂量组各项血清学指标均明显降低(P<0.05),与加味茵陈蒿汤高剂量组比较,TBA明显低于复方甘草酸苷胶囊组及加味茵陈蒿汤低剂量组(P<0.05)。见表2。
| 组别 | 剂量/g·kg-1 | TBIL/μmol·L-1 | DBIL/μmol·L-1 | IBIL/μmol·L-1 | ALT/U·L-1 | TBA/μmol·L-1 |
|---|---|---|---|---|---|---|
| 空白 | - | 3.11±0.41 | 0.67±0.12 | 2.44±0.35 | 60.84±7.54 | 38.31±9.38 |
| 模型 | - | 167.33±13.101) | 111.80±8.451) | 55.53±4.691) | 567.80±60.971) | 244.17±13.791) |
| 复方甘草酸苷胶囊 | 0.023 | 122.71±13.53 | 83.48±9.82 | 39.24±3.90 | 458.11±57.08 | 204.86±17.444) |
| 0.045 | 147.95±12.76 | 96.71±7.51 | 51.24±5.46 | 453.14±62.35 | 219.86±12.354) | |
| 加味茵陈蒿汤 | 4.1 | 109.26±16.76 | 72.68±11.26 | 36.59±5.58 | 460.03±40.90 | 225.16±22.234) |
| 8.1 | 104.60±17.41 | 70.95±12.18 | 33.65±5.33 | 388.65±40.802) | 174.30±22.072) | |
| 16.2 | 86.54±15.002) | 55.84±10.792) | 30.70±4.302) | 453.56±52.08 | 131.70±19.022) |
3.3 对大鼠肝组织病理学影响
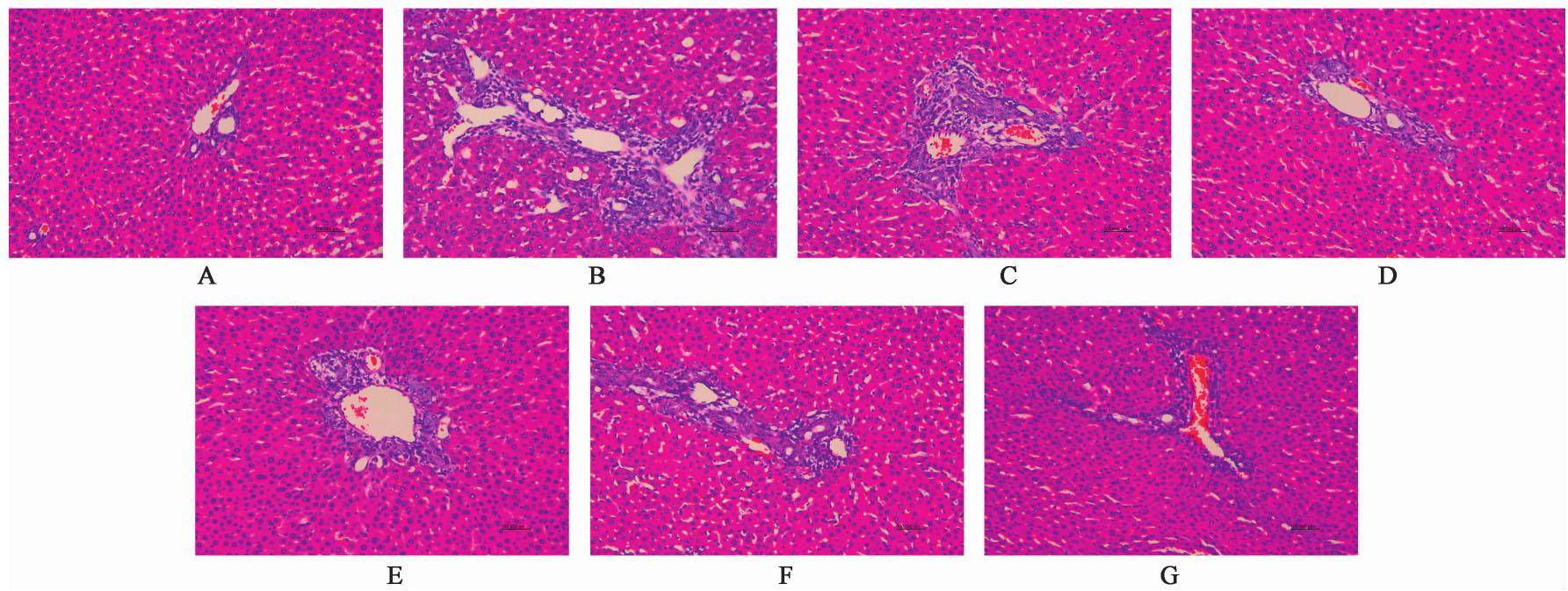
空白组肝组织结构完整,肝小叶结构清晰,肝细胞与胆管区均无显著异常,模型组胆管增生扩张明显,肝细胞颗粒变性,大量炎细胞浸润。复方甘草酸苷胶囊组和加味茵陈蒿汤组肝组织上述病变均有不同程度地改善,尤其加味茵陈蒿汤高剂量组胆管区增生明显减少,肝组织炎性病变减轻,炎细胞减少。见图1。
3.4 对大鼠肝组织TGR5,NLRP3,Caspase-1蛋白表达的影响
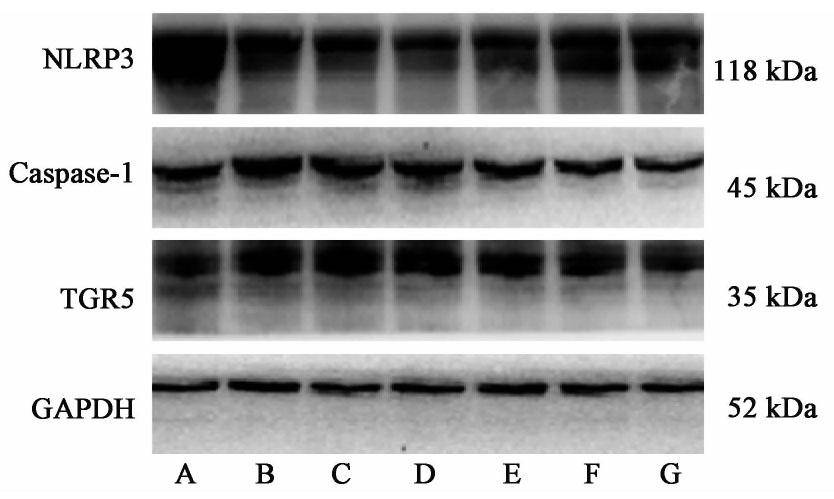
与空白组比较,模型组NLRP3表达显著降低(P<0.01),TGR5与Caspase-1表达显著增高(P<0.01);与模型组比较,加味茵陈蒿汤中、高剂量组NLRP3表达明显增高(P<0.05),复方甘草酸苷胶囊低、高剂量组及加味茵陈蒿汤中、高剂量组Caspase-1表达明显降低(P<0.05),加味茵陈蒿汤高剂量组TGR5表达明显降低(P<0.05)。见图2,表3。
| 组别 | 剂量/g·kg-1 | NLRP3/GAPDH | Caspase-1/GAPDH | TGR5/GAPDH |
|---|---|---|---|---|
| 模型 | - | 0.64±0.041) | 2.06±0.211) | 2.85±0.401) |
| 复方甘草酸苷胶囊 | 0.023 | 0.67±0.03 | 1.57±0.152,5) | 2.21±0.46 |
| 0.045 | 0.60±0.04 | 1.58±0.152,5) | 2.24±0.43 | |
| 加味茵陈蒿汤 | 4.1 | 0.83±0.09 | 1.72±0.124) | 2.76±0.535) |
| 8.1 | 0.90±0.112) | 1.67±0.242,5) | 2.22±0.38 | |
| 16.2 | 0.94±0.112) | 1.28±0.202) | 1.70±0.302) |
4 讨论
CSLD病因复杂,常见的CSLD包括原发性胆汁性胆管炎(PBC),原发性硬化性胆管炎(PSC),自身免疫性肝病和药物性胆汁淤积等,其中以PBC与PSC最为常见。目前临床上尚无疗效确切且稳定的治疗药物[3]。加味茵陈蒿汤方由茵陈,丹参,大黄、白头翁、败酱草、甘草6味组成,茵陈中的绿原酸[17-19],滨蒿内酯[20],丹参中的丹参酮[21],甘草中的甘草酸,甘草苷,异甘草素[22]等均为经实验验证的保肝利胆成分。白头翁和败酱草,中医常用其配伍治疗肠痈,而胆汁淤积症通常伴随着肠道微生物生态失衡和肠道胆汁酸缺乏引起的细菌和内毒素(LPS)易位率的增加[23],故而本方中这两味药的配伍对于胆汁淤积引起的全身症状也起到了一定的治疗作用。
本文采用ANIT刺激肝脏以模拟肝内胆汁淤积的病理状态。ANIT由肝细胞代谢,其与谷胱甘肽(GSH)结合后,通过多药耐药相关蛋白2(MRP2)分泌到胆汁中,对胆管细胞产生毒性作用。另一方面,由于ANIT-GSH复合物在胆汁中不稳定,游离的ANIT会经历吸收和代谢循环,导致胆汁浓度逐渐升高,从而对肝细胞产生毒性引起炎症反应[24]。这一模型与临床胆汁淤积的病理生理过程极为相近[25]。本实验中模型组TBIL,ALT,TBA水平显著增高,肝脏病理结果显示胆管增生明显,肝细胞炎性浸润,说明模型成功模拟了肝内胆汁淤积的病理状态。
近年来研究发现,胆汁酸在胆汁淤积性肝病中起到了关键作用[26],胆汁酸膜受体TGR5是由初级和次级胆汁酸激活的G蛋白偶联受体,其在肝脏的不同非实质细胞中表达。在肝脏中,TGR5调节微循环,炎症,再生,胆汁分泌和增殖以及胆囊充盈。由于TGR5在单核细胞和巨噬细胞中的抗炎作用,以及在胆汁酸肝肠循环中的重要作用,可通过激活TGR5从而有效改善肝脏炎症[27]。炎性小体在机体的病理生理过程中起到重要的调控作用[28]。NLRP1,NLRP3,NLRC4等NLR家族成员是炎症小体的重要组成部分,炎性小体通过介导Caspase-1的激活促进炎症细胞因子IL-1β和IL-18的分泌[29]。本实验模型组中,肝脏TGR5和Caspase-1表达显著增高,说明由于胆汁淤积时胆汁酸代谢障碍,导致胆汁酸受体在肝脏中表达增高,同时由于胆汁酸对肝细胞的毒性作用导致肝内炎性因子累积,从而并发肝炎。已有研究发现胆汁酸分子及其膜受体TGR5可抑制NLRP3的表达。由此,可以假设在依赖于NLRP3激活Caspase-1的炎症中,通过激活胆汁酸和TGR5可有效抑制炎症因子的释放。而本实验结果表明,在模型组中TGR5的高表达抑制了NLRP3的表达,但并未影响Caspase-1的高表达,说明在CSLD中,Caspase-1的激活并不完全依赖于NLRP3,对于这一假设还需进一步的证实。并且模型组中TGR5的高表达并未对CSLD中的肝脏炎症起到积极的作用,在经过加味茵陈蒿汤治疗后,肝脏TGR5的表达与血中胆汁酸水平同时出现下降,因此对于胆汁酸受体TGR5调节胆汁淤积的相关机制推测更侧重于促进体内胆汁酸的代谢,对于TGR5调节胆汁淤积引起的炎症反应的具体机制仍有待进一步研究。
综上所述,加味茵陈蒿汤可通过改善血清学中各肝功能指标,抗炎,降低炎性小体的表达,促进胆汁酸排泄和下调胆汁酸受体蛋白的表达等方面有效治疗CSLD,其作用机制之一可能是通过抑制胆汁酸受体TGR5,进一步调节相关炎性因子,从而调节肝内胆汁酸代谢和炎性反应。

