绝经后肥胖是影响更年期女性人体健康的重要危险因素,由于卵巢功能衰竭,雌激素分泌减少,下丘脑-垂体-卵巢轴平衡失调,导致体内物质代谢紊乱,体质量进行性增加。研究表明,女性肥胖的发病率随着年龄的增长而增加,并且绝经后女性的肥胖率高于有卵巢功能的绝经前女性[1]。绝经后女性比绝经前女性腹腔内脂肪堆积更多,导致肥胖及相关并发症的风险更大[2]。绝经后女性2型糖尿病、血脂异常、高血压病和心血管疾病的患病率比绝经前女性更高[3-4]。目前临床上针对绝经后女性的肥胖缺乏有效的治疗措施,激素替代疗法虽然能缓解肥胖及其并发症,但也增加了其他妇科肿瘤的患病率[5]。中医秉持整体观念和辨证论治的理念,认为绝经后女性除了易致肥胖,还常伴有胸胁胀满、烦躁易怒、情志抑郁、神疲食少等症[6],应归属于肝郁脾虚证。逍遥散出自《太平惠民和剂局方》[7],全方深合《黄帝内经·素问·藏气法时论》“肝苦急,急食酸以缓之”“脾欲缓,急食甘以缓之”“肝欲散,急食辛以散之”之旨,可使肝郁得疏,血虚得养,脾弱得复,气血兼顾,肝脾同调。逍遥散为治疗肝郁血虚脾弱证之基础方、妇科调经之常用方,目前在治疗女性绝经前后情志病方面有较好的临床疗效[8],但是逍遥散对与此相关的肥胖及其并发症可能的治疗效果还未见报道。此外,临床研究与基础研究已证实逍遥散加减对肝郁脾虚型非酒精性脂肪性肝炎有改善作用[9-11]。因此,本研究通过卵巢切除(OVX)雌大鼠模拟绝经后肥胖女性,观察逍遥散对雌激素缺乏引起肥胖及其相关并发症,包括脂代谢紊乱和肝脏脂肪变性及其炎症的影响,探讨其可能的机制,为临床运用提供一定参考。
1 材料
1.1 动物
40只成年雌性SD大鼠,体质量(200±20) g,年龄6~7周,SPF级,购于北京维通利华实验动物技术有限公司有限公司,动物合格证号SCXK(苏)2016-0002。本实验已获南京中医药大学实验动物伦理委员会批准,大鼠饲养于12 h/12 h昼夜循环环境(7:00~19:00),室温保持在25 ℃,相对湿度保持在50%~55%,动物自由摄食饮水。实验开始前动物适应性饲养7 d。
1.2 药物
实验所用中药复方选自《太平惠民和剂局方》中的逍遥散(北柴胡30 g,当归30 g,白芍30 g,白术30 g,茯苓30 g,炙甘草15 g,生姜10 g,薄荷10 g)。上述中药饮片购自南京中医药大学附属医院,经江苏省中医院药剂科朱育凤教授鉴定均为正品。药物先用清水浸泡30 min,煎煮2次,每次沸腾后煎煮40 min,合并2次药液,过滤,水浴浓缩制备成相当于含有1 g·mL-1生药的煎剂,保存于4 ℃冰箱备用。
1.3 试剂
苏木素-伊红(HE)染液,油红O染液(武汉谷歌生物科技有限公司,货号分别为G1005,G1016);trizol RNA分离试剂,SYBR Green Mix(南京诺唯赞生物科技有限公司,货号分别为R401-01,Q131-02);Prime Script™ Master Mix(日本Takara公司,货号RR036A);总胆固醇(TC),甘油三酯(TG),碱性磷酸酶(AKP),高密度脂蛋白(HDL),低密度脂蛋白(LDL),天冬氨酸氨基转移酶(AST),丙氨酸氨基转移酶(ALT)试剂盒(南京建成生物工程研究所,货号分别为20190105,20190106,20190111,20190117,20190117,20190201,20190202)。
1.4 仪器
Cryostar NX50型冰冻切片机(赛默飞世尔科技中国公司),JB-P5型包埋机(武汉俊杰电子有限公司),Nikon Eclipse E100型正置光学显微镜(日本尼康公司),Step One Plus型ABI实时荧光定量PCR(Real-time PCR)仪(美国应用生物系统公司),H7600-020型生化分析仪(日本日立公司)。
2 方法
2.1 OVX术
大鼠腹腔注射1%戊巴比妥钠40 mg·kg-1麻醉,在腹部正中作2~3 cm的切口,用手术钳和细丝结扎子宫,移除双侧卵巢,缝合切口。假手术组在麻醉打开腹腔后不做任何处理,缝合切口。OVX术后5 d,收集5 d的阴道涂片,参照文献[12]以出现动情期反应与否判断手术是否成功。
2.2 分组与给药
40只雌大鼠随机分为4组,分别为假手术组,OVX模型组,逍遥散低、高剂量组,每组各10只。药物组大鼠OVX后1周,每天早8:00灌胃给药,持续6周。假手术组和OVX模型组给予0.9%生理盐水10 mL·kg-1,逍遥散低、高剂量组分别给予3,9 g·kg-1剂量灌胃(给药剂量为预实验的有效剂量)。每周称量体质量,给药剂量按体质量变化灌胃。
2.3 血清生化指标测定
大鼠给药6周后,禁食8 h,将大鼠用戊巴比妥深度麻醉后,经左心耳取血,分离血清,生化分析仪测定血清TC,TG,ALT,AST,AKP,HDL,LDL的水平。
2.4 HE染色观察肝组织病理学变化
上述取血后的部分大鼠,每组3只,以4 ℃生理盐水经左心耳冲净血液,再经心脏灌注4%多聚甲醛固定1 h。大鼠剖腹,取部分肝右叶,用10%磷酸盐缓冲甲醛固定1 d,再用石蜡包埋,然后切成5 μm厚的切片;以HE染色切片,梯度浓度乙醇脱水,二甲苯透明后以中性树胶封片;显微镜下图像采集分析。
2.5 油红O脂肪染色观察肝脏组织病理变化
上述取血后的另一部分大鼠,每组3只,以4 ℃生理盐水经左心耳冲净血液,迅速开腹去除新鲜肝组织行冰冻切片。实验时将冰冻切片复温干燥,固定液中固定15 min,切片入油红O染液浸染10 min(加盖避光),蒸馏水洗;75%乙醇分化背景,蒸馏水洗。苏木素复染8 min,甘油明胶封片。显微镜镜检,图像采集分析。
2.6 Real-time PCR检测白细胞介素(IL)-1β,IL-6,肿瘤坏死因子(TNF)-α,雌激素受体β(ERβ) mRNA表达
用trizol试剂从肝脏组织中提取细胞总RNA,细胞总RNA 1 μL再加上Prime Script TM Master Mix 4 μL和RNAase-free 15 μL双蒸水配置成反转录反应液,进行反转录反应生成反义cDNA模板,条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ 10 min,最后用5 μL SYBR Green Mix,2 μL cDNA模板,上下游引物(10 μmol·L-1)等配置混合液,PCR仪扩增所需cDNA。PCR扩增条件为95 ℃ 5 s,1次循环,95 ℃ 5 s,60 ℃ 31 s,40次循环。熔解条件为95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。最后通过2-ΔΔCt计算各mRNA相对表达量。引物序列由生工生物工程(上海)股份有限公司合成,见表1。
| 引物 | 序列(5′-3′) | 长度/bp |
|---|---|---|
| IL-1β | 上游GCACAGTTCCCCAACTGGTA | 82 |
| 下游TGTCCCGACCATTGCTGTTT | ||
| IL-6 | 上游CTGGTCTTCTGGAGTTCCGT | 90 |
| 下游TGCTCTGAATGACTCTGGCT | ||
| TNF-α | 上游GGCATGGATCTCAAAGACAACC | 126 |
| 下游AAATCGGACGGTGTGG | ||
| ERβ | 上游GCTACTGCTGAGCACCTTGA | 141 |
| 下游TTGTCCGCCAGCTTAGTGAG | ||
| GAPDH | 上游GCGAGATCCCGCTAACATCA | 178 |
| 下游CTCGTGGTTCACACCCATCA |
2.7 统计学分析
采用SPSS 22.0软件对结果进行分析,实验数据以
3 结果
3.1 对OVX模型大鼠体质量增长率的影响
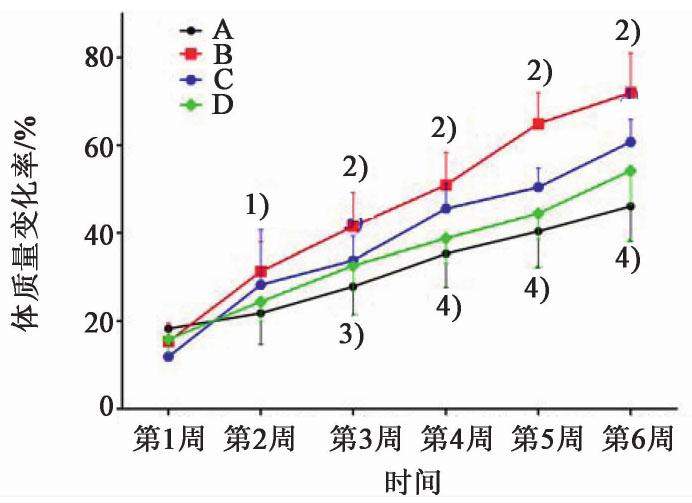
在6周的给药周期中,与假手术组比较,从第2周开始OVX模型组大鼠体质量增长率均明显增加(P<0.05,P<0.01);与OVX模型组比较,逍遥散低剂量组在第3,5,6周体质量增长率明显降低(P<0.05,P<0.01),其余给药周期体质量增长率虽有下降,但差异无统计学意义;逍遥散高剂量组较OVX模型组从第3周开始体质量增长率明显下降(P<0.05,P<0.01)。见图1。
3.2 对OVX模型大鼠血清生化指标的影响
与假手术组比较,OVX模型组TC,ALT,AST,LDL均明显升高(P<0.05,P<0.01)。与OVX模型组比较,逍遥散低剂量组TC水平明显下降(P<0.05),且逍遥散高剂量组TC,ALT,AST,LDL均明显下降(P<0.05),TG,AKP,HDL在各组间差异无统计学意义。逍遥散对OVX模型的肝功能、血脂有改善作用,并呈现一定的量效关系。见表2。
| 组别 | 剂量/g·kg-1 | TC | TG | ALT | AST | AKP | HDL | LDL |
|---|---|---|---|---|---|---|---|---|
| 假手术 | - | 1.30±0.15 | 0.48±0.14 | 35.00±7.13 | 133.95±16.52 | 97.60±26.01 | 0.58±0.09 | 0.28±0.06 |
| OVX模型 | - | 1.62±0.252) | 0.61±0.18 | 50.78±13.391) | 164.29±20.142) | 137.17±55.60 | 0.49±0.10 | 0.36±0.061) |
| 逍遥散 | 3 | 1.36±0.233) | 0.52±0.19 | 45.85±12.36 | 143.57±17.31 | 124.31±45.14 | 0.53±0.12 | 0.30±0.06 |
| 9 | 1.33±0.213) | 0.52±0.16 | 37.44±10.563) | 139.67±18.693) | 121.86±47.08 | 0.56±0.10 | 0.28±0.073) |
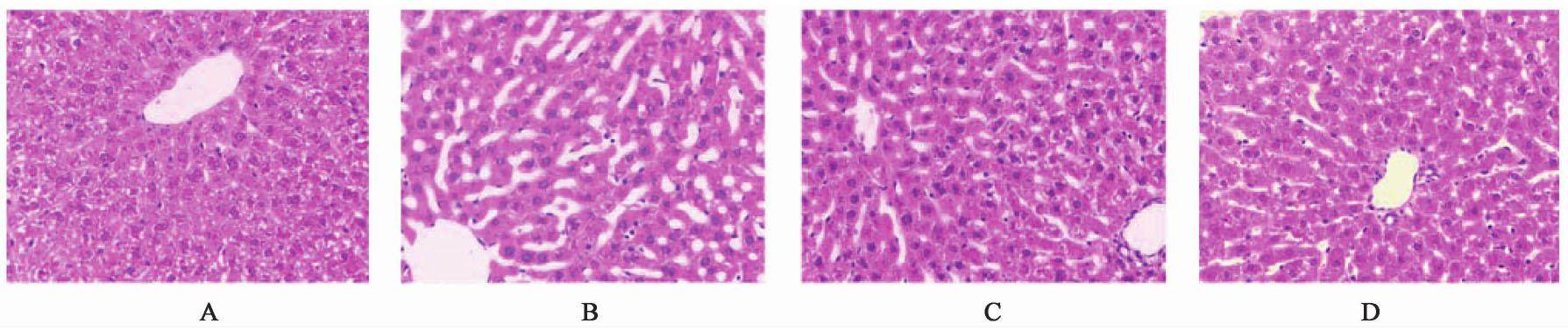
3.3 对OVX模型大鼠肝细胞结构的影响
假手术组大鼠的肝细胞围绕小叶中心静脉呈放射状排列,肝索排列整齐。OVX模型组大鼠肝细胞和肝索排列紊乱无序。经过6周逍遥散干预后,肝索排列成有序形态,逍遥散高剂量组更明显。见图2。
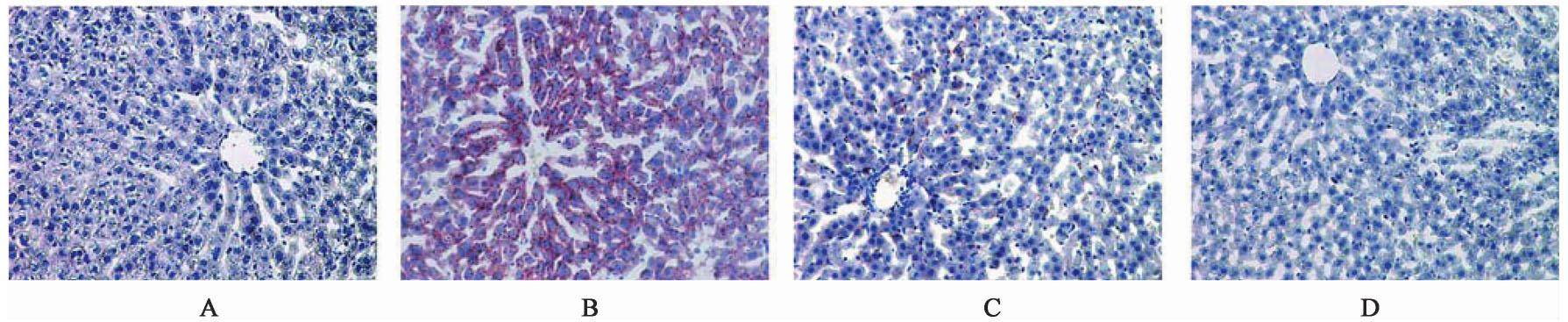
3.4 对OVX模型大鼠肝细胞脂肪变性的作用
由于肝细胞的脂肪变性表现为胞浆脂滴的堆积,细胞浆染色为红色。模型组出现肝细胞胞浆内散在分布的红染,有脂滴堆积,且脂滴数目较假手术组增多。而经过逍遥散干预后,药物组肝细胞的胞浆内红色亮度减弱,肝内脂滴数目减少,且逍遥散高剂量组脂肪染色进一步减少。见图3。
3.5 对OVX模型大鼠肝脏内促炎因子和ERβ mRNA表达
与假手术组比较,OVX模型组IL-1β,IL-6 mRNA水平明显增高(P<0.05);与模型组比较,低剂量逍遥散可明显降低IL-6 mRNA水平(P<0.05),高剂量逍遥散均可显著降低OVX模型组的IL-1β,IL-6 mRNA水平(P<0.05,P<0.01),TNF-α的表达在各组之间的差异没有统计学意义。与假手术组比较,OVX模型组的ERβ相对表达量有降低的趋势,但差异无显著性明显升高;与模型组比较,逍遥散低、高剂量可明显升高OVX模型组ERβ mRNA水平(P<0.05,P<0.01)。见表3。
| 组别 | 剂量/g·kg-1 | IL-1β | IL-6 | TNF-α | ERβ |
|---|---|---|---|---|---|
| OVX模型 | - | 3.495±1.0281) | 1.452±0.1571) | 0.842±0.259 | 0.604±0.095 |
| 逍遥散 | 3 | 1.605±0.876 | 0.873±0.1833) | 1.110±0.498 | 1.467±0.5053) |
| 9 | 0.903±0.2463) | 0.644±0.1714) | 1.179±0.146 | 2.242±0.2544) |
4 讨论
绝经后女性的肥胖属于中医“肥满”“肥人”“胖人”等范畴。《黄帝内经》对其治疗指出“必先别其三形,血之多少,气之清浊,而后调之,治无常经。”《黄帝内经·素问·奇病论》曰:“肥者令人内热……治之以兰,除陈气也。”主张除了对肥胖类型、气血多少清浊的鉴别外,还可以通过芳香清化之品来治疗肥胖及其并发症。中医秉持着五脏藏神的理念,认为“怒伤肝”“思伤脾”,绝经后女性常因情志郁结、饮食不调,伤及脾胃,脾失健运,湿浊内停,气机失于疏泄,肝气郁结,肝胆疏泄失常而发为肥胖。临证常伴见头晕、耳鸣、心悸、失眠、烘热汗出、胸胁作胀、精神抑郁、烦躁易怒、善太息等症[6]。逍遥散作为经典方剂,临床上对各科疾病肝郁脾虚证的治疗效果显著[13-14],其应用范围不局限于某一种疾病,而是疾病发展过程中所出现的症状,即逍遥散方证[15]。通过分析近10年由中国知网(CNKI)数据库收录的关于使用逍遥散的临床报道,得出逍遥散临床治疗常见症状为面色无华或晦暗、倦怠乏力、头晕、头痛、烦热、叹息、抑郁、烦躁、懒言并伴有消化道症状,舌淡苔薄,脉弦或沉细[16]。与绝经后肥胖妇女的症状基本相符,且方中柴胡疏肝解郁,臣以当归、白芍养血敛阴、柔肝缓急,佐以白术、茯苓、甘草健脾益气,更加少许薄荷、生姜作为芳香清化之品来疏散郁遏之气,与《黄帝内经》对肥胖的治则相符。
OVX后的去势雌性大鼠通常用于模拟绝经后女性的状态,且存在血清雌二醇水平降低[17]。既往研究已经证明OVX模型大鼠更易肥胖且会引发代谢综合征,如血脂、血糖异常及非酒精性脂肪肝等[18-19],且与绝经后女性状态基本一致。本研究中OVX模型组较对照组大鼠体质量变化明显增加,出现血脂、肝功能异常,病理显示肝细胞结构紊乱,肝脂肪变性,伴随肝内部分促炎症因子转录水平增加,这些与之前的研究OVX模型大鼠出现的肥胖,血脂异常及非酒精性脂肪肝基本一致[18]。发现逍遥散干预6周后改善了去势雌性大鼠的血清和肝脏内脂肪代谢和肝内炎症过程,说明逍遥散可改善OVX绝经状态大鼠的脂质代谢、修复肝细胞结构和功能。研究发现逍遥散可增加大鼠子宫质量,促进间情期大鼠动情[20];逍遥散可提高OVX大鼠动情周期、增加血清雌二醇及子宫质量,减轻子宫萎缩[21],均阐明逍遥散有雌激素样作用。逍遥散中槲皮素、山柰酚、异鼠李素3种黄酮类成分,均有类雌激素作用[22]。但是逍遥散究竟参与了调节内源性雌激素的分泌与代谢,还是直接作用于ER等途径,尚需进一步研究。
雌激素通过与ERα和ERβ结合而在脂肪组织的分布中起着关键作用。研究发现,即使不激活ERα,单纯使用ERβ选择性激活剂Diarylpropionitrile(DPN)可改善与肥胖相关的代谢疾病[23]。使用4-[2-(3,5-dimethylisoxazol-4-yl)-1H-indol-3-yl]phenol(DIP)选择性激活ERβ可改善非OVX雌性大鼠非酒精性脂肪肝的脂肪变性[24]。 ERβ选择性配体(β-LGNDs)可以通过增加能量消耗,减少脂肪储存,提高肌肉量来减轻雄性大鼠和OVX大鼠的肥胖[25]。另一种ERβ选择性配体β-LGND2还可以间接地调节孕烷X受体和胆汁酸受体两个途径来抑制大鼠的脂肪累积和脂肪性肝炎[26]。因此ERβ在调节脂肪组织和脂质/能量代谢中有重要作用。另外,通过微阵列分析发现ERβ选择性激动剂可以抑制促炎因子如IL-6,IL-8,TNF-α的转录基因[27],从而缓解相关炎症性疾病。总之,选择性激活ERβ可以减少脂质合成、促进外周组织如内脏脂肪组织的脂类动员,提高产热,进而对机体的代谢产生一系列有益的作用[24,28]。本研究发现逍遥散可调高OVX模型大鼠肝内ERβ mRNA转录,且显著降低OVX模型组的促炎因子IL-1β和IL-6转录水平,改善血清和肝脏的脂质代谢。因植物性雌激素对ERβ的亲和力高于ERα[29],因此推测逍遥散调节脂肪代谢可能的作用机制之一是通过激活肝内ERβ发挥效应的,但是逍遥散通过何种信号通路活化ER介导的转录尚待挖掘,将是本课题组下一步工作的重点。
综上所述,逍遥散可以减轻OVX去势大鼠的体质量,纠正其脂质代谢的紊乱,改善脂肪性肝炎,其机制可能与其拟雌激素作用,选择性激活肝内ERβ有关。但逍遥散的成分复杂,可能通过更多途径、靶点以及系统的参与发挥作用,因此还需要更多的研究来探讨其机制。

