新药的研究与开发是一个成本巨大、时间冗长且成功率极低的过程,大量的目标化合物在经过临床前的细胞实验和动物实验之后被淘汰,而进入临床Ⅰ期试验的化合物仍有90%被淘汰[1]。传统的二维细胞实验难以构建细胞及体内组织的真实微环境,也不能实现器官之间的真实串扰[2]。动物实验则耗时长、成本高、存在伦理争议,且由于种属差异导致测试结果难以应用到人类身上[3]。因此,需要开发出更接近人体真实体内情况且成本较低的体外模型以应用于临床前药物筛选。
药物临床前的药物代谢动力学-药物效应动力学(PK-PD)研究对于阐明药物进入人体后的吸收、分布、代谢和排泄及其经时过程等机体对药物的作用,揭示药物效应随时间和浓度变化的动力学过程具有重大意义。目前,用于药物临床前PK-PD研究的模型主要为动物模型,例如大鼠、小鼠、兔子等,然而,动物模型由于存在种属差异经常导致错筛或漏筛等结果,造成了极大的人力和财力损失。微流控芯片技术在微尺度下对流体进行精准操控,实现对生物、化学等样品的微尺度试验,可实现高度集成化、小体积、高通量等目标[4-5]。器官芯片(organ-on-a-chip)是基于微流控技术制造模拟人体器官主要生理特征或功能的系统,该系统可通过微通道及泵阀之间的连接实现细胞或组织之间的串扰连接,可在体外较为真实地反映人体的部分功能[6]。目前,器官芯片研究主要集中在构建单个器官芯片,已有研究人员成功构建了肠芯片[7]、肝芯片[8-11]、肾芯片[12-14]、心脏芯片[15-17]、肺芯片[18-19]等器官芯片,这些器官芯片以在体外实现某个器官的功能为主。将多个不同器官或组织组装在一起的多器官芯片近年来逐渐成为研究热点,Maschmeyer等[20]构建一个整合了肠、肝脏、皮肤和肾的四器官共培养系统,可以实现4个器官的细胞在该系统上共培养达28 d。AN等[21]利用搭建的多器官芯片平台评估药物的抗肿瘤活性、肝毒性及药物代谢动力学,同时开展了多种药物在该芯片上的吸收、分布、代谢、排泄(ADME)过程试验。Sung等[2]利用水凝胶将肝、肿瘤、骨髓的细胞三维共培养于芯片中,在芯片上研究5-氟尿嘧啶的PK-PD过程,所得结果与理论模型计算结果相符合。然而,在目前多器官芯片的构建过程中,器官与器官之间相互独立,各个器官都单独施加一个循环体系。事实上,人体中各器官之间是通过公共血液循环系统相互连接并相互影响的。
本实验拟通过微流控芯片技术构建一个具有公共循环培养通道(模拟公共血液循环),共同培养4种细胞的多器官仿生芯片,这4种细胞分别为Caco-2,HUVEC,HepG2,MCF-7。其中,Caco-2细胞单层可模拟小肠上皮细胞用于构建芯片的吸收功能[7,22],HUVEC细胞单层可在体外模拟血管内皮屏障作用[21],HepG2细胞可用于构建体外代谢研究模型[23],MCF-7细胞是常用的体外乳腺癌模型构建工具[21,24]。通过构建并验证芯片中肠模块、肝模块的功能来实现芯片的吸收、代谢功能,并从检测普萘洛尔的药物浓度-时间曲线和抗肿瘤药物环磷酰胺、紫杉醇、卡培他滨的抗肿瘤活性2个方面研究药物在芯片中的PK-PD过程,该模型有望用于临床前药物筛选,为药物临床前PK-PD研究提供实验根据。
1 材料
HERAcell 150型细胞培养箱和Micro17型高速离心机(美国Thermo公司),Synergy H1型全功能酶标仪(美国BioTek公司),Mili-Q Academic型超纯水仪(美国Millipore公司),BV-30/70型垂直层流超净工作台(西班牙Telstar公司),IX71型倒置荧光显微镜(日本Olympus公司),AUW 120D型电子分析天平(日本Shimadzu公司),205S型蠕动泵(英国Watson-Marlow公司),LSP 10-1B型注射泵(保定兰格恒流泵有限公司),URE-2000/35型紫外深度光刻机(中国科学院光电技术研究院),SC-1B型匀胶机(北京金盛微纳科技有限公司),DGG-9070A型电热恒温鼓风干燥箱(上海森信实验仪器有限公司)。
DMEM高糖培养基,DMEM/F12培养基,DMEM/F12培养基(无酚红),青霉素-链霉素混合溶液(100×双抗)(美国Hyclone公司,批号分别为AE24921270,AE24921272,AC10237765,SV30010);胎牛血清(FBS)和鼠尾Ⅰ型胶原(美国Gibco公司,批号分别为1942017,2084715),环磷酰胺、紫杉醇、普萘洛尔、荧光素钠对照品(美国Sigma公司,批号分别为WXBC7023,T7191,BCBJ2807,061M0048V,纯度依次为97%~103%,≥97%,≥99%,≥99%),卡培他滨对照品(美国Aladinn公司,批号K1406006,纯度≥99%),聚二甲基硅氧烷(PDMS,美国Dow Corning公司,批号0008192937),SU-8 3035胶(美国MicroChem公司,批号17080653),白蛋白测试盒(南京建成生物工程研究所,批号20181219),钙黄绿素(Calcein)-乙酰甲氧基甲酯(AM)/碘化丙啶(PI)活细胞/死细胞双染试剂盒(江苏凯基生物技术股份有限公司,批号20190404),CellTracker Red/Green(美国Invitrogen公司,批号C7025),1 μm聚碳酸酯多孔膜(英国Whatman公司),Hoechst 33342染色液(北京酷来搏科技有限公司,批号SK2040),乳酸乙酯(天津市大茂化学试剂厂,批号20180518),甲醇(色谱纯,瑞典Oceanpak公司)。
人脐静脉内皮细胞株HUVEC,人结肠癌细胞株Caco-2,人肝癌细胞株HepG2,人乳腺癌细胞株MCF-7均为本课题组所在实验室保存所有。
2 方法与结果
2.1 芯片设计及制造
利用Adobe Illustrator CS6绘制芯片掩膜的设计图,见图1。
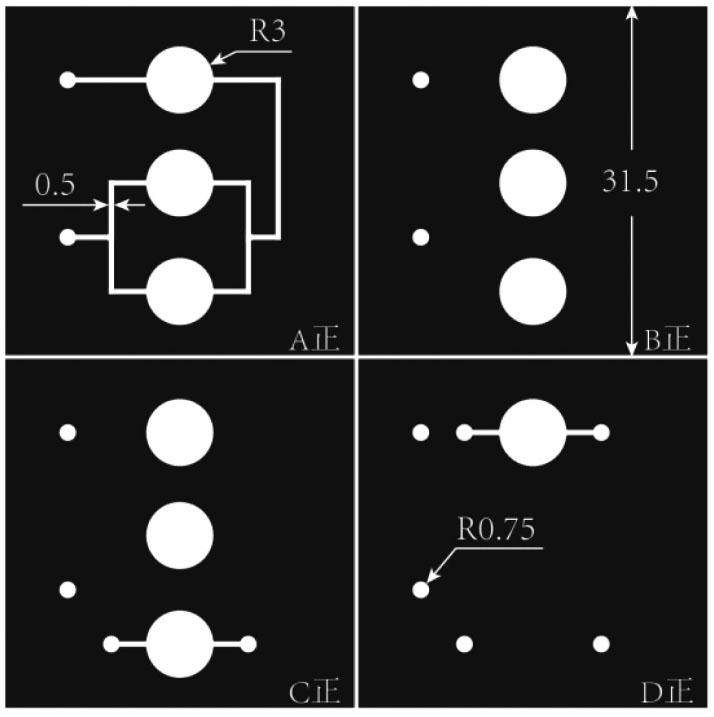
将洗净的75 mm×75 mm玻璃片置于匀胶机上,以1 000 r·min-1(30 s)的速度旋涂SU-8 3035胶于玻璃片上,在烘胶热板上烘干放凉,在其上覆盖63 mm×63 mm的掩膜,置于紫外曝光机下曝光15 s,用乳酸乙酯进行显影后通道显现。然后制作围栏,倒入配制好的PDMS 6 g,在真空烘箱中抽真空至PDMS中无气泡,取出放至80 ℃烘箱中30 min使得PDMS固化,分离SU-8 3035模板和固化的PDMS,有通道的部分打孔,按照叠加顺序将PDMS基板置于等离子体机中照射3 min,进行PDMS间的不可逆封接。待聚碳酸酯多孔膜上细胞层培养成熟后,按图2所示芯片结构组装芯片,用螺丝将芯片固定,用特氟龙管连接芯片与蠕动泵,设置蠕动泵流速为2 μL·min-1,开启蠕动泵进行流动循环培养。
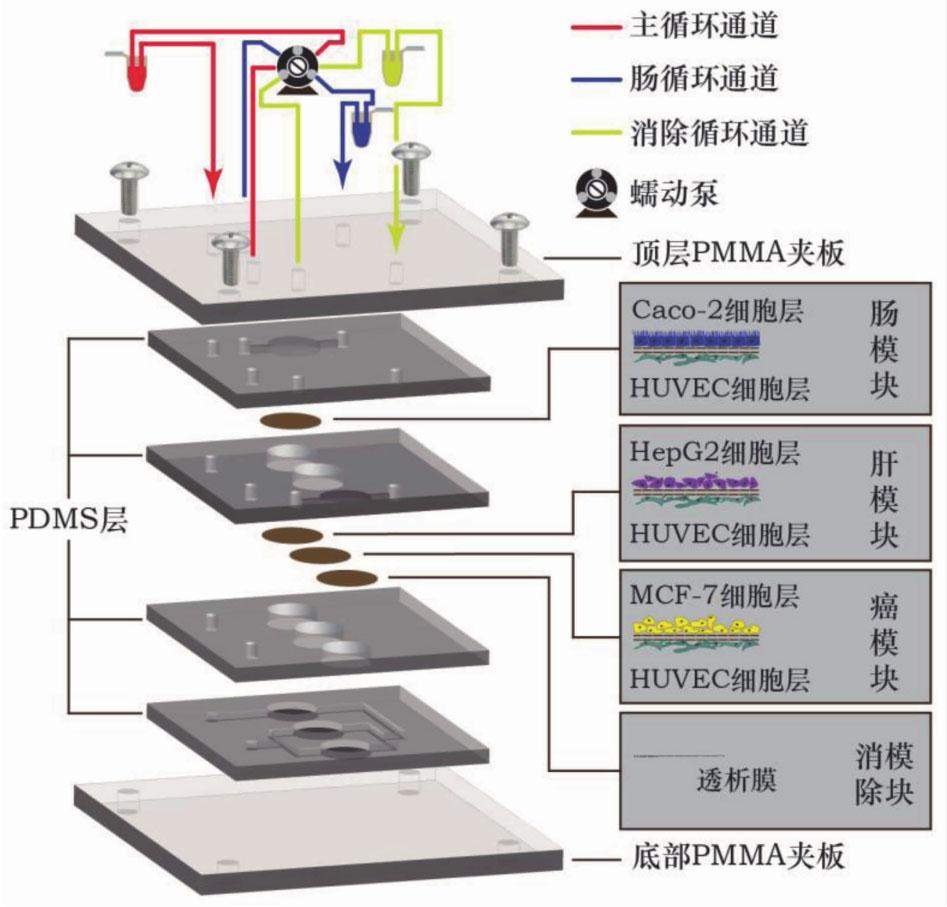
本研究设计了一种肠-肝-乳腺癌PDMS芯片,该芯片共2层,并有3条独立运行的通道,上层为肠模块,由朝上的Caco-2细胞层和背靠朝下的HUVEC细胞层组合而成,上方通循环液,为肠循环通道;下层有3个腔室,分别为朝上的HepG2细胞层与背靠朝下的HUVEC细胞层构成的肝模块、朝上的MCF-7细胞层与背靠朝下的HUVEC细胞层构成的乳腺癌模块、透析膜模拟的消除模块,在3个下层模块的下方通公共循环培养液,该循环培养液可为肝模块、乳腺癌模块和消除模块同时提供营养物质,类似于体内的公共血液循环系统,透析膜上方设计有消除通道。
2.2 细胞与细胞层培养
HUVEC细胞和MCF-7细胞均用DMEM/F12+10%FBS+1%青霉素-链霉素混合溶液(100×双抗)培养液(简称F12培养液)培养,Caco-2细胞和HepG2细胞均用DMEM高糖培养基+10%FBS+1%青霉素-链霉素混合溶液(100×双抗)(简称DMEM培养液)培养,于37 ℃,5%CO2饱和湿度的恒温培养箱内进行传代培养。将孔径为1 μm的透明聚碳酸酯多孔膜用直径8 mm的打孔笔裁剪成直径8 mm的圆片,浸于75%乙醇中24 h,取出置于35 mm培养皿中,随后用超纯水冲洗3次后紧密排布于35 mm培养皿中,随后用5 μg·cm-2的鼠尾Ⅰ型胶原包被皿中晾干的多孔膜,分别将消化成细胞悬液的Caco-2细胞,HepG2细胞,HUVEC细胞和MCF-7细胞接种于4个包被有多孔膜的皿中,各细胞的接种密度分别为8×104,1×105,1×105,8×104个/cm2,成熟时间分别为17~22,1,3,1 d。
2.3 肠模块的构建及其功能验证
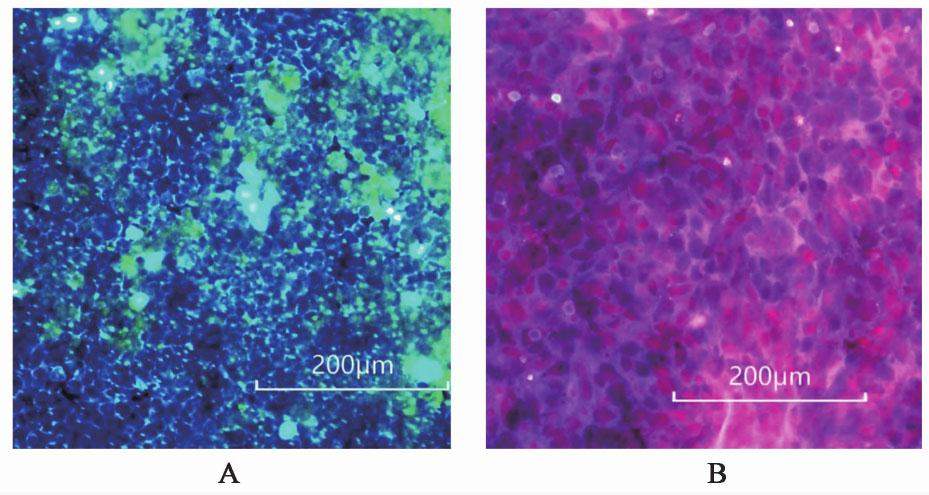
分别使用CellTracker Red/Green和Hoechst 33342染色液对生长21 d的Caco-2细胞层和生长3 d的HUVEC细胞层进行染色,考察细胞间的连接情况。图3为Caco-2在多孔膜上生长21 d和HUVEC在多孔膜上生长3 d后的染色照片,结果发现这2种细胞在多孔膜表面完全铺满、连接紧密。
配制质量浓度分别为0.5,0.05,0.025,0.005,0.002 5,0.000 5 mg·L-1的荧光素钠对照品溶液,在酶标仪中测定荧光强度(激发波长488 nm,发射波长530 nm,下同),以质量浓度为横坐标,荧光强度为纵坐标,绘制标准曲线,得拟合直线方程Y=146 582X+3 566.6(R2=0.998 8)。在芯片第一、二层PDMS间夹入培养21 d的Caco-2细胞多孔膜,在细胞层上层通道中分别通入含2 g·L-1荧光素钠和33.28 mg·L-1普萘洛尔的无酚红DMEM/F12空培养基,下层通无酚红DMEM/F12空培养基,启动注射泵单向灌流培养,每隔30 min取下层培养基50 μL,共取5次。将Caco-2细胞多孔膜分别换成空多孔膜和培养3 d的HUVEC细胞多孔膜,重复同样的实验。在酶标仪中检测荧光强度,计算样品溶液中荧光素钠的质量浓度。配制质量浓度分别为66.56,33.28,16.64,8.32,4.16,2.08,1.04,0.52 mg·L-1的普萘洛尔对照品溶液,采用HPLC测定普萘洛尔的质量浓度,色谱条件为流动相0.2 mol·L-1磷酸二氢钾-水-甲醇(2∶43∶55),ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),检测波长210 nm。以质量浓度为横坐标,峰面积为纵坐标,得拟合直线方程Y=72.733X-7.735 4(R2=0.997 9),根据该方程计算样品溶液中普萘洛尔的质量浓度。
根据公式Papp=ΔQ/(Δt×A×C0)计算荧光素钠的透过率,其中ΔQ为相邻2次下层培养液样品中待测物的量差值,用公式C2V2-C1V1计算,单位为mg,C1,C2和V1,V2分别为相邻2次下层培养液样品溶液的质量浓度和体积;Δt为1 800 s;A为传质面积0.282 7 cm2;C0为上层培养液中初始荧光素钠质量浓度2 g·L-1。普萘洛尔透过率计算方法同荧光素钠,其中C0=33.28 mg·L-1。见表1。结果发现荧光素钠在Caco-2细胞层的透过率低于普萘洛尔在Caco-2细胞层的透过率2个数量级,荧光素钠和普萘洛尔在HUVEC细胞层的透过率相差不大。
| 药物 | 质量浓度/mg·L-1 | Caco-2细胞层 | HUVEC细胞层 |
|---|---|---|---|
| 荧光素钠 | 2 000 | 4.614×10-7±2.823×10-7 | 4.558×10-6±3.529×10-6 |
| 普萘洛尔 | 33.28 | 1.225×10-5±0.238×10-5 | 7.698×10-6±1.009×10-6 |
2.4 肝模块的构建及其代谢水平考察
取一块96孔板(记为孔板1),每孔接种6 000个HepG2细胞,用DMEM培养液培养。24 h后移走DMEM培养液,在6个孔中分别加入含125 μmol·L-1环磷酰胺的DMEM培养液200 μL,作为组一;在另外6个孔中分别加入DMEM培养液200 μL,作为组二。同时另取一块96孔板(记为孔板2),在24个孔中分别接种6 000个MCF-7细胞,用F12培养液培养。将上述2块孔板置于37 ℃恒温培养箱中培养12 h。然后将孔板2的F12培养液全部移出,将孔板2的24个孔平均分成4组,分别记为实验组1~3和空白组,分别加入孔板1中组一的培养液、孔板1中组二的培养液、含125 μmol·L-1环磷酰胺的DMEM培养液以及DMEM培养液200 μL,将孔板2置于37 ℃恒温培养箱中孵育48 h后移出培养液,加入含0.5 g·L-1噻唑蓝(MTT)的磷酸盐缓冲液(PBS,pH=7.2)200 μL孵育4 h,弃去PBS,晾干后加入二甲基亚砜(DMSO)150 μL,震荡15 min,于490 nm处测定吸光度A,按公式抑制率=(A空白组-A实验组)/A空白组计算药物对MCF-7细胞的增殖抑制率,结果实验组1~3的MCF-7细胞增殖抑制率分别为(22.12±8.74)%,(3.06±5.46)%,(1.84±4.68)%,说明环磷酰胺在孔板上经HepG2细胞处理后抗肿瘤活性有很大提高。
在芯片第二、三层PDMS间的肝模块和乳腺癌模块腔室处分别背对夹入HepG2,HUVEC细胞层和MCF-7,HUVEC细胞层,上层肠循环通道和下层主循环通道分别通入DMEM培养液流动培养12 h,然后将上层循环液换成含125 μmol·L-1环磷酰胺的DMEM培养液作为实验组1,下层循环液换成含125 μmol·L-1环磷酰胺的DMEM培养液作为实验组2,实验组3为上、下层均为DMEM培养液。芯片循环流动培养48 h后,拆开芯片取下MCF-7细胞层置于48孔板中,加入含0.5 g·L-1 MTT的PBS 200 μL孵育4 h,弃去PBS,晾干后加入DMSO 200 μL,震荡15 min后取出样品溶液150 μL加入96孔板中,于490 nm处测定A,计算实验组1~3的MCF-7细胞增殖抑制率分别为(32.13±2.51)%,(7.23±0.96)%,(4.72±0.83)%。说明含125 μmol·L-1环磷酰胺的培养液从芯片上层肠循环通道注入芯片循环培养48 h后对MCF-7的增殖抑制率高于孔板实验组1的抑制率,而从下层主循环通道注入芯片循环培养48 h后对MCF-7的增殖抑制率比孔板实验组3中未被HepG2细胞代谢的环磷酰胺所引起的抑制率要高。
同时,在芯片空白组中每隔24 h采集HepG2细胞层上侧循环液10 μL,用白蛋白测试盒检测所采集循环液中白蛋白的质量浓度。结果发现循环培养1,2,3 d时白蛋白分泌量依次为(4.659±0.508),(4.055±0.572),(4.366±0.904) g·L-1,说明循环培养3 d内白蛋白的分泌量基本稳定。
2.5 药物质量浓度随时间变化趋势的检测
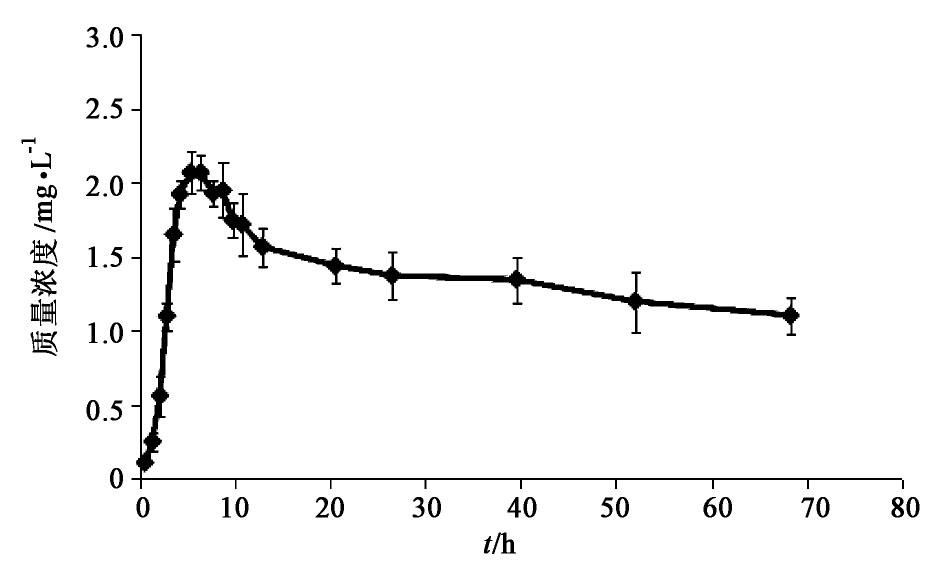
在芯片肠循环通道通入含55 mg·L-1普萘洛尔的DMEM培养液,开启蠕动泵循环培养4 h后更换成正常的DMEM培养液,在每个采样时间点时取出下层循环液20 μL置于离心管中,在采集的样品溶液中分别加入甲醇20 μL吹匀,于12 000 r·min-1离心15 min,移取上清液置于高效液相色谱仪中检测,计算样品溶液中普萘洛尔的质量浓度,以时间为横坐标轴,普萘洛尔质量浓度为纵坐标轴,绘制药物浓度-时间曲线,见图4。结果发现在初始阶段,普萘洛尔在培养液中质量浓度随时间的增加而快速上升,于6 h左右达最大值,之后就随着时间增加而缓慢下降。
2.6 抗肿瘤药物的活性检测
在芯片肠循环通道中分别通入含125 μmol·L-1环磷酰胺,5 μmol·L-1紫杉醇,50 μmol·L-1卡培他滨的DMEM培养液,开启蠕动循环培养72 h,拆开芯片取下MCF-7细胞层置于48孔板中,加入含0.5 g·L-1 MTT的PBS 200 μL孵育4 h,弃去PBS,晾干后加入DMSO 200 μL,震荡15 min后取出样品溶液150 μL加入96孔板中,于490 nm处测定A。
取1块96孔板(记为孔板1),每孔接种6 000个HepG2细胞,用DMEM培养液培养,24 h后移出所有DMEM培养液,分别加入含125 μmol·L-1环磷酰胺,5 μmol·L-1紫杉醇,50 μmol·L-1卡培他滨的DMEM培养液200 μL;另取1块96孔板(记为孔板2),在12个孔中分别接种6 000个MCF-7细胞,用F12培养液培养。上述2块孔板均置于37 ℃恒温培养箱培养24 h,将孔板2中的F12培养液全部移出,将孔板2的12个孔平均分成4组,分别记为环磷酰胺组、紫杉醇组、卡培他滨组、空白组,每组3个孔,分别加入孔板1含125 μmol·L-1环磷酰胺的DMEM培养液,含5 μmol·L-1紫杉醇的DMEM培养液,含50 μmol·L-1卡培他滨的DMEM培养液以及DMEM培养液200 μL。将孔板2置于培养箱中孵育48 h后移出培养液,加含0.5 g·L-1 MTT的PBS 200 μL孵育4 h,弃去PBS,晾干后加入DMSO 150 μL,震荡15 min,在酶标仪中检测样品溶液在490 nm处的A。
芯片试验与孔板试验中环磷酰胺、紫杉醇、卡培他滨对MCF-7细胞的72 h抑制率见表2。结果发现环磷酰胺在芯片上对MCF-7细胞的抑制效果要高于孔板。卡培他滨在孔板上经HepG2处理后对MCF-7细胞的抑制率接近50%,但在芯片上对MCF-7细胞的抑制率则有所降低。紫杉醇在孔板上经HepG2处理后对MCF-7细胞的抑制率要高于其在芯片上的抑制率。
| 药物 | 浓度/μmol·L-1 | 孔板试验 | 芯片试验 |
|---|---|---|---|
| 环磷酰胺 | 125 | 23.89±2.43 | 34.39±5.13 |
| 卡培他滨 | 50 | 48.92±3.21 | 36.59±4.01 |
| 紫杉醇 | 5 | 78.01±2.32 | 56.17±6.96 |
2.7 统计学分析
所有数据均用Microsoft Excel 2010软件进行分析与整理,组内采用单因素方差分析,组间比较采用t检验,各组数据采用
3 讨论
口服药物入胃后经幽门进入小肠,在小肠绒毛处被吸收,经肠系膜静脉进入血液,经门静脉到达肝脏,在肝脏中被肝细胞的肝微粒体酶代谢后进入肝静脉,然后随血液汇入下腔静脉,经下腔静脉进入右心房,经左心房的主动脉泵出,然后跟随体内丰富的血管分布到达全身各处(包括靶器官),经过一段时间之后,药物逐渐经肾动脉进入肾脏,最后经肾脏消除作用排出体外。基于上述过程,本研究设计并构建了一种包含肠模块、肝模块、乳腺癌模块及透析膜消除模块的多器官芯片,在该芯片中同时设计有肠腔循环通道、公共循环通道及物质消除通道,芯片各模块通过微流体实现连接,通过蠕动泵实现系统的封闭循环,培养液灌注流速为2 μL·min-1,实验中可利用各种检测手段实时监测芯片中目标生物标记物或目标药物的变化情况。
为确保构建的芯片具备吸收和代谢的功能,需对构建的肠模块与肝模块进行功能验证。药物在体内经小肠处的小肠绒毛吸收,小肠绒毛处由肠上皮细胞和毛细血管内皮细胞构成,故本研究选择Caco-2细胞层和HUVEC细胞层在体外分别模拟肠上皮细胞和血管内皮细胞[25],以模拟小肠吸收情况。实验中通过检测荧光素钠和普萘洛尔在细胞层间的透过率来考察这2个细胞层的物质运输能力,结果发现同为小分子的荧光素钠和普萘洛尔在HUVEC细胞层中透过率相差较小,这符合小分子物质在血管内皮间自由扩散的特性,可用于构建血管内皮屏障;而Caco-2细胞层中的荧光素钠透过率很低,且低于普萘洛尔透过率2个数量级,表明荧光素钠不易被Caco-2细胞层吸收,普萘洛尔则因被动转运而被良好转运[26],说明构建的Caco-2细胞层具有良好的选择透过性,可用于构建体外肠吸收模型,同时也说明芯片封接的紧密性良好。体内药物代谢的主要部位是肝脏,药物在肝细胞中被代谢。本研究利用HepG2细胞构建了肝代谢模块,利用前药环磷酰胺考察HepG2细胞的代谢水平,环磷酰胺在铺满HepG2细胞的孔板中被代谢12 h后对MCF-7细胞的48 h增殖抑制率要低于在芯片中的结果,说明其在芯片上能提高HepG2细胞的代谢水平,这可能与芯片结构中的流动培养及细胞间的相互作用有关,而且其他细胞分泌的因子有可能会促进HepG2细胞的代谢。而环磷酰胺注入芯片下层主循环通道循环培养48 h后对MCF-7细胞的增殖抑制率高于孔板中没有被代谢的环磷酰胺所引起的增殖抑制率,这可能是因为主循环通道培养液中的环磷酰胺渗透到HepG2细胞层后被代谢,然后再转到下层培养液所致,这也证明该芯片中各通道间可实现物质交换。在芯片运行的3 d内白蛋白的分泌量保持稳定,表明芯片结构能够保持HepG2细胞的活力。综上所述,本研究中构建的多器官芯片具备良好的肠吸收和肝代谢功能。
通过考察药物在构建的肠-肝-乳腺癌芯片上的PK-PD特性来研究芯片的生理功能。口服药物进入体内被吸收代谢后进入下腔静脉然后到达心脏,经心脏动脉泵出后分布到全身各处,从而引起药物效应,最后被肾脏消除排出体外,这个过程使得口服药物的血药浓度随着时间变化的曲线呈“几”字形。本研究利用含有吸收、透血管、代谢及消除功能的芯片检测并绘制的普萘洛尔药-时曲线大致走向与已有研究的普萘洛尔体内药-时曲线相似[27],但达峰时间延长至6 h左右,且到达峰值后消除速度变得很慢,这可能是由于透析膜的透过消除作用与肾脏的消除作用差异较大造成的。普萘洛尔药-时曲线结果表明构建的多器官芯片具备良好的PK特性。抗肿瘤活性测试结果在孔板和芯片上均有较为明显的差距,其中在芯片上环磷酰胺对MCF-7的72 h抑制率较孔板结果有所增强,即抗肿瘤活性有所提高,卡培他滨和紫杉醇在芯片上对MCF-7的72 h抑制率较孔板结果均有所下降,这可能是因为Caco-2细胞层和HUVEC细胞层所形成的屏障减小了紫杉醇和卡培他滨透到下层的量,进而降低了其抗肿瘤活性。这也说明构建的多器官芯片具备良好的PD特性。
本研究根据口服药物进入人体的过程设计了包含肠吸收、肝代谢、透析膜透过消除及乳腺癌病灶的多器官微流控芯片,在体内过程中,血管屏障及血液是物质运输与交换的重要载体[28],而心脏主导的公共血液循环系统使得体内各器官之间实现信息互通[29],说明体外构建人体模型时包含血管屏障的公共循环系统是仿生模型的重要一环,然而现有的多器官芯片系统中尚无同时综合血管屏障和公共循环系统进行研究的报道。例如AN等[21]研发的用于ADME研究的多器官芯片中考虑了血管屏障的作用,但各器官之间需单独提供循环培养液,并没有考虑公共血液循环系统。Maschmeyer等[20]所构建的四器官芯片中的替代血液回路能够同时为4种器官提供营养物质,但4个器官处在同一条回路上,且没有考虑血管屏障作用,这种结构与体内公共血液循环系统相去甚远。ZHANG等[3]和Kimura等[30]研究的多器官芯片系统设计了公共循环通道,然而结构中都没有设计血管屏障。在本研究的芯片结构设计中,消除模块之外的各模块均有HUVEC细胞层与培养液直接连通,这能够起到血管屏障及物质运输的作用,而公共循环培养通道可同时为肝模块、乳腺癌模块和透析膜消除模块提供营养物质,芯片中同时包含血管屏障和公共循环系统是本研究有别于其他多器官芯片的设计,使得本芯片结构设计更仿生。功能验证结果表明本研究构建的多器官芯片具备良好的吸收、代谢功能以及良好的PK-PD生理特性,这种基于微流控技术的多器官芯片可实现流体剪切力、细胞间相互作用等细胞微环境,可为临床前药物筛选提供理想的研究平台。然而,本研究中用于构建器官的人源细胞系虽然能表现出正常人体细胞的部分功能,但还是有较大差距,而且消除模块选用的透析膜与体内复杂的肾脏消除过程也尚有较大差距,同时芯片结构中构建的器官数量较少,而器官数量越多则各器官之间的串扰更能体现真实的体内情况。
综上所述,本研究根据口服药物进入人体的过程设计了包含肠吸收、肝代谢、透析膜透过消除及乳腺癌病灶的多器官微流控芯片,芯片在结构上设计了一个同时为肝模块、乳腺癌模块、消除模块提供营养物质的主循环通道,使得结构设计更加仿生。利用普萘洛尔和荧光素钠的跨细胞膜透过率来验证肠模块的功能,通过测定白蛋白分泌量及环磷酰胺代谢前后的药效来验证肝模块的功能,并利用芯片考察了普萘洛尔的药物浓度随时间变化的关系和抗肿瘤药物环磷酰胺、紫杉醇、卡培他滨的抗肿瘤活性,所得普萘洛尔药-时曲线与体内趋势相似,肠模块的存在使得芯片上紫杉醇和卡培他滨的抗肿瘤活性明显不同于孔板。在后续研究中可换成更接近人体正常细胞的原代细胞,并通过优化芯片结构设计加入更多的器官从而使得系统更仿生,进而为药物筛选提供更加可靠的体外模型。

