2型糖尿病(T2DM)是以血糖增高为特征的代谢性疾病,该疾病由胰岛素受损所致[1]。目前,治疗T2DM的西药多针对单靶点进行研发,其降糖效果虽然明显,但长期使用容易引起多种不良反应,如低血糖、酮酸中毒、肥胖、心血管疾病等[2]。
金芪降糖片(Z10920027)是由黄芪、黄连、金银花组成的中药复方制剂,具有清热益气的功效,该方具有良好的降血糖、降血脂作用,临床用于治疗轻、中度非胰岛素依赖型糖尿病[3]。然而,截至目前,金芪降糖片治疗T2DM的药效物质基础尚不明确。
超高效液相色谱仪联用四级杆串联飞行时间质谱(UPLC-Q-TOF-MS)技术,不仅具备UPLC高效的分离能力,同时Q-TOF拥有高分辨的定性能力,相对其他定性方法而言,该方法具有准确度高、通用性好以及灵活便捷的特点,已逐渐成为中药复杂体系中化学成分快速分离和鉴定的有效手段[4]。分子对接是利用计算机模拟药物分子产生药效反应的过程,通过蛋白质大分子受体与药物小分子之间的相对位置和取向了解两者之间的相互作用,从而推测出药物起效的作用机制[5]。分子对接具有方便、快捷和成本低的优势,其广泛应用于计算机辅助药物设计、先导化合物的开发以及分子靶点的确证[6]。可见,在药物设计以及探讨药物作用机制的过程中,分子对接技术处于重要地位。
基于以上研究现状,本文整合LC-MS与分子对接技术探讨金芪降糖片治疗T2DM的药效物质基础。采用UPLC-Q-TOF-MS分析其化学成分,在此基础上,结合在线疾病数据库和蛋白互作筛选靶点,进而采用分子对接验证金芪降糖片中化学成分与疾病靶点的相互关系,寻找金芪降糖片治疗T2DM的潜在药效物质基础。
1 材料
金芪降糖片(天津中新药业集团股份有限公司隆顺榕制药厂,批号FD87103),甲醇、乙腈、甲酸(赛默飞世尔科技有限公司),0.22 μm有机微孔滤膜(津腾实验设备有限公司)。
ACQUITY UPLC Class I型超高效液相色谱仪,SYNAPT G2-Si Q-TOF/MS型原位离子敞度高分辨质谱仪,ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)(美国Waters公司);Milli-Q型超纯水仪(美国Millipore公司),数据处理软件MassLynx 4.1,分子显示软件PyMOL,分子对接软件AutoDock Tool 1.5.6。
2 方法
2.1 溶液的配制
称取去除包衣的金芪降糖片粉末0.5 g左右至100 mL量瓶中,甲醇定容至刻度,超声提取1 h,0.45 μm的微孔滤膜滤过,备用。
2.2 分析条件
2.2.1 色谱条件
Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相0.1%甲酸水(A)-0.1%甲酸乙腈(B),梯度洗脱(0~14 min,2%B;14~16.5 min,2%~60%B;16.5~18 min,60%~98%B;18~20 min,98%B),流速0.3 mL·min-1,柱温40 ℃,进样量5 μL。
2.2.2 质谱条件
采用电喷雾离子源(ESI),在正、负离子模式下分别进行质谱检测分析。使用高纯N2作为辅助喷雾电离与脱溶剂气体,干燥气流速10 mL·min-1,N2温度120 ℃,雾化气气压310 kPa,脱溶剂氮气流速900 L·h-1,锥孔反吹氮气50 L·h-1。毛细管电离电压500 V,锥孔电压40 V,碰撞能量为40~65 eV,四极杆扫描范围为50~1 200 Da。
2.3 金芪降糖片治疗“2型糖尿病-作用靶点”的获取
2.3.1 基于在线数据库查找“2型糖尿病-作用靶点”
以“type 2 diabetes mellitus”为关键词,通过基因组学毒理数据库Comparative Toxicogenomics Database,CTD(http://ctdbase.org/)查找T2DM的疾病治疗靶点。
2.3.2 靶蛋白互作网络(PPI)的构建与分析
基于String数据库(https://string-db.org/cgi/input.pl),将所获取的金芪降糖片治疗T2DM的靶点导入,选择人源物种,导出TSV格式结果。将此结果一并导入Cytoscape软件绘制相互作用网路,以Degree反映网络中节点的大小,得到金芪降糖片治疗T2DM的蛋白相互作用网络,并用Cytoscape中的“Network Analyer”功能对PPI网络进行拓扑学分析,将Degree前3的靶点作为网络中的关键靶点。
2.4 分子对接
2.4.1 配体分子准备
从ZINC(http://zinc.docking.org/)数据库下载小分子配体(mol2格式),AutoDock Tool 1.5.6软件对配体小分子配体进行处理,包括添加极性氢原子和Gasteiger电荷等过程,之后保存相应的pdbqt格式。
2.4.2 受体分子准备
从RCSB PDB(http://www.rcsb.org/)蛋白质数据库获得蛋白质受体的晶体结构,CAT,PPARG和INSR受体对应的PBD ID分别是1DGF,1FM9和1IR3。利用PYMOL软件去除水分子和蛋白质受体中的原有配体,以pdb格式保存。通过AutoDock Tool 1.5.6软件,在大分子受体上添加极性氢原和Gasteiger电荷等过程,之后保存相应的pdbqt格式。
2.4.3 分子对接过程
在AutoDock Tool 1.5.6软件中,利用AutoGrid设置网格大小和参数,运行生成相应的文件,选择拉马克遗传算法预测受体和配体分子的最佳结合位置,最后运行AutoDock进行分子对接计算实验运算。对接结果以结合自由能(binding energy,ΔGbind)和估计抑制常数(inhibit constant,Ki)作为参考指标。
3 结果
3.1 金芪降糖片化学成分的鉴定
考虑到金芪降糖片中复杂的化学成分,因此本研究采用正(+),负(-)两种ESI电离模式对金芪降糖片的化学成分进行全扫描,以尽可能多的鉴定其化学成分。见图1。
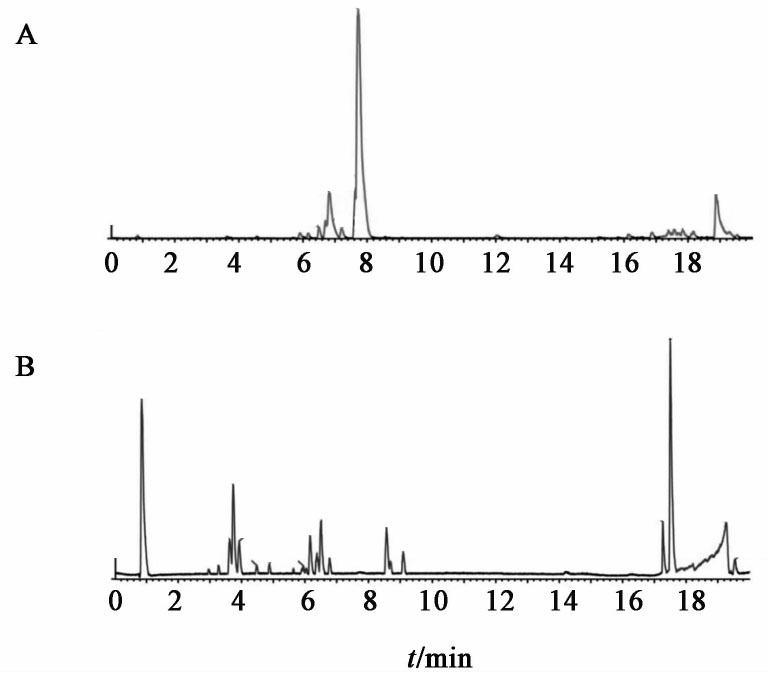
UPLC-Q-TOF-MS分析进程结束后,通过MassLynx 4.1软件对峰值进行检测、校准、采集得到原始数据。参数如下,保留时间0~20 min,m/z 50~1 200 Da;消除噪声水平6。然后转换成Excel格式,包括保留时间,m/z及各组峰面积等。数据通过处理得到目标化合物。最后,由数据库确定提取目标化合物,并通过二级碎片和对照品比对进行鉴定。金芪降糖片共鉴定出51个化学成分,其中黄芪31个,黄连16个,金银花4个[7-33]。见表1。
| No. | tR/min | 加和离子 | 测定值m/z | 计算值m/z | δ/ppm | 特征离子 | 化学式 | 鉴定 | 来源 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.77 | [M-H]- | 131.044 4 | 131.045 7 | -9.92 | 131.044 4[M-H]-,114.020 1[M-H-NH3]-,113.037 8[M-H-H2O]-,95.032 6[M-H-CH2O2]- | C4H8N2O3 | asparagine[7,11] | A |
| 2 | 0.86 | [M+HCOO]- | 387.111 7 | 387.113 9 | -5.67 | 387.111 7[M+HCOO]-,341.111 9[M-H]-,179.054 2[M-H-glc]- | C12H22O11 | disaccharide[7] | A |
| 3 | 0.78 | [M-H]- | 503.164 8 | 503.161 2 | 7.15 | 503.164 8[M-H]-,161.049 8[M-2H-2glc]- | C18H32O16 | raffinose[7] | A |
| 4 | 1.59 | [M-H]- | 134.047 5 | 134.046 7 | 5.97 | 134.047 5[M-H]-,107.038 7[M-H-HCN]- | C5H5N5 | adenine[7] | A |
| 5 | 4.66 | [M-H]- | 371.135 3 | 371.134 2 | 2.96 | 371.135 3[M-H]-,209.044 6[M-H-glc]- | C17H24O9 | syringin[7] | A |
| 6 | 2.77 | [M-H]- | 153.018 1 | 153.018 8 | -4.57 | 153.018 1[M-H]-,109.032 4[M-H-CO2]- | C7H6O4 | 原儿茶酸[7] | A |
| 7 | 5.1 | [M-H]- | 433.132 6 | 433.134 6 | -4.62 | 433.132 6[M-H]-,139.004 5[M-H-C5H8O4-glc]-,301.098 6[M-H-C5H8O4]- | C18H26O12 | markhamioside F[7] | A |
| 8 | 3.51 | [M-H]- | 137.023 2 | 137.023 9 | -5.11 | 137.023 2[M-H]-,93.036 5[M-H-CO2]-,75.003 8[M-H-H2O-CO2]- | C7H6O3 | 羟基苯甲酸[7] | A |
| 9 | 3.91 | [M-H]- | 193.051 4 | 193.050 1 | 6.73 | 193.051 4[M-H]-,178.995 8[M-H-CH3]-,149.060 6[M-H-CO2]-,134.037 3[M-H-CO2-CH3]- | C10H10O4 | 阿魏酸[7-8] | A |
| 10 | 5.97 | [M-H]- | 623.158 9 | 623.161 2 | -3.69 | 623.158 9[M-H]-,461.189 5[M-H-glc]-,299.024 7[M-H-2glc]- | C28H32O16 | rhamnocitrin3,4′- di-O-glucoside[7] | A |
| 11 | 4.11 | [M+HCOO]- | 225.038 0 | 225.039 9 | -8.44 | 225.038 0[M+HCOO]-,179.036 7[M-H]-,135.044 5[M-H-CO2]-,117.033 0[M-H-CO2-H2O]- | C9H8O4 | 咖啡酸[7-8] | A,L |
| 12 | 6.49 | [M-H]- | 461.105 1 | 461.108 4 | -7.16 | 461.105 1[M-H]-,299.055 0[M-H-glc]-,284.038 1[M-H-glc-CH3]- | C22H22O11 | pratensein-7-O-glucoside[7] | A |
| 13 | 4.93 | [M+HCOO]- | 269.064 0 | 269.066 1 | -7.80 | 269.064 0[M+HCOO]-,223.062 9[M-H]-,205.002 3[M-H-H2O]-,179.030 8[M-H-CO2]-,163.035 4[M-H-2CH2O]-,161.044 3[M-H-H2O-CO2]- | C11H12O5 | sinapic acid[7] | A |
| 14 | 6.27 | [M-H]- | 431.098 1 | 431.097 8 | 0.70 | 431.098 1[M-H]-,269.042 5[M-H-glc]- | C21H20O10 | cosmosiin[7] | A |
| 15 | 6.58 | [M+Cl]- | 223.075 9 | 223.073 7 | 9.86 | 223.075 9[M+Cl]-,187.099 9[M-H]-,169.082 3[M-H-H2O]-,143.862 9[M-H-CO2]-,125.096 3[M-H-H2O-CO2]- | C9H16O4 | azelaic acid[7] | A |
| 16 | 7.95 | [M-H]- | 463.162 1 | 463.160 4 | 3.67 | 463.162 1[M-H]-,301.030 3[M-H-glc]-,271.054 8[M-H-glc-CH3O]- | C23H28O10 | isomucronulatol-7-O-glucoside[7] | A |
| 17 | 3.61 | [M-H]- | 353.085 9 | 353.087 3 | -3.97 | 353.085 9[M-H]-,191.053 2[M-H-Caffeyl]-,173.042 6[M-H-Caffeyl-H2O]-,161.026 7[M-H-quinine acyl]- | C16H18O9 | 绿原酸[10] | A |
| 18 | 0.80 | [M+H]+ | 203.052 8 | 203.053 2 | -1.97 | 203.052 8[M+H]+,143.019 8[M+Na-C2H4O2]+ | C6H12O6 | 己糖[9] | A |
| 19 | 0.84 | [M+H]+ | 132.099 7 | 132.102 5 | -2.27 | 132.099 7[M+H]+,86.950 0[M+H-CH2O2]+ | C6H13NO2 | 高氨酸[10] | A |
| 20 | 10.01 | [M+H]+ | 269.084 6 | 269.082 4 | 8.18 | 269.084 6[M+H]+,253.837 5[M+H-C15H7O4]+,225.476 5[M+H-C14H7O3]+ | C16H12O4 | formononetin[11-12] | A |
| 21 | 5.58 | [M+H]+ | 595.166 0 | 595.166 3 | -0.50 | 595.166 0[M+H]+,433.024 3[M+H-glc]+,271.072 1[M+H-2glc]+ | C27H30O15 | emodin-di-O-glucoside[7] | A |
| 22 | 5.38 | [M+H]+ | 285.078 4 | 285.076 3 | 7.37 | 285.078 4[M+H]+,270.899 6[M+H-CH3]+ | C16H12O5 | 毛蕊异黄酮[12] | A |
| 23 | 8.45 | [M+H]+ | 913.500 7 | 913.516 1 | -9.20 | 913.500 7[M+H]+,935.330 1[M+Na]+ | C47H76O17 | astragaloside Ⅷ[7,12] | A |
| 24 | 0.81 | [M+H]+ | 104.108 1 | 104.107 5 | 5.76 | 104.108 1[M+H]+,60.081 5[M+H-C2H5O]+ | C5H13NO | choline[13] | A |
| 25 | 0.87 | [M+H]+ | 136.063 1 | 136.062 3 | 5.88 | 136.063 1[M+H]+,119.017 7[M+H-NH3]+,92.956 9[M+H-NH3-HCN]+ | C5H5N5 | adenine[7] | A |
| 26 | 1.64 | [M+H]+ | 268.104 3 | 268.104 6 | -1.12 | 268.104 3[M+H]+,136.935 3[M+H-ribose]+,119.809 7[M+H-ribose-NH3]+ | C10H13N5O4 | adenine nucleoside[7] | A |
| 27 | 18.17 | [M+H]+ | 643.219 0 | 643.223 8 | -7.46 | 643.219 0[M+H]+,665.442 4[M+Na]+ | C29H38O16 | isomucronulatol-2′,5′-di-O- glucoside[7] | A |
| 28 | 5.92 | [M+H]+ | 195.064 0 | 195.065 7 | -8.72 | 195.064 0[M+H]+,177.054 6[M+H-H2O]+,149.023 3[M+H-CH2O2]+,117.035 1[M+H-CH2O2-CH3OH]+ | C10H10O4 | 异阿魏酸[7] | A |
| 29 | 5.38 | [M+H]+ | 447.127 5 | 447.129 1 | -3.58 | 447.127 5[M+H]+,285.071 0[M+H-glc]+,270.059 4[M+H-glc-CH3]+ | C22H22O10 | calycosin-7-O-glucoside[7,12] | A |
| 30 | 8.57 | [M+H]+ | 943.519 5 | 943.526 6 | -7.52 | 943.519 5[M+H]+,965.356 3[M+Na]+ | C48H78O18 | soyasaponin I[7,10] | A |
| 31 | 18.37 | [M+NH4]+ | 803.500 1 | 803.503 1 | -3.73 | 803.500 1[M+NH4]+,807.254 3[M+NH4+Na]+ | C41H68O14 | 黄芪甲苷Ⅳ[12] | A |
| 32 | 4.51 | [M+H]+ | 342.172 5 | 342.170 5 | 5.85 | 342.172 5[M+H]+,297.115 2[M+H-C2H7N]+,282.093 4[M+H-C2H7N-CH3]+,265.080 8[M+H-C2H7N-MeOH]+ | C20H23NO4 | 木兰黄碱[14-15,19-20] | C |
| 33 | 7.22 | [M+H]+ | 322.107 8 | 322.107 9 | -0.31 | 322.107 8[M+H]+,279.087 7[M+H-CH3-CO]+,307.086 1[M+H-CH3]+ | C19H15NO4 | groenlandicine[16] | C |
| 34 | 7.41 | [M+H]+ | 352.120 7 | 352.118 5 | 6.25 | 352.120 7[M+H]+,703.219 7[2M+H]+ | C20H17NO5 | berberastine[17,21] | C |
| 35 | 7.45 | [M+H]+ | 368.151 7 | 368.149 8 | 5.16 | 368.151 7[M+H]+,735.229 2[2M+H]+ | C21H21NO5 | lincangenine[21] | C |
| 36 | 5.99 | [M+H]+ | 324.124 8 | 324.123 6 | 3.70 | 324.124 8[M+H]+,647.178 0[2M+H]+ | C19H17NO4 | demethylene-berberine[23-24] | C |
| 37 | 5.06 | [M+H+NH4]+ | 325.115 9 | 325.118 8 | -10.38 | 325.115 9[M+H+NH4]+,308.089 1[M+H]+,615.141 8[2M+H]+ | C18H13NO4 | lycoranine B[21] | C |
| 38 | 6.71 | [M+H]+ | 338.138 3 | 338.139 2 | -2.66 | 338.138 3[M+H]+,294.112 6[M-CH3-CO]+,323.111 6[M+H-CH3]+ | C20H19NO4 | 非洲防己碱[14-17] | C |
| 39 | 6.72 | [M+H]+ | 336.126 3 | 336.123 6 | 8.03 | 336.126 3[M+H]+,320.097 3[M+H-CH4]+,292.102 0[M+H-CH4-C2H4]+ | C20H17NO4 | 表小檗碱[22-24] | C |
| 40 | 6.90 | [M+H]+ | 320.089 4 | 320.092 3 | -9.06 | 320.089 4[M+H]+,292.102 0[M+H-CO]+ | C19H13NO4 | 黄连碱[15-20] | C |
| 41 | 5.08 | [M+H]+ | 310.107 8 | 310.107 9 | -0.32 | 310.107 8[M+H]+,619.339 5[2M+H]+ | C18H15NO4 | thalifendine[21] | C |
| 42 | 7.63 | [M+H]+ | 352.153 5 | 352.154 9 | -3.98 | 352.153 5[M+H]+,294.112 6[M+H-2CH3-CO]+,322.107 8[M+H-2CH3]+,336.126 3[M+H-CH4]+ | C21H21NO4 | 巴马汀[14-20] | C |
| 43 | 7.72 | [M+H]+ | 336.126 3 | 336.123 6 | 8.03 | 336.126 3[M+H]+,278.082 1[M+H-2CH3-CO]+,292.094 5[M+H-C2H4O]+,306.077 0[M+H-2CH3]+,320.089 4[M+H-CH4]+ | C20H17NO4 | 小檗碱[22-23] | C |
| 44 | 8.31 | [M+H]+ | 350.140 9 | 350.139 2 | 4.86 | 350.1409[M+H]+,699.254 2[2M+H]+ | C21H19NO4 | dihydroche-lerythrine[21] | C |
| 45 | 4.05 | [M+H]+ | 291.125 3 | 291.125 9 | -2.06 | 291.125 3[M+H]+,274.007 8[M+H-OH]+,262.982 0[M+H-OH-C]+,246.004 0[M-2OH-C+2H]+ | C19H16NO4 | berberrubine[25-26] | C |
| 46 | 6.83 | [M+H]+ | 338.138 3 | 338.139 2 | -2.66 | 338.138 3[M+H]+,674.267 3[2M+H]+ | C20H19NO4 | jatrorrhizine[17,21] | C |
| 47 | 6.81 | [M+H]+ | 339.145 7 | 339.142 6 | -9.14 | 339.147 1[M+H]+,322.107 8[M-CH4]+,308.089 1[M-2CH3]+,294.112 6[M-C2H4O]+,280.102 4[M-2CH3-CO]+ | C20H20NO4 | jateorhizine[22] | C |
| 48 | 3.28 | [M-H]- | 375.127 5 | 375.129 1 | -4.27 | 213.074 5[M-glc-H]-,169.088 0[M-glc-CO2-H]-,151.027 4[M-glc-H2O-CO2-H]-,125.027 9[M-glc-H2O-CO2-C2H2-H]- | C16H24O10 | loganic acid[27,29-30] | L |
| 49 | 4.48 | [M-H]- | 357.120 4 | 357.1186 | 5.04 | 195.066 1[M-glc-H]-,149.910 0[M-glc-H2O-CO-H]-,124.988 8[M-pent-glc-C3O-H2O-H]- | C16H22O9 | sweroside[31-33] | L |
| 50 | 4.86 | [M-H]- | 403.126 4 | 403.124 0 | 5.95 | 371.101 7[M-H-32]-,223.062 9[M-glc-H2O-H]-,191.053 2[M-H-glc-H2O-32]-,164.926 6[M-H-glc-H2O-32-CO]-,121.029 7[M-H-glc-H2O-32-CO-H]- | C17H24O11 | secoxyloganin[28-30] | L |
| 51 | 1.37 | [M-H]- | 387.128 9 | 387.129 1 | -0.52 | 225.858 1[M-H-glc]-,179.054 2[M-H-glc-H2O-CO]-,155.956 1[M-H-glc-H2O-CO-24]-,123.901 9[M-H-glc-H2O-CO-24-32]- | C17H24O10 | secologanin[29-33] | L |
3.2 金芪降糖片治疗“2型糖尿病-作用靶点”的选择
以“type 2 diabetes mellitus”为关键词,通过CTD数据库查找2型糖尿病的直接作用靶点,结果中标记有“marker/mechanism/therapeutic”的靶标有6个,标记有“therapeutic”的靶标有3个。将该9个靶蛋白导入String蛋白互作数据库,选择人源物种,挖掘间接靶标,一并导入Cytoscape软件进行互作网络的拓扑学分析,共涉及21个节点,初步选择Degree数值高的直接作用靶点INS(胰岛素),过氧化物酶体增殖物激活受体γ(PPARG)和过氧化氢酶(CAT)作为分子对接的蛋白作用靶点,见图2,图3。
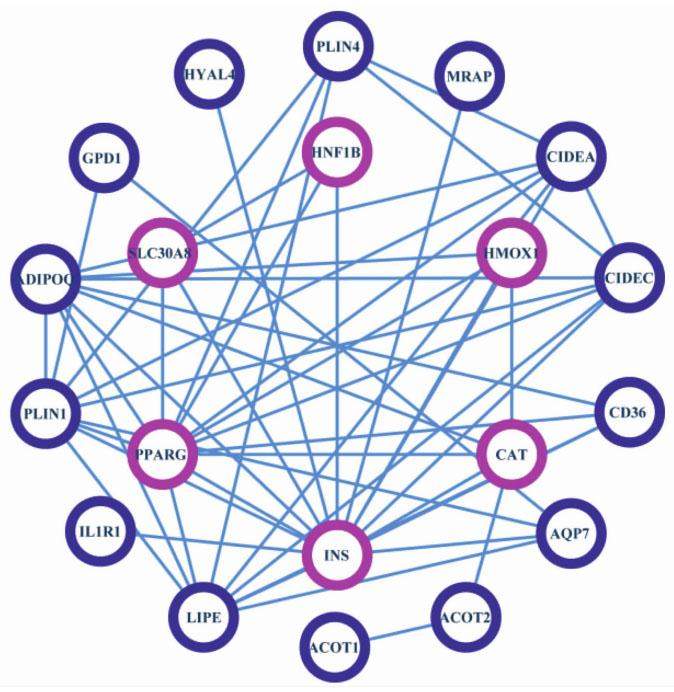
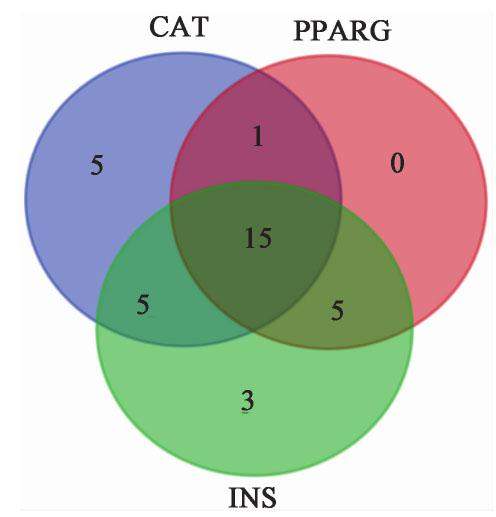
结合相关报道,胰岛素(INS)功能异常或缺乏可引起2型糖尿病[34];国外有研究发现过氧化物酶体增殖物激活受体γ(PPARG)是属于转录因子的核激素受体超家族成员,参与糖脂代谢和线粒体能量代谢调节,其与糖尿病的发生极为密切[35],同时,唐新等[36]研究显示PPARG基因单核苷酸多态性与T2DM有关,这些提示PPARG基因与T2DM,代谢综合征及脂类糖类代谢密切相关;研究证实,氧化应激与T2DM及其并发症的发生发展关系紧密,贾春新等[37]研究发现,CAT作为内源性抗氧化酶,可清除活性氧及氧化损伤代谢产物以维持细胞正常的氧化还原状态,因此,CAT在T2DM发生及发展中扮演重要角色。
本研究结合在线数据库以及相关文献的佐证,最后选择INS受体,PPARG受体和CAT受体进行下一步分子对接工作。
3.3 分子对接结果
利用AutoDock分子对接软件,将金芪降糖片中所鉴定出的51个化合物分别和CAT受体,PPARG受体和INS受体进行分子对接。对接结果以结合自由能(binding energy,ΔGbind)和估计抑制常数(inhibit constant,Ki)作为参考指标,其中ΔGbind和Ki越小表明药物小分子与蛋白质大分子受体结合越稳定。结果见表2,发现与上市的3个阳性药甲吡唑,吡格列酮和罗格列酮的分子对接结果的均值比较,结合图4发现,3个靶标蛋白质与金芪降糖片中的15个化学成分有较好的结合作用,这些成分包括木兰花碱,黄连碱,表小檗碱,黄芪甲苷,咖啡酸,巴马汀,小檗碱,药根碱,小檗红碱,berberastine,groenlandicine,lycoranine B,isomucronulatol-7-O-glucoside,demethyleneberberine和calycosin-7-O-glucoside。基于此结果,初步确定这15种成分是金芪降糖片治疗2型糖尿病潜在的药效物质基础。
| 金芪降糖片 | 编号 | 化合物名称 | CAT | PPARG | INS | |||
|---|---|---|---|---|---|---|---|---|
| ΔGbind/kcal·mol-1 | Ki/μmol·L-1 | ΔGbind/kcal·mol-1 | Ki/μmol·L-1 | ΔGbind/kcal·mol-1 | Ki/μmol·L-1 | |||
| 阳性药 | 1 | 甲吡唑 | -3.09 | 5.41 | -3.55 | 2.5 | -3.08 | 5.53 |
| 2 | 吡格列酮 | -4.08 | 1.03 | -5.14 | 169.6 | -4.82 | 293.59 | |
| 3 | 罗格列酮 | -4.63 | 400.59 | -4.80 | 269.97 | -5.17 | 162.63 | |
| 平均值 | 4 | average | -3.93 | 135.68 | -4.50 | 147.07 | -4.36 | 153.92 |
| 黄芪 | 5 | asparagine | -2.25 | 22.34 | -3.41 | 3.15 | -2.92 | 7.27 |
| 6 | disaccharide | -3.44 | 2.99 | -3.69 | 1.97 | -2.30 | 20.46 | |
| 7 | raffinose | -3.03 | 47.71 | -1.27 | 117.95 | -1.35 | 102.54 | |
| 8 | adenine | -3.74 | 1.81 | -3.87 | 1.45 | -3.02 | 6.14 | |
| 9 | syringin | -0.14 | 9.76 | -2.69 | 10.62 | -3.69 | 1.99 | |
| 10 | protocatechuic acid | -2.15 | 26.54 | -1.72 | 54.91 | -4.62 | 411.81 | |
| 11 | markhamioside F | -4.51 | 1.33 | 0.12 | -4.35 | -2.67 | 11.12 | |
| 12 | hydroxybenzoic acid | -4.92 | 245.48 | -1.87 | 42.45 | -3.10 | 5.33 | |
| 13 | 阿魏酸 | -1.94 | 37.93 | -3.38 | 3.32 | -4.26 | 759.80 | |
| 14 | rhamnocitrin 3,4′-di-O-glucoside | -4.64 | 400.0 | -1.47 | 83.34 | -4.11 | 972.50 | |
| 15 | 咖啡酸 | -5.49 | 94.64 | -4.63 | 1.26 | -4.48 | 1.20 | |
| 16 | pratensein-7-O-glucoside | -7.15 | 5.77 | -2.73 | 10.01 | -5.70 | 66.75 | |
| 17 | sinapic acid | -2.91 | 7.35 | -1.96 | 36.46 | -3.47 | 2.84 | |
| 18 | cosmosiin | -2.02 | 32.79 | -3.89 | 1.41 | -3.74 | 1.81 | |
| 19 | azelaic acid | -3.91 | 1.37 | -1.32 | 107.56 | -0.70 | 307.89 | |
| 20 | isomucronulatol-7-O-glucoside | -4.66 | 2.88 | -6.97 | 7.72 | -6.70 | 12.22 | |
| 21 | chlorogenic acid | -3.05 | 5.79 | -3.45 | 2.94 | -2.67 | 11.04 | |
| 22 | hexose | -1.62 | 64.45 | -3.25 | 4.12 | -2.54 | 13.76 | |
| 23 | leucine | -3.16 | 52.17 | -2.25 | 22.39 | -3.06 | 5.76 | |
| 24 | formononetin | -3.13 | 5.07 | -5.89 | 47.9 | -6.40 | 20.48 | |
| 25 | emodin-di-O-glucoside | -6.55 | 15.73 | -1.18 | 137.45 | -4.75 | 329.70 | |
| 26 | calycosin | -2.82 | 8.59 | -5.82 | 54.14 | -5.34 | 122.20 | |
| 27 | astragaloside Ⅷ | -8.30 | 1.87 | -9.55 | 100.24 | -3.77 | 1.72 | |
| 28 | choline | -2.14 | 26.97 | -2.27 | 21.71 | -3.23 | 4.26 | |
| 29 | adenine | -3.74 | 1.81 | -3.87 | 1.45 | -3.02 | 6.14 | |
| 30 | adenine nucleoside | -3.93 | 1.31 | -4.00 | 1.16 | -3.50 | 2.73 | |
| 31 | isomucronulatol-2′,5′-di-O-glucoside | -4.09 | 1.01 | -3.60 | 2.28 | -4.07 | 1.04 | |
| 32 | isoferulic acid | -2.13 | 7.43 | -3.37 | 3.41 | -4.70 | 360.10 | |
| 33 | calycosin-7-O-glucoside | -6.29 | 24.54 | -5.22 | 1.65 | -5.34 | 121.69 | |
| 34 | soyasaponin I | -1.79 | 8.62 | -4.78 | 312.21 | -4.96 | 231.70 | |
| 35 | 黄芪甲苷 | -7.70 | 2.25 | -10.21 | 33.01 | -6.61 | 14.25 | |
| 黄连 | 36 | 木兰花碱 | -4.73 | 338.34 | -8.30 | 43.76 | -5.65 | 71.74 |
| 37 | groenlandicine | -7.63 | 2.56 | -8.27 | 5.05 | -7.16 | 5.68 | |
| 38 | berberastine | -7.73 | 2.14 | -4.70 | 7.12 | -6.62 | 14.00 | |
| 39 | lincangenine | -6.16 | 30.42 | -0.47 | 453.74 | -5.56 | 83.60 | |
| 40 | demethyleneberberine | -6.86 | 9.40 | -7.05 | 6.81 | -6.84 | 9.61 | |
| 41 | lycoranine B | -7.63 | 2.57 | -8.50 | 87.88 | -7.34 | 4.13 | |
| 42 | columbamine | -5.25 | 141.52 | -3.43 | 3.07 | -5.32 | 126.69 | |
| 43 | epiberberine | -8.05 | 1.26 | -6.58 | 15.12 | -6.80 | 10.39 | |
| 44 | 黄连碱 | -7.57 | 2.81 | -8.27 | 18.43 | -6.72 | 11.93 | |
| 45 | thalifendine | -7.91 | 1.59 | -5.40 | 109.75 | -6.70 | 12.32 | |
| 46 | 巴马汀 | -5.71 | 65.68 | -7.41 | 5.79 | -5.44 | 103.51 | |
| 47 | 小檗碱 | -6.27 | 26.26 | -6.71 | 12.12 | -7.08 | 6.51 | |
| 48 | dihydrochelerythrine | -3.00 | 6.30 | -7.51 | 3.12 | -6.88 | 9.08 | |
| 49 | berberrubine | -7.65 | 2.48 | -5.10 | 5.22 | -7.54 | 2.98 | |
| 50 | jatrorrhizine | -1.85 | 15.62 | -7.70 | 2.27 | -6.75 | 11.36 | |
| 51 | 药根碱 | -6.57 | 15.37 | -5.28 | 135.82 | -6.34 | 22.43 | |
| 金银花 | 52 | 马钱苷酸 | -1.34 | 104.21 | -1.68 | 58.39 | -3.79 | 1.66 |
| 53 | sweroside | -2.82 | 8.58 | -2.42 | 16.83 | -5.30 | 130.96 | |
| 54 | secoxyloganin | -1.97 | 32.45 | -1.22 | 127.66 | -3.47 | 2.84 | |
| 55 | secologanin | -2.57 | 56.26 | -2.92 | 7.25 | -3.45 | 2.96 | |
4 讨论
4.1 色谱、质谱条件的优化
中药复方中的化学成分是寻找药物成分以及确认药效物质基础的关键。传统的分析方法通常采用液相色谱-紫外检测方法来检测中药中复杂的化合物,但因其所得的化合物指纹图谱往往存在灵敏度低且专一性差的特点,以致无法确认化学物质的结构信息。
本研究基于UPLC-Q-TOF-MS高分辨原位质谱平台,为了保证实验结果的准确性和可靠性,本实验对液质条件进行了一定程度的优化。本研究中,基于金芪降糖片主要3味中药(黄芪、黄连、金银花)的成分信息并结合相关文献,采用BEH C18色谱柱(2.1 mm×100 mm,美国Waters公司)和HSS T3色谱柱(2.1 mm×100 mm,美国Waters公司)进行色谱条件优化,同时对进样量和流速进行调整。最终采用BEH C18色谱柱,优化条件为柱温为40 ℃,流速为0.3 mL·min-1,进样量5 μL,在流动相中加入0.1%甲酸能够得到较好的分离度且较好的峰型。同时,为了全面地分析金芪降糖片中的化学成分,本实验分别进行了正、负离子模式的全扫描,在提取离子流图(BPI)中发现金芪降糖片中的化合物在正负离子模式下都有出峰行为,参照对照品的质谱行为,选用两种模式同时进样分析。
4.2 靶点的选择与确定
生命体是一个极其复杂的系统,各作用靶点之间互作联系,互相影响,本文基于CTD数据库查找T2DM的疾病靶点,在此基础上引入拓扑学分析策略,以degree值作为参考寻找网络关系中的核心靶点,并通过文献确证,最终确定分子对接的受体为CAT,PPARG和INS。其中PPARG受体[38]是调节目的基因表达的核内受体转录因子超家族成员,通过与目的基因增强子位点中的特异性过氧化物酶体增殖物反应元件结合,参与调控脂质代谢、胰岛素敏感性、脂肪酸转运等作用;CAT受体[39]可以改善ROS产生增加所致的PDX-1表达下降及活性改变,从而改善β细胞功能;INS受体[40]为胰岛素受体,胰岛素与胰岛素受体结合促进胰岛素受体底物的磷酸化,进而激活各种下游分子如磷脂酰肌醇3激酶,蛋白激酶B等,从而起到改善糖尿病的作用。基于以上文献报道,CAT受体,PPARG受体和INS受体均与糖尿病存在密切的关系并起到关键性的作用。该方法充分考略到靶点之间的相互作用,以数据库为龙头,以网络分析为手段,系统、快速、准确的筛选关键靶点。
4.3 分子对接在筛选药效物质基础中的重要作用
目前,中药药效物质基础的研究方法主要有谱-效关系法[41]、仿生技术法[42]及细胞膜色谱法[43]等,其中,谱-效关系法的瓶颈主要是化学成分指纹谱表征不足;仿生技术法和细胞膜色谱法在筛选过程中,活性成分可能与功能性受体及非功能性受体相结合,筛选出的活性成分不能很好代表中药发挥药效的物质基础。基于以上研究现状,本文采用分子对接技术,其可通过大规模的虚拟筛选寻找具有潜力的候选化合物,该方法节省实验操作,缩短实验时间,通过模拟药物分子与受体活性位点的相对位置和取向评价结合作用的优劣,初步筛选中药复方的药效物质基础,避免传统药效物质基础成本过高,分析物过多的不足,并为其进一步的机制研究指明方向[41]。
4.4 金芪降糖片治疗T2DM潜在药效物质基础
T2DM是由于胰岛素调控葡萄糖代谢能力的下降,并且伴随胰岛β细胞功能缺陷,从而导致胰岛素分泌减少,脂肪、碳水化合物和蛋白质代谢异常,以血糖升高为主要特征代谢性疾病[44]。在传统中医理论中,糖尿病被称为“消渴病”,消渴是因为五脏虚弱、阴虚燥热,从而引起形体消瘦、多尿、多食、多饮。禀赋不足、劳欲过度、情志失调以及饮食不节等均可能导致消渴。中药复方制剂金芪降糖片来源于《千金方》中的千金黄连丸[45],由黄连、黄芪、金银花组成,其君药为黄连,臣药为黄芪,佐使药为金银花,具有清热益气的功效,该方具有良好的降血糖、降血脂作用,临床用于治疗轻、中度非胰岛素依赖型糖尿病。
本研究通过UPLC-Q-TOF-MS和分子对接技术发现金芪降糖片治疗T2DM的药效物质基础包括木兰花碱,黄芪甲苷和咖啡酸等15种成分,其中木兰花碱,黄连碱,表小檗碱,巴马汀,小檗碱,药根碱,小檗红碱,berberastine,groenlandicine,lycoranine B,demethyleneberberine这11中成分来自于黄连,甲芪甲苷,isomucronulatol-7-O-glucoside,calycosin-7-O-glucoside这3种成分来自于黄芪,咖啡酸来自于黄芪和金银花。其中黄连中含量最高的小檗碱,具有降低T细胞与外基质的黏附能力,通过阻断炎性细胞mRNA的复制与转录,发挥抗炎作用;还可以促进胰岛β细胞再生及胰岛素释放,抑制肝脏糖原异生,促进糖酵解,从而发挥降血糖作用[46];臣药黄芪[47]是补气药,具有抗氧自由基生成、抗氧化、抗炎作用,其主要成分黄芪甲苷可通过抑制p-130Cas表达上调,抑制高糖诱导的足细胞足突融合,缓解糖尿病病变[48];佐使药金银花具有清热解毒、抗炎、抗氧化的作用,而炎症状态正是胰岛素抵抗的重要原因之一[47]。
分析结果表明,magnoflorine,caffeic acid,coptisine,epiberberine,astragaloside Ⅳ,palmatine,jateorhizine和berberine与靶点对接结果优于阳性药物平均值,与文献报道的金芪降糖片的质控成分和入血成分基本一致[49-50]。基于以上所述,整合LC-MS和分子对接技术可快速筛选中药药效物质基础,且结果与文献报道基本一致。除此之外,groenlandicine,lycoranine B,berberastine,isomucronulatol-7-O-glucoside,demethyleneberberine,calycosin-7-O-glucoside和berberrubine与靶点对接结果优于阳性药物平均值,是具有潜力的候选药效物质基础,但其是否具有良好的药物活性,还需进一步的药理学验证和活性评估。
本研究基于UPLC-Q-TOF-MS和分子对接技术,发现magnoflorine,coptisine,epiberberine,astragaloside Ⅳ,caffeic acid,palmatine,berberine,jateorhizine,berberrubine,berberastine,groenlandicine,lycoranine B,demethyleneberberine,isomucronulatol-7-O-glucoside和calycosin-7-O-glucoside为金芪降糖片治疗T2DM潜在的药效物质基础。
Identification of “multiple components-multiple targets-multiple pathways” associated with Naoxintong capsule in the treatment of heart diseases using UPLC/Q-TOF-MS and network pharmacology
[J].Evid Based Complement Alter Med,2016,doi:10.1155/2016/9468087.Bioactivity evaluation-based ultra high-performance liquid chromatography coupled with electrospray ionization tandem quadrupole-time-of-flight mass spectrometry and novel distinction of multi-subchemome compatibility recognition strategy with Astragali Radix-Fructus Corni herb-pair as a case study
[J].J Pharmaceut Biomed Anal,2016,129:514-534.UPLC-QTOF/MS analysis of alkaloids in traditional processed Coptis chinensis Franch
[J]. Evid Based Complement Alternat Med,2012,doi:10.1155/2012/942384.金芪降糖片治疗2型糖尿病胰岛素抵抗的Meta分析
[J].中国中药杂志,2019,doi:10.19540/j.cnki.cjcmm.20190401.502.
