肺癌是目前中国以及全球死亡率最高的恶性肿瘤。尽管目前有手术治疗、放化疗等多种治疗手段,但肺癌患者的总体5年生存率仅为16.1%[1]。中医认为燥热伤肺是肺癌的重要病机。肺为娇脏,喜润恶燥,患者感受燥热之邪,耗伤津液,则肺不治节,气机失调、火盛化毒,痰瘀凝聚,日久不解可导致肺癌发生,故清热润燥是肺癌的常用治法[2]。清燥救肺汤为清代名医喻嘉言《医门法律》滋养肺阴名方,该方由党参片、霜桑叶、生石膏、苦杏仁、阿胶、胡麻仁、麦冬、枇杷叶、炙甘草组成,方中重用霜桑叶质轻性寒,轻宣肺燥而不耗气;生石膏辛甘清泄肺热而不伤中;麦冬甘寒,养阴润肺,党参片益气生津;胡麻仁、阿胶助麦冬养阴润肺,苦杏仁、枇杷叶苦降肺气;加炙甘草以调合诸药。全方宣、清、润、降四法并用,清燥润肺,养阴益气,主治温燥伤肺,气阴两伤证,能较好地缓解燥热伤肺主证,故常用于肺癌中医临床治疗[3]。有氧糖酵解(Warburg效应)是恶性肿瘤的显著特征,该过程受己糖激酶2(HK2),6-磷酸果糖激酶2(PFK2),M2型丙酮酸激酶(PKM2)及乳酸脱氢酶-A等限速酶的调控。肿瘤细胞通过糖酵解途径产生三磷酸腺苷(ATP)的速度比氧化磷酸化更快,可为肿瘤细胞快速增殖提供所需能量与原材料[4]。同时糖酵解还能大量产生乳酸,维持肿瘤局部酸性微环境,有利于肿瘤细胞对周围组织的浸润与转移[5]。因此,阻断糖酵解限速酶的活性,就有可能抑制肿瘤糖酵解能量代谢,减少肿瘤细胞的能量生成,从而达到抗癌目的。本课题组在前期研究中发现,清燥救肺汤能明显降低荷Lewis小鼠瘤重,抑制其肺癌细胞增殖,具有显著的抗肺癌功效[6-7],但其具体作用机制尚不明确。本研究在前期证实该方能显著抑制肺癌细胞增殖的研究基础上,拟通过建立荷Lewis小鼠肺癌小鼠模型,观察该方对肺癌细胞糖酵解关键限速酶HK2,PFK2,PKM2的影响,从抑制肺癌细胞糖酵解角度探索该方抗肺癌功效的作用机制。
1 材料
1.1 药物
清燥救肺汤组成:生石膏12 g,霜桑叶9 g,党参片12 g,炙甘草3 g,麦冬10 g,阿胶9 g,苦杏仁9 g,枇杷叶9 g,购于江西省中医院中药房,由江西中医药大学国家工程中心冯育林教授鉴定为正品。将上述中药首次加10倍清水浸泡后煎煮1 h,药液沸腾后文火煎40 min,纱布过滤;第2次加8倍量的清水煎煮,水沸后文火煎40 min,纱布过滤,合并滤液,置于60 ℃恒温烘箱内烘干后用打粉机研磨成干粉27.62 g(1 g含0.28 g杂质),故干粉实际有效成分质量为27.62×0.72=19.9 g,得率19.9 g/73 g=27.26%。密封干粉,4 ℃保存备用。药量计算方法参考《中药药理研究方法学》[8],小鼠用药剂量=标准体质量×人的剂量,人临床剂量换算成小鼠中剂量。经过前期预实验研究探索,本研究以11 g·kg-1·d-1为高剂量,清燥救肺汤中、低剂量分别为5.5,2.75 g·kg-1·d-1。腹腔注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号16092525,0.2 g/瓶),给药剂量25 mg·kg-1·d-1,隔日1次。
1.2 动物和瘤株
SPF级C57BL/6J小鼠50只,雄性,体质量(20±2)g,购自常州卡文斯实验动物有限公司,合格证号SCXK(苏)2016-0003。小鼠Lewis肺癌原代细胞,购于ATCC细胞库,编号36470TM。本实验经江西中医药大学实验动物伦理委员会审查批准,批号JZLLSC:2017-0030。
1.3 试剂
DMEM高糖培养基(北京Solarbio公司,批号20170605);胎牛血清(中国医学科学院生物医学工程研究所,批号TBD15HT);葡萄糖测定试剂盒(南京建成生物工程研究所,批号F006);trizol总RNA提取试剂盒(北京康为世纪生物科技有限公司,批号CW0581S);反转录试剂盒(北京诺博莱德科技有限公司,批号205311);PCR mix(美国MCE公司,批号HY-K0501);PFK2一抗,二抗HRP标记山羊抗兔,β-肌动蛋白(β-actin)一抗(美国Proteintech公司,批号分别为13763-1-AP,SA00001-2,20536-1-AP);PKM2酶联免疫吸附试验(ELISA)试剂盒(上海江莱生物科技有限公司,批号JL45585)。
1.4 仪器
CO2-IR型CO2细胞培养箱(上海丙林电子科技有限公司),DMI3000B型倒置显微镜(德国Leica公司),SCIENTZ-192型高通量组织研磨机(宁波新芝生物科技股份有限公司),Mini Trans-blot型PowerPacTW电泳仪及转膜仪(美国Bio-Rad公司),92-14860-00型凝胶成像系统(美国Alpha Innotech公司),HBS-1096A型全波长酶标仪(南京德铁实验设备有限公司),AFD9600型实时荧光定量PCR仪(杭州安杰思有限公司)。
2 方法
2.1 Lewis细胞培养及造模方法
将Lewis细胞于37 ℃ 5%CO2培养箱,用含10%FBS的DMEM培养基贴壁培养。取生长良好Lewis细胞用生理盐水将密度调至5×106个/mL。以0.2 mL/只接种于小鼠右腋下[9]。
2.2 分组及给药
将小鼠随机分为模型组,CTX组,清燥救肺汤高、中、低剂量组,每组10只。模型组接种24 h后,以生理盐水灌胃,0.2 mL/只,每12 h给药1次;CTX组接种24 h后,按50 mg·kg-1剂量隔日腹腔注射;清燥救肺汤组造模前2周即开始按设计剂量灌胃给药,每12 h给药1次,接种24 h后继续给药2周。
2.3 实时荧光定量PCR检测HK2 mRNA表达水平
取冰冻肿瘤组织50 mg用剪刀剪碎,用生理盐水洗净后加入trizol 1 mL,研磨至充分匀浆后以4 ℃,12 000 r·min-1离心10 min,静置5 min后,加入三氯甲烷0.2 mL,剧烈震荡30 s,静置3 min后以4 ℃,12 000 r·min-1离心10 min;在得到的水相溶液中加入等体积异丙醇,颠倒混匀后以4 ℃,12 000 r·min-1离心10 min,弃上清,留沉淀;75%乙醇对沉淀进行洗涤;再以4 ℃,12 000 r·min-1离心2 min,弃上清,留RNA沉淀;放置2~3 min,晾干后加入无核酶水30~100 μL溶解,充分溶解提取总RNA,逆转录为cDNA。再以cDNA为模板,以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参,采用两步法PCR反应程序,扩增条件:95 ℃预变性30 s,95 ℃变性10 s,61 ℃退火10 s,72 ℃延伸1 min,共40个循环。反应结束后记录相应Ct和溶解曲线,所有样品均重复检3次。以2-ΔΔCt法对目的基因进行相对定量分析。引物通过引物设计软件oligo6自行设计,见表1。
| 引物 | 序列 | 长度/bp |
|---|---|---|
| GAPDH | 上游5′-ACCACAGTCCATGCCATCAC-3′ | 452 |
| 下游5′-TCCACCACCCTGTTGCTGTA-3′ | ||
| HK2 | 上游5′-CAGAGCGCCTCAAGACAAGG-3′ | 130 |
| 下游5′-CTGTCGTCACACGTGCTCTC-3′ |
2.4 氧化酶法检测肺癌细胞葡萄糖含量
取冰冻肿瘤组织0.1 g,剪碎后置于1.5 mL离心管中,充分研磨后加入RIPA裂解液1 mL,4 ℃,12 000 r·min-1离心20 min后取上清液,按照试剂盒说明书要求操作。以505 nm波长测各孔吸光度A,葡萄糖浓度=A样品/A标准×标准浓度。
2.5 蛋白免疫印迹法(Western blot)检测移植瘤组织中PFK2蛋白表达
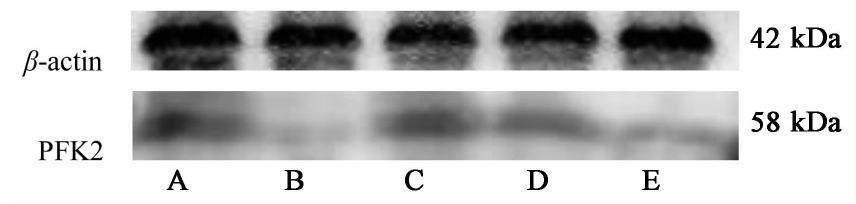
取肿瘤组织0.1 g,充分研磨后加入RIPA裂解液,冰上裂解30 min;4 ℃,12 000 r·min-1离心15 min,提取总蛋白上清液,BCA法测定蛋白浓度。根据蛋白定量结果,将蛋白样品-Loading buffer 4∶1混匀,加上样缓冲液,105 ℃变性5 min,配胶进行SDS-PAGE电泳,转膜。50 g·L-1脱脂奶粉封闭,加入一抗(1∶6 000),4 ℃过夜,洗膜3次,每次10 min,加入二抗,室温摇床孵育1 h,TBST法洗膜,ECL法显影。蛋白半定量图像分析,采用Alpha view SA图像分析软件分析蛋白条带灰度值,以β-actin作为内参分析灰度值。
2.6 ELISA检测糖酵解关键限速酶PKM2活性
取2.4项下肿瘤组织上清液,按试剂盒说明书进行操作。最后在酶标仪中以450 nm波长测定各孔的A,然后根据标准孔A绘制标准曲线,按曲线方程计算各样品浓度值。
2.7 统计学分析
所有数据均用SPSS 20.0软件分析整理,计量资料用
3 结果
3.1 清燥救肺汤对荷Lewis小鼠肺癌细胞HK2 mRNA表达及葡萄糖含量的影响
与模型组比较,清燥救肺汤高、中、低剂量组及CTX组中肺癌细胞HK2 mRNA表达降低(P<0.01);与CTX组比较,清燥救肺汤高、中、低剂量组中HK2 mRNA表达升高(P<0.05,P<0.01);与清燥救肺汤高剂量组比较,清燥救肺汤中、低剂量组中HK2 mRNA表达升高(P<0.05,P<0.01);与清燥救肺汤中剂量组比较,清燥救肺汤低剂量组中HK2 mRNA表达升高(P<0.01)。与模型组比较,清燥救肺汤高、中、低剂量组及CTX组葡萄糖含量升高(P<0.01);与CTX组比较,清燥救肺汤高、中、低剂量组葡萄糖含量降低(P<0.01);与清燥救肺汤高剂量组比较,清燥救肺汤中、低剂量组葡萄糖含量降低(P<0.05,P<0.01);与清燥救肺汤中剂量组比较,清燥救肺汤低剂量组葡萄糖含量降低(P<0.05),见表2。
| 组别 | 剂量/g·kg-1 | HK2 mRNA | 葡萄糖/mmol·L-1 |
|---|---|---|---|
| 模型 | - | 1.046±0.035 | 0.214±0.020 |
| CTX | 0.05 | 0.299±0.0421) | 0.725±0.0351) |
| 清燥救肺汤 | 11 | 0.349±0.0281,3) | 0.428±0.0131,3) |
| 5.5 | 0.440±0.0411,2,5) | 0.406±0.0111,3,4) | |
| 2.75 | 0.790±0.0401,2,4,7) | 0.387±0.0121,3,5,6) |
3.2 清燥救肺汤对荷Lewis小鼠肺癌细胞PFK2蛋白表达及PKM2活性的影响
与模型组比较,清燥救肺汤高、中剂量组及CTX组中肺癌细胞PFK2蛋白表达降低(P<0.05,P<0.01);与CTX组比较,清燥救肺汤中、低剂量组中PFK2蛋白表达升高(P<0.01);与清燥救肺汤高剂量组比较,清燥救肺汤中、低剂量组中PFK2蛋白表达升高(P<0.05,P<0.01)。与模型组比较,CTX组及清燥救肺汤高、中、低剂量组PKM2活性降低(P<0.01);与CTX组比较,清燥救肺汤高、中、低剂量组PKM2活性升高(P<0.01);与清燥救肺汤高剂量组比较,清燥救肺汤中、低剂量组PKM2活性升高(P<0.05,P<0.01);与清燥救肺汤中剂量组比较,清燥救肺汤低剂量组PKM2活性升高(P<0.05),见图1,表3。
| 组别 | 剂量/g·kg-1 | PFK2/β-actin | PKM2/μg·L-1 |
|---|---|---|---|
| 模型 | - | 0.549±0.084 | 4.310±0.549 |
| CTX | 0.05 | 0.145±0.0152) | 1.391±0.431 2) |
| 清燥救肺汤 | 11 | 0.248±0.0442) | 2.029±0.2232,3) |
| 5.5 | 0.404±0.0581,4,5) | 2.681±0.3042,4,5) | |
| 2.75 | 0.461±0.1024,6) | 3.061±0.2912,4,6,7) |
4 讨论
肺癌常见干咳少痰,甚则痰中带血或咯血,声音嘶哑等表现。中医学认为,肺为娇脏,喜润恶燥,且肺与外界直接相通,易受邪侵,导致热毒灼津,炼液为痰,日久耗伤正气,气滞血瘀,形成积块。亦有医家认为,肺癌多因汗出伤津,或燥热伤肺,或食辛辣燥热之品,或素嗜烟酒,致虚火灼津,炼液为痰,终致痰浊瘀血胶结于肺,形成积块[10]。因此,诸多医家提出燥热伤肺是肺癌的重要病机。清燥救肺汤主治温燥伤肺,气阴两伤证,与肺癌燥热病机相符,故用于肺癌各分期的中医治疗中,疗效较为显著[11]。前人研究表明,热证与能量代谢密切相关。如徐志伟等[12]发现,实热证、虚热证模型大鼠机体能量代谢都比较旺盛,机体产能和耗能增加。司惠丽[13]证实寒性中药大黄三氯甲烷提取物、大黄水煎液对实热证大鼠的能量代谢有抑制作用。
有氧糖酵解(Warburg效应)是恶性肿瘤能量代谢的明显特征,并在肿瘤的增殖与转移过程中发挥了重要作用,肿瘤组织代谢的葡萄糖是正常组的十多倍。且与氧化磷酸化相比,葡萄糖通过有氧糖酵解方式产生ATP速度更快,更能满足肿瘤细胞快速生长和分裂所需。HK2是肿瘤糖酵解过程中的第一个限速酶。HK2在快速生长的肿瘤中对启动和维持高葡萄糖代谢水平具有至关重要的作用,大部分恶性肿瘤细胞都有HK2的高表达,其活性在肿瘤细胞比正常细胞高5~7倍[14],在肿瘤细胞Warburg效应中起到关键作用。在转录水平,缺氧条件等都可以增强该基因的启动子的活性,从而增加其转录速率[15]。在本实验中,PCR结果显示清燥救肺汤高、中、低剂量组HK2 mRNA表达均低于模型组,且清燥救肺汤高、中、低剂量组中肺癌细胞内葡萄糖含量高于模型组,提示清燥救肺汤可能通过降低HK2 mRNA表达,减少HK2生成,进而减少肺癌细胞葡萄糖摄取。
PFK2是合成2,6二磷酸果糖(2,6-diphosphate fructose,F-2,6-P2)的限速酶,广泛存在于生物细胞中。2,6二磷酸果糖是糖酵解的重要刺激剂,PFK2可通过影响2,6-二磷酸果糖水平实现对糖酵解通路调节,其表达增多可促进细胞糖酵解,生成大量乳酸和ATP,以满足肿瘤细胞增殖对能量的快速需求[16]。本实验中Western blot结果显示,清燥救肺汤高、中剂量组中肺癌细胞PFK2蛋白表达量低于模型组,提示清燥救肺汤抑制肺癌增殖,PFK2可能是其效应靶点之一。
PKM2是糖酵解途径最后一个限速酶。PKM有两种异构体:PKM1和PKM2,其中PKM2与肿瘤能量代谢密切相关,其在多种肿瘤和高度增殖的细胞中具有较高表达[17]。PKM2还能够为肿瘤细胞提供充足的中间代谢产物,以满足肿瘤细胞快速分裂所需,并避免氧化应激损伤。同时,PKM2能够进入细胞核内,作为共转录因子和蛋白激酶调节转录[18-19]。本实验中ELISA结果显示,清燥救肺汤高、中、低剂量组中PKM2活性低于模型组,提示清燥救肺汤抑制肺癌增殖,PKM2可能是其效应靶点之一。
综上所述,清燥救肺汤能抑制荷Lewis肺癌细胞增殖,并降低肺癌细胞葡萄糖摄取速率,糖酵解关键限速酶HK2,PFK2,PKM2可能是其效应靶点。本次研究结果提示清燥救肺汤抗肺癌可能与其抑制肺癌细胞糖酵解关键酶有关,但该方对上述糖酵解关键限酶的调控机制仍需进一步的研究。

