多发性硬化(multiple sclerosis,MS)是由T细胞介导的中枢神经系统炎性脱髓鞘疾病,具有时间和空间多发的特点,主要表现为视力、运动、感觉以及直肠/膀胱功能障碍的一种或几种症状组合[1]。在临床类型中,复发缓解型多发性硬化(relapsing-remitting multiple sclerosis,RRMS)最常见,占MS疾病类型的80%以上[2]。中医学认为,RRMS患者以肾虚为主,在肾气亏虚的基础上,若遇湿热久羁,则易化生浊毒,损伤督络,导致疾病反复发作[3]。目前RRMS肾虚湿热证的生物学基础尚不明确,而血清学指标的筛选对于阐释RRMS肾虚湿热证患者的人群特征具有重要价值。
血清神经丝轻链蛋白(NfL)是一种大量表达于有髓轴突的蛋白,在炎症、神经退行性变导致中枢神经系统轴突损伤时,NfL大量释放于脑脊液和血液中[4]。多项研究[5-7]证实,血清NfL水平与MS的发生、发展及预后存在显著关联。程序性死亡受体1(PD-1)与程序性死亡配体1(PD-L1)结合后能够有效抑制T细胞功能,对机体免疫应答发挥负性调节作用[8-9]。既往研究发现,MS患者外周血单核细胞的膜型程序性死亡受体1(mPD-1)和膜型程序性死亡配体1(mPD-L1)的蛋白和转录水平在疾病发作期和缓解期均低于健康者,且发作期水平低于缓解期[10-11];可溶型程序性死亡受体1(sPD-1)和可溶型程序性死亡配体1(sPD-L1)通过与mPD-1和mPD-L1结合,可阻断mPD-1/mPD-L1免疫抑制信号通路,从而促进T细胞的活化和相关免疫炎症反应[12]。因此,本研究利用高通量、超灵敏的单分子阵列分析(SIMOA)蛋白质检测技术检测RRMS患者和健康者血清NfL、sPD-1、sPD-L1的水平,并分析其与RRMS肾虚湿热证的相关性,以期从神经损伤和免疫炎症角度阐释RRMS肾虚湿热证的血清学特征。本研究通过北京中医药大学东直门医院伦理委员会批准(批准号:2021DZMEC-039-02)。
1 资料
1.1 研究对象
回顾性选取北京中医药大学东直门医院多发性硬化专病门诊2018年5月至2021年7月诊治的27例RRMS患者作为RRMS组,选取同时期招募的与RRMS患者例数、性别和年龄匹配的健康志愿者26例作为健康组。
1.2 诊断标准
RRMS西医诊断标准参照《多发性硬化诊断和治疗中国专家共识(2018版)》[13]制定。
1.3 纳入标准
RRMS组:符合上述西医诊断标准,处于疾病缓解期[13];年龄18~65岁,性别不限,病程<30年;采血前1个月内无应用激素、免疫抑制剂、疾病修正治疗药物及中药史;采血1周前无吸烟、饮酒史;女性志愿者经期1周以后;患者或其法定代理人签署知情同意书。
健康组:年龄18~65岁,性别不限;既往无特殊服药史如免疫调节剂等,无任何病史;采血1周前无吸烟、饮酒史;女性志愿者经期1周以后;签署知情同意书。
1.4 排除标准
合并严重心、肝、肾功能不全及其他影响生命体征平稳的疾病;合并恶性肿瘤及严重免疫功能缺陷疾病;仍处于活动期的传染性疾病患者;合并任何病毒、细菌、真菌等急性感染;妊娠期或哺乳期女性;不能配合采血,以及研究者认为不适合参加该研究的任何其他情况。
2 方法
2.1 临床资料采集
采集两组受试者的人口学信息(性别、年龄),采集RRMS组患者临床信息包括首次发病日期、发作次数(从首次发病到采血时点的总发作次数),并采用扩展残疾量表(EDSS)[13]评估患者神经功能损伤情况。根据《中医内科常见病诊疗指南·中医病证部分》[14]中的相关标准将RRMS组患者分为肾虚湿热证亚组及肾虚非湿热证亚组。
2.2 血清NfL、sPD-1、sPD-L1水平检测
两组受试者均空腹抽取静脉血3 ml,静置后4 ℃、3000 r/min离心10 min(离心半径:12.5 cm),取上清液保存于-80 ℃冰箱备用。应用NfL、sPD-1、sPD-L1检测试剂盒(货号分别为101457、102929、102648,Quanterix公司),利用simoa HD-1数字式单分子免疫阵列分析仪(Quanterix公司)检测血清NfL、sPD-1、sPD-L1水平。
2.3 统计学方法
采用SPSS 21.0、GraphPad Prism 8、JMP 13.0软件进行统计学分析。本研究计量资料均为非正态分布数据,采用中位数(四分位数)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验。计数资料以频数和百分比描述,采用Fisher's 精确检验。采用Spearman法对血清NfL、sPD-1、sPD-L1水平之间的相关性,以及以上指标与病程、发作次数、EDSS评分的相关性进行分析。以P<0.05为差异有统计学意义。
3 结果
3.1 各组受试者一般资料比较
RRMS组中男7例,女20例,平均年龄45.1(32.5,52.0)岁,平均病程56.4(12.9,140.7)个月,平均发作次数2.0(1.0,4.0)次;共有24例患者进行了EDSS评分,平均EDSS评分1.5(1.0,2.0)分。健康组中男8例,女18例,平均年龄36.5(24.0,47.3)岁。两组受试者性别分布、年龄比较差异均无统计学意义(P = 0.766,P = 0.159),具有可比性。
表1示,RRMS患者中肾虚湿热证亚组9例、肾虚非湿热证亚组18例,两亚组患者性别分布、年龄、病程、发作次数及EDSS评分比较差异均无统计学意义(P>0.05)。
| 组别 | 性别(女) /例(%) | 年龄 /岁,M(P25,P75) | 病程 /月,M(P25,P75) | 发作次数 /次,M(P25,P75) | EDSS评分 /分,M(P25,P75) |
|---|---|---|---|---|---|
| P值 | 0.363 | 0.930 | 0.085 | 0.089 | 0.876 |
| 肾虚湿热证亚组 | 8(88.9)[9] | 48.2(32.2,52.6)[9] | 131.9(66.1,145.0)[9] | 4.0(2.0,6.0)[9] | 1.5(1.0,3.5)[8] |
| 肾虚非湿热证亚组 | 12(66.7)[18] | 44.7(33.3,50.4)[18] | 31.4(7.2,127.2)[18] | 2.0(1.0,3.0)[18] | 1.5(1.0,2.0)[16] |
3.2 各组受试者血清NfL、sPD-1、sPD-L1水平比较
表2示,RRMS组患者血清NfL、sPD-1、sPD-L1水平均显著高于健康组(P<0.05或P<0.01)。表3示,肾虚湿热证亚组患者血清NfL、sPD-1、sPD-L1水平均显著高于肾虚非湿热证亚组患者(P<0.05或P<0.01)。
| 组别 | 例数 | NfL | sPD-1 | sPD-L1 |
|---|---|---|---|---|
| P值 | <0.001 | 0.010 | 0.008 | |
| RRMS组 | 27 | 13.3(6.7,19.9) | 115.7(86.6,163.7) | 56.4(12.9,140.7) |
| 健康组 | 26 | 5.7(4.5,7.5) | 34.4(23.3,143.6) | 35.7(32.8,38.6) |
| 组别 | 例数 | NfL | sPD-1 | sPD-L1 |
|---|---|---|---|---|
| P值 | 0.001 | 0.027 | 0.041 | |
| 肾虚湿热证亚组 | 9 | 30.8(19.1,38.3) | 172.5(140.2,184.1) | 43.7(41.2,48.6) |
| 肾虚非湿热证亚组 | 18 | 10.2(5.6,13.8) | 106.7(76.6,135.0) | 38.9(35.1,40.1) |
3.3 RRMS患者血清NfL、sPD-1、sPD-L1水平之间及其与病程、发作次数、EDSS评分相关性分析结果
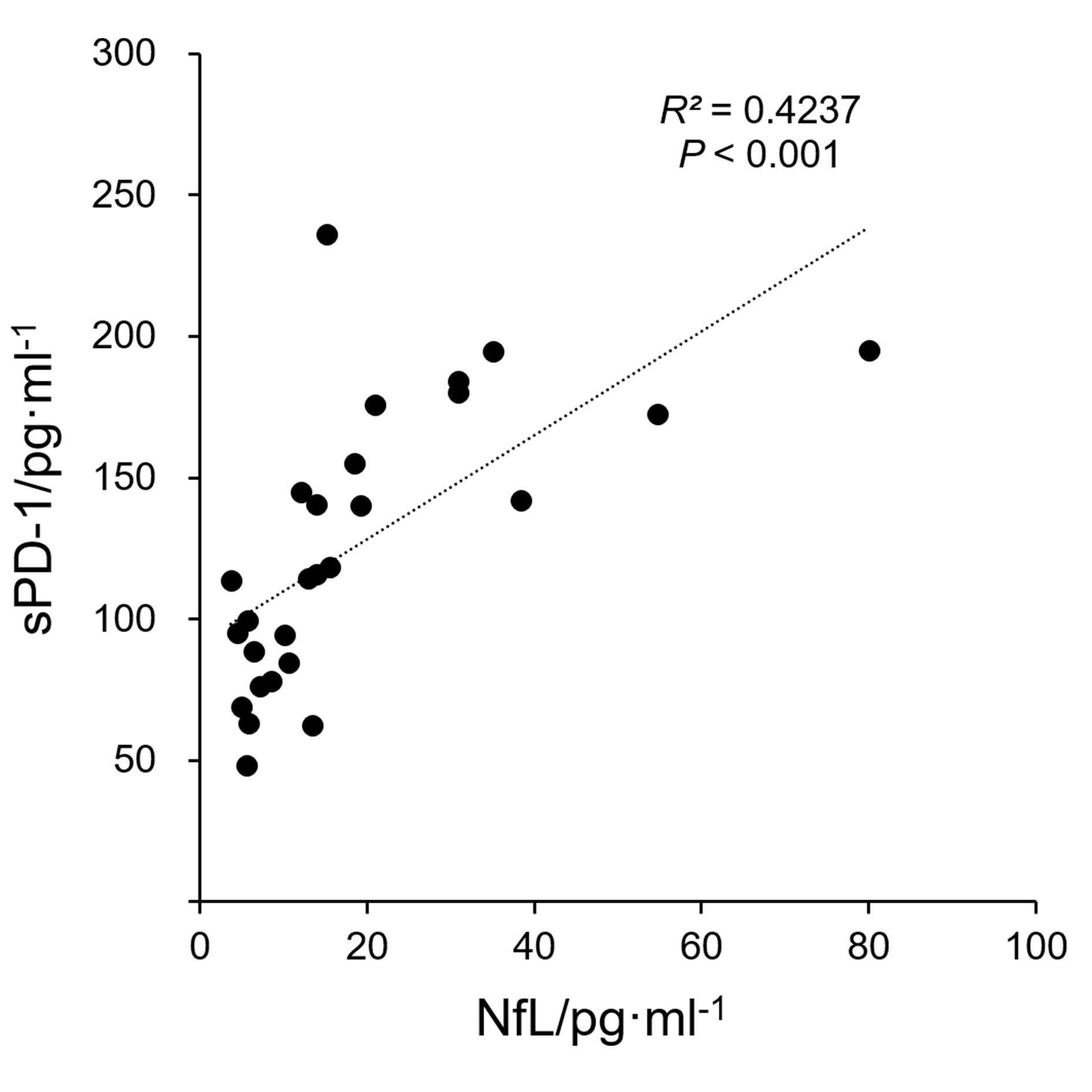
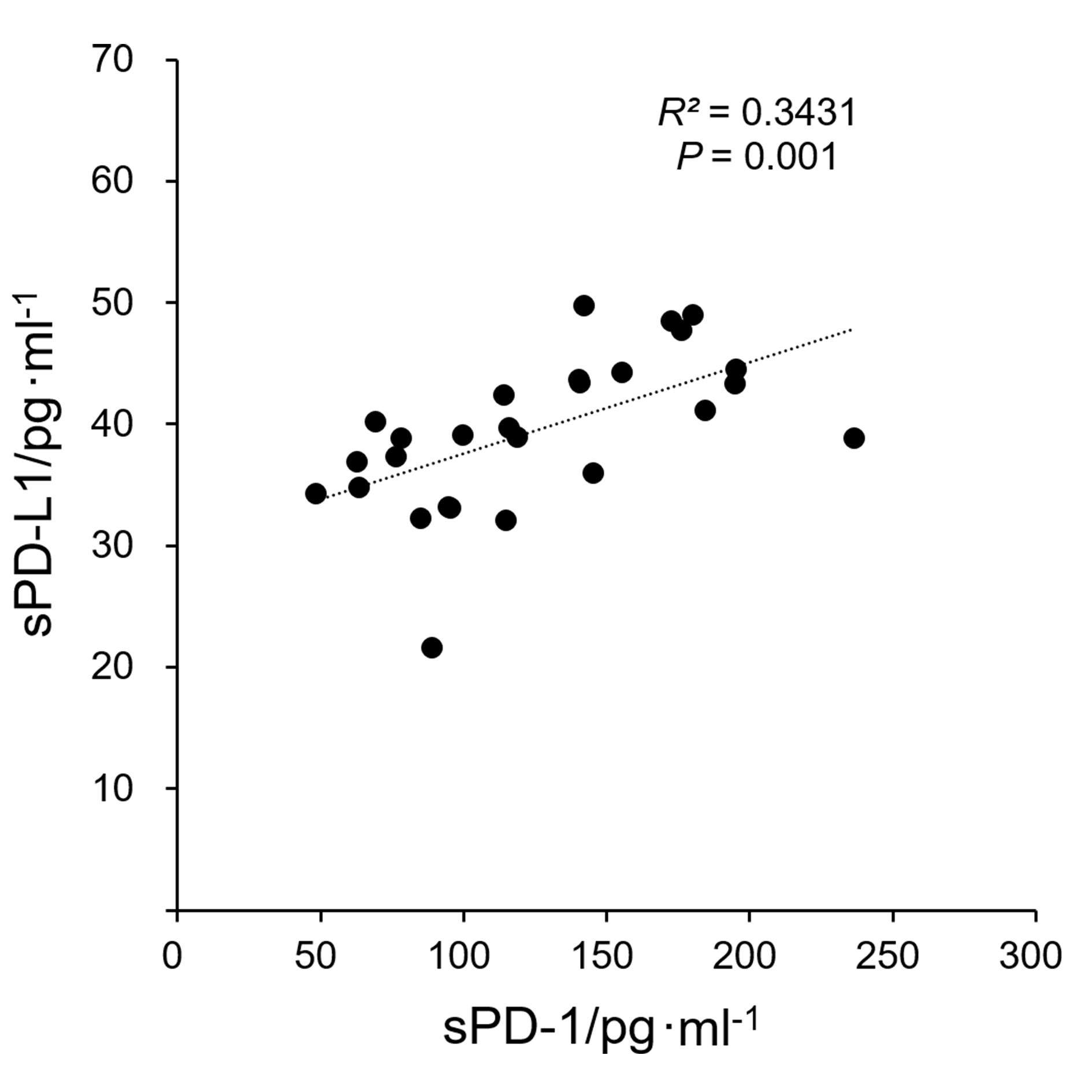
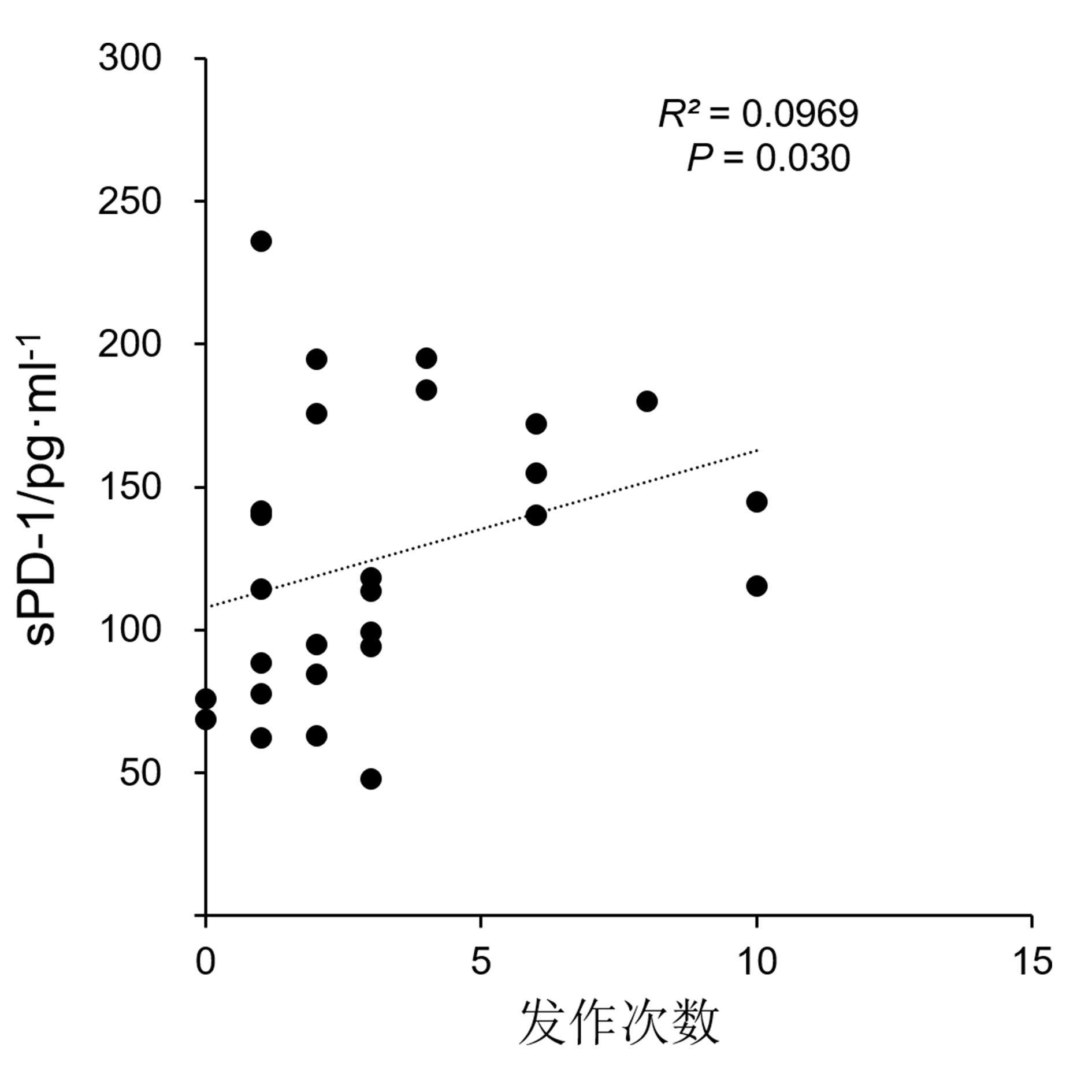
表4示,RRMS组患者血清NfL水平与sPD-1、sPD-L1水平均呈正相关(P<0.001),sPD-1水平与sPD-L1水平呈正相关(P<0.001)。表5示,RRMS患者血清sPD-1水平与发作次数呈正相关(P = 0.030),血清NfL、sPD-1、sPD-L1水平与病程、EDSS评分无明显相关性(P>0.05)。有相关性结果指标的相关性分析散点图见图1。
| 项目 | 例数 | NfL | sPD-1 | sPD-L1 | |||
|---|---|---|---|---|---|---|---|
| R2 | P 值 | R2 | P 值 | R2 | P 值 | ||
| NfL | 27 | — | — | 0.4237 | <0.001 | 0.3370 | <0.001 |
| sPD-1 | 27 | 0.4237 | <0.001 | — | — | 0.3431 | <0.001 |
| sPD-L1 | 27 | 0.3370 | <0.001 | 0.3431 | <0.001 | — | — |
| 项目 | 组别 | 例数 | NfL | sPD-1 | sPD-L1 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| R2 | P 值 | R2 | P 值 | R2 | P 值 | |||||
| 病程 | RRMS组 | 27 | 0.0028 | 0.696 | 0.0011 | 0.647 | 0.0168 | 0.240 | ||
| 肾虚湿热证亚组 | 9 | 0.1072 | 0.433 | 0.1748 | 0.356 | 0.0303 | 0.460 | |||
| 肾虚非湿热证亚组 | 18 | 0.0058 | 0.570 | 0.0010 | 0.829 | 0.0159 | 0.505 | |||
| 发作次数 | RRMS组 | 27 | 0.0572 | 0.094 | 0.0969 | 0.030 | 0.0755 | 0.102 | ||
| 肾虚湿热证亚组 | 9 | 0.0183 | 0.729 | 0.1212 | 0.359 | 0.1574 | 0.290 | |||
| 肾虚非湿热证亚组 | 18 | 0.0695 | 0.866 | 0.0484 | 0.447 | 0.0210 | 0.223 | |||
| EDSS评分 | RRMS组 | 24 | 0.0143 | 0.572 | 0.0843 | 0.314 | <0.0001 | 0.190 | ||
| 肾虚湿热证亚组 | 8 | 0.0177 | 0.816 | 0.0024 | 0.476 | 0.1004 | 0.682 | |||
| 肾虚非湿热证亚组 | 16 | 0.0002 | 0.199 | 0.1556 | 0.288 | 0.0114 | 0.078 | |||
复发缓解型多发性硬化缓解期患者血清NfL、sPD-1和sPD-L1水平之间以及血清sPD-1与发作次数的相关性分析散点图

4 讨论
湿热之邪作为RRMS病理过程中重要的致病因素,贯穿RRMS发展过程始终。既往研究亦表明,湿热之邪是RRMS反复发作、迁延不愈的重要因素[15-16];从现代医学角度分析,疾病反复发作与过度活化的免疫炎症密切相关,并导致患者出现严重的神经损伤[17]。
NfL是构成神经元轴突中间纤维的特异性分子蛋白,是神经元细胞骨架的重要成分,当炎症等导致中枢神经系统髓鞘和轴突损伤时,NfL大量释放于脑脊液并通过受损的血脑屏障入血,故目前血清NfL已成为评价神经损伤公认的生物标志物[4]。本研究结果证实,RRMS患者血清NfL水平明显高于健康者,且RRMS肾虚湿热证患者血清NfL水平高于肾虚非湿热证患者,提示RRMS患者较健康者存在显著的神经损伤,且肾虚湿热证患者的神经损伤程度较肾虚非湿热证患者更为严重。
研究[12,18]显示,MS患者外周血单核细胞、CD4+T、CD8+T细胞的mPD-1、mPD-L1水平显著低于健康者,且mPD-1水平与EDSS评分呈负相关。本研究结果显示,RRMS患者血清sPD-1、sPD-L1水平均明显高于健康者,肾虚湿热证患者血清sPD-1、sPD-L1水平高于肾虚非湿热证患者。相关性分析结果显示,RRMS患者sPD-1水平与sPD-L1水平呈正相关,提示两者在RRMS免疫失衡中密切相关;sPD-1、sPD-L1水平均与NfL水平呈正相关,且sPD-1水平与发作次数呈正相关,说明RRMS患者神经损伤和临床复发可能与sPD-1、sPD-L1升高导致的T细胞活化和炎症反应相关。
综上所述,本研究通过检测血清NfL、sPD-1、sPD-L1水平,从神经损伤和免疫炎症角度对RRMS肾虚湿热证的血清学特征进行初步探讨,结果提示RRMS肾虚湿热证患者可能存在更为明显的免疫炎症和神经损伤。尽管研究中纳入的RRMS患者例数较少,且只对疾病缓解期患者的血清样本进行了检测,但该结果仍对RRMS肾虚湿热证的血清学特征具有一定区分性。后续我们将分别于疾病的发作期和缓解期采集更多RRMS患者血清样本,一方面观察患者的证候演变,另一方面结合相关细胞和动物实验对本研究结果予以验证并对其作用机制进行深入探讨。
PD-1/PD-L1 axis as a potential therapeutic target for multiple sclerosis: a t cell perspective
[J]. Front Cell Neurosci, 2021, 15: 716747.doi: 10.3389/fncel.2021.716747.Inflammation in multiple scle-rosis
[J]. Ther Adv Neurol Disord, 2021,14:17562864211007687.doi: 10.1177/17562864211007687.CTLA-4, PD-1 and TIM-3 expression predominantly downregulated in MS patients
[J]. J Neuroimmunol, 2018, 323: 105-108.doi: 10.1016/j.jneuroim. 2018. 08.004.刘佳,孔令博,贾珍等.复发缓解型多发性硬化缓解期患者血清NfL、sPD-1、sPD-L1与肾虚湿热证的相关性[J].中医杂志,2023,64(01):37-42.
LIU Jia,KONG Lingbo,JIA Zhen,et al.Correlation between Serum NfL, sPD-1, sPD-L1 and the Syndrome of Kidney Deficiency and Damp-heat in Relapsing-remitting Multiple Sclerosis Patients during the Remission Period[J].Journal of Traditional Chinese Medicine,2023,64(01):37-42.

